Больное горло, казалось бы, вылечить просто. Пополоскал травяными отварами, и нет проблем. Но иногда ситуация настолько критичная, что гомеопатия здесь бесполезна. Приходится применять более радикальные меры – использовать антибактериальные медикаменты. Многие считают, что антибиотики – это выход из положения. Но так ли это? Какие опасности и достоинства таят антибиотики от горла? Давайте разбираться.
Назначать антибиотики должен только врач.
Когда необходим антибиотик?
Антибиотики при боли в горле имеют смысл тогда, когда причиной заболевания становятся размножившиеся бактерии. Избавится от них можно только с помощью антибиотиков. Чтобы установить точный диагноз, пациенту требуется сдать анализ крови, а также мазок из зева. Высокий уровень лейкоцитов в крови свидетельствует о развивающемся недуге.
К антибиотикам прибегают при таких симптомах воспаленных дыхательных путей:
- сильные болезненные ощущения;
- постоянное повышение температуры;
- опухание миндалин;
- появление налета, или гноя на верхних дыхательных путях;
- боли в подчелюстной части лица;
- опухлость лимфатических узлов;
- , трудное дыхание при кашле.
Правила применения
Антибактериальные препараты имеют большой вес у эскулапов, считаются панацеей от многих серьезных заболеваний. Но они также могут навредить. Чтобы этого избежать, во время лечения антибиотиками нужно строго придерживаться правил применения, выполнять рекомендации лечащего доктора. Перечислим данные правила:

Антибиотики при заболевании горла
Антибактериальные средства назначаются взрослым при таких заболеваниях верхних дыхательных путей бактериального происхождения:
- ангина;
- тонзиллит;
- ларингит;
- фарингит.
Если не прибегнуть при данных заболеваниях к антибиотикам, можно заработать осложнения в виде паратонзилярного абсцесса, отита, воспаления легких, или отита.
Антибиотики также применяются при усложненном заболевании верхних дыхательных путей у детей. Многие родители против такого лечения. Но они должны понимать, что отказ от подобного лечения детей может привести к пагубным последствиям.
Только доктор устанавливает диагноз, принимает решение, какими антибактериальными препаратами осуществлять лечение детей.
Как выбрать?
Для болезней верхних дыхательных путей применяют четыре группы антибиотиков:
- пенициллины;
- макролиды;
- линкозамиды;
- цефалоспорины.
Для взрослых, страдающих заболеваниями верхних дыхательных путей, антибиотики выпускаются в виде таблеток, капсул. Для детей идет порошок, из которого готовится суспензия. Это удобно для домашнего лечения, когда заболевание не требует госпитализации.
Пенициллиновые антибиотики
 Пенициллиновую группу назначают чаще всего.
Пенициллиновую группу назначают чаще всего. - Амоксициллин эффективно справляется с болезнетворными бактериями, обладает широким спектром действия. Прекрасно абсорбируется, отлично взаимодействует с желудочным соком. Имеет полусинтетическую основу. Побочные действия практически отсутствуют.
- Бициллин-5 хорошо справляется с размножением микроорганизмов, но слаб перед грамотрицательными бактериями. Надолго устраняет противника, предотвращает появление осложнений.
- Ампициллин отлично борется со стафилококками, а также стрептококками. Обладает большим спектром воздействия. Стоит недорого. Разрешен для лечения детей грудного возраста. Но людям, страдающим почечной недостаточностью, или аллергией его принимать нельзя.
- обеспечивает быстрое, эффективное лечение тонзиллита. Прекрасно справляется с инфекцией. Из побочных действий имеет только высыпания, колебание артериального давления, снижение веса. Является комбинированным препаратом.
Макролиды
- Эритромицин применяется от . По характеристикам подобен пенициллиновым антибиотикам. Благодаря малой токсичности, данный препарат разрешается принимать беременным.
- Спирамицин эффективно устраняет инфекции дыхательных путей. Является щадящим, малотоксичным антибиотиком. Но беременным, кормящим противопоказан.
Линкозамиды
- Линкомицин хорошо зарекомендовал себя во время лечения верхних дыхательных путей. Применяется против .
- Клиндамицин лечит исключительно ангину, развитую на основе бета-гемолитического стрептококка. Врачи любят этот препарат. Он обладает большой скоростью проникновения внутрь тканей, отличается тотальным уничтожением болезнетворных микроорганизмов. Из-за быстрого периода полувыведения его следует принимать четыре раза за сутки. Этот антибиотик называют также Клиндацином, или Далацином.
Антибиотики местного применения
 Биопарокс - антибиотик в форме спрея.
Биопарокс - антибиотик в форме спрея. В антибиотиках местного назначения есть своя прелесть. Они выпускаются в форме леденцов, спрея, что облегчает взрослым пациентам пользование ими. Среди таких препаратов выделяют:
- Биопорокс считается одним из самых эффективных антибиотиков местного назначения. Аэрозоль Биопорокс эффективно снимает воспаление горла. Биопорокс лечит ангину, фарингит. Благодаря компактности Биопороксом можно пользоваться где угодно.
- Трахисан - самый популярный местный антибиотик на сегодняшний день.
Способствует уничтожению любых видов бактерий, снимает боль, воспаление. Его составляющие:
- Тиротрицин – основной компонент данного препарата.
- Лидокаина гидрохлорид – местный анестетик.
- Хлоргексидин – средство от бактерий любого происхождения.
- Граммицидин - местный антибактериальный препарат, эффективно избавляющий взрослых пациентов от ангины, тонзиллита. Не вызывает привыкание к себе бактерий.
- Стопангин - эффективный местный препарат от заболеваний горла. Разработан на основе антибиотика бензокаина. Выпускается в форме и спрея.
- Фарингосепт – таблетки для рассасывания, основной составляющей которых является амбазон. Препарат за считанные дни устраняет все болезнетворные микробы в горле. Рекомендуется как взрослым, так и для детей.
Патологии ЛОР-органов часто бывают причиной обращений пациентов к врачам общей специализации и отоларингологов. Преимущественно заболевания возникают в холодную пору года, когда возникают благоприятные условия для распространения респираторных инфекционных патологий.
Очень большая часть из них вызвана различными бактериальными возбудителями, которые поражают слизистую оболочку верхних дыхательных путей. Именно в таких ситуациях необходимо назначать антибиотики при ЛОР заболеваниях у взрослых.
Антибактериальные препараты - это группа медикаментов, которые способны угнетать жизнедеятельность различных бактерий. Их механизм действия бывает двух типов:
- Бактерицидным - когда антибиотик способен нарушать целостность клеточных мембран патогенных бактерий, что приводит к их лизису.
- Бактериостатическим - действующее вещество угнетает синтез белка рибосомами, что делает невозможным дальнейшее размножение микрофлоры. Одновременно повышается их чувствительность к защитным иммунным реакциям организма.
 Большинство антибиотиков при ЛОР-заболеваниях назначают перорально. Таким образом, большую роль также имеет биодоступность препарата - показатель (в процентах), который характеризует, какая часть принятого медикамента проходит в системный кровоток. На него влияет время приема антибактериального средства, применение других препаратов, наличие острых или хронических патологий у пациента.
Большинство антибиотиков при ЛОР-заболеваниях назначают перорально. Таким образом, большую роль также имеет биодоступность препарата - показатель (в процентах), который характеризует, какая часть принятого медикамента проходит в системный кровоток. На него влияет время приема антибактериального средства, применение других препаратов, наличие острых или хронических патологий у пациента.
Применение антибиотиков в клинической практике позволило значительно улучшить прогноз даже для самых сложных пациентов. Страх многих больных и их родственников нежелательных эффектов этих препаратов часто очень преувеличен. Поэтому важна роль врача - доступно объяснить больному или его родственникам о необходимости антибактериальной терапии.
Правила подбора антибиотика при ЛОР-патологии
На выбор антибактериального средства лечащим врачом для конкретного пациента влияют несколько факторов. В первую очередь - специфичность бактериальных возбудителей при заболеваниях ЛОР-органов у взрослых.
Как показали многочисленные исследования, наиболее часто причиной их возникновения бывают стафилококки, стрептококки, менингококки, коринебактерии, гемофильная палочка, энтеробактерии, моракселлы и синегнойная палочка.
Поэтому необходимо подбирать антибиотики, которые были б максимально эффективными против данной микробной флоры.
Второй важный фактор - общее состояние больного, наличие осложнений, пороков развития или хронических патологий у пациента. При сравнительно легких патологиях, отсутствии риска возникновения неблагоприятных событий, лечение начинают с более распространенных антибиотиков (пенициллинов, макролидов, цефалоспоринов первых поколений).
 Если у пациента есть хронические патологии (сахарный диабет, иммунодефицитные состояния, ишемическая болезнь сердца, тромбоэмболические патологии, функциональные нарушения печени или почек), тяжелые осложнения (генерализация инфекционного процесса - сепсис) - отдают преимущество более узкоспециализированным антибактериальным препаратам.
Если у пациента есть хронические патологии (сахарный диабет, иммунодефицитные состояния, ишемическая болезнь сердца, тромбоэмболические патологии, функциональные нарушения печени или почек), тяжелые осложнения (генерализация инфекционного процесса - сепсис) - отдают преимущество более узкоспециализированным антибактериальным препаратам.
Острая проблема последних десятилетий - развитие резистентности к антибиотикам у различных бактерий. Это делает использование многих препаратов неэффективным. Некоторые штаммы золотистого стафилококка в исследованиях проявили стойкость даже к антибактериальным препаратам резерва. Единственным действующим медикаментом в таких случаях остается полипептидный антибиотик колистин.
Показания к применению антибиотиков
Принимает решение о назначении антибактериальных препаратов при ЛОР-инфекции только квалифицированный врач (общей практики, отоларинголог).
Перед этим решением он должен оценить жалобы и общее состояние больного. Среди симптомов, которые могут указывать на бактериальную патологию, выделяют:
- повышение температуры до суб- или фебрильных показателей;
- синдром общей интоксикации;
- продуктивный кашель;
- боль в горле;
- отек миндалин, появление на их поверхности гнойных выделений;
- боль в ушах, ощущение заложенности и снижение слуха.
 Кроме того берутся во внимание и лабораторные признаки. При бактериальной патологии обычно в общем анализе крови повышается количество лейкоцитов, нейтрофилов, увеличивается СОЭ (скорость оседания эритроцитов) и смещается лейкоцитарная формула влево.
Кроме того берутся во внимание и лабораторные признаки. При бактериальной патологии обычно в общем анализе крови повышается количество лейкоцитов, нейтрофилов, увеличивается СОЭ (скорость оседания эритроцитов) и смещается лейкоцитарная формула влево.
Обязательно необходимо проводить и золотой стандарт диагностики - бактериологическое исследование мазка из задней стенке носоглотки, миндалин, мокроты. Цель теста - достоверно установить тип бактериального возбудителя у конкретного пациента. Дополнительно изучается чувствительность возбудителя к отдельным антибактериальным препаратам. Среди недостатков этого метода - необходимость ожидать 2-3 дня результаты в ситуации, когда нужно проводить терапию немедленно. Поэтому практически всегда антибиотики назначают исходя из эмпирического опыта.
Обязательно врач собирает также историю использования антибиотиков для конкретного пациента.
Нужно избегать назначения одного антибактериального препарата в течение краткого промежутка времени.
Правила проведения антибиотикотерапии
При назначении антибиотиков необходимо соблюдать несколько простых правил. Нельзя принимать антибактериальные препараты самостоятельно, без консультации с квалифицированным врачом. Пациенту сложно объективно оценить собственное состояние и необходимость приема того или иного медикамента. При самолечении гораздо чаще возникают побочные эффекты.
 Нужно соблюдать режим приема антибиотика. Препарат должен приниматься в четко означенное время каждого дня. При пропуске приема необходимо как можно быстрее принять пропущенную дозу и продолжить лечение в стандартном режиме. Запивать таблетку нужно только обычной водой, поскольку другие напитки (кофе, соки, газировки) могут изменять фармакологические характеристики препарата.
Нужно соблюдать режим приема антибиотика. Препарат должен приниматься в четко означенное время каждого дня. При пропуске приема необходимо как можно быстрее принять пропущенную дозу и продолжить лечение в стандартном режиме. Запивать таблетку нужно только обычной водой, поскольку другие напитки (кофе, соки, газировки) могут изменять фармакологические характеристики препарата.
Оценка эффективности антибиотикотерапии проводится по анализу клинических проявлений. Если через 3 дня отмечается регресс клинической симптоматики, то делается вывод о правильном выборе препаратов. При отсутствии позитивной динамики у пациента советуют сменить антибактериальный препарат.
Если получены данные о результатах микробиологического исследования, то по его результатам можно делать коррекцию медикаментов. Минимальная длительность антибактериальной терапии - 3 дня (при лечении макролидами и отсутствии осложнений). В некоторых случаях длительность приема антибиотиков составляет 2-3 недели. Важно проводить терапию до полного излечения пациента, чтобы избежать регресса патологии.
При антибиотикотерапии часто используется ступенчатая методика проведения лечения.
Она заключается в том, что сначала в стационарных условиях пациенту назначается препарат в инъекционной форме для внутривенного или внутримышечного введения. После выписки, когда состояния больного значительно улучшается, для домашнего применения назначается тот же антибиотик, но уже в таблетках, капсулах или сиропе.
Группы антибиотиков при ЛОР-инфекциях у взрослых
Пенициллины
Очень часто терапию различных патологий ЛОР-органов начинают с исторически первой группы антибиотиков - пенициллинов. Они относятся к группе бета-лактамных препаратов, которые владеют выраженным бактерицидным эффектом против широкого круга возбудителей.
 Существуют формы как для перорального применения, так и для парентерального. Пенициллины хорошо себя зарекомендовали в лечении бактериальных инфекций у беременных, пациентов пожилого возраста, во время лактации, поскольку практически не имеют токсического действия на основные функциональные системы организма. Наиболее часто используют следующие их представители:
Существуют формы как для перорального применения, так и для парентерального. Пенициллины хорошо себя зарекомендовали в лечении бактериальных инфекций у беременных, пациентов пожилого возраста, во время лактации, поскольку практически не имеют токсического действия на основные функциональные системы организма. Наиболее часто используют следующие их представители:
- пенициллин;
- амоксициллин;
- ампициллин;
- комбинацию амоксициллина и клавулановой кислоты.
Пенициллины обычно назначают при несложных патологиях - назофарингитах, ангинах, ларингитах. Среди их недостатков обычно выделяют высокую резистентность многих возбудителей, которая возникла за десятилетия их использования. Наиболее опасный побочный эффект при назначении пенициллинов - развитие аллергических реакций различной степени сложности.
Поэтому всегда перед первым назначением медикамента необходимо провести тест на гиперчувствительность к препарату.
Цефалоспорины
Цефалоспорины, как и пенициллины, относятся к группе бета-лактамных антибиотиков. Особой популярностью эти антибактериальные препараты пользуются в стационарах. Цефалоспорины владеют бактерицидным эффектом, спектр которого довольно сильно отличается в разных поколениях препаратов (сейчас их насчитывается 5).
Преимущественно используются цефалоспорины, за небольшим исключением, внутримышечно или внутривенно. Показания для назначения у них гораздо шире, нежели у пенициллинов: отиты, гаймориты, различные формы ангин, синуситы, фарингиты, ларингиты. Также цефалоспорины используют до и после проведения оперативных вмешательств с целью профилактики возможных осложнений. Для лечения ЛОР-заболеваний преимущественно назначаются следующие медикаменты из этой группы:
- цефтриаксон;
- цефоперазон;
- цефтазидим;
- цефиксим;
- цефепим.
Проблема антибиотикорезистентности для последних поколений цефалоспоринов стоит чуть менее остро. Их также можно назначать с осторожностью беременным, детям с самого раннего возраста. Однако, довольно часто при их применении могут возникать аллергические реакции, поэтому, как и для пенициллинов, необходимо проводить исследование наличия гиперчувствительности перед первым применением.
Макролиды
Макролиды - группа препаратов, которую наиболее часто назначают отоларингологи при первом визите пациента к ним. Причины тому простые - низкая токсичность, простота применения препаратов этой группы (курс терапии обычно длится 3-5 дней) и небольшой риск побочных эффектов.
 Макролиды блокируют синтез белка клетками бактерий, и таким образом делают невозможным их дальнейшее размножение. Они имеют уникальные фармакологические свойства: способность накапливаться в пораженных тканях организма (концентрация в них может в 10 раз превышать аналогический показатель в крови).
Макролиды блокируют синтез белка клетками бактерий, и таким образом делают невозможным их дальнейшее размножение. Они имеют уникальные фармакологические свойства: способность накапливаться в пораженных тканях организма (концентрация в них может в 10 раз превышать аналогический показатель в крови).
Также для макролидов характерный длительный период выведения из организма. Преимущественно выпускают в форме капсул, таблеток или сиропа для детей. Среди показаний - фарингиты, ангины, отиты без осложнений, бактериальные риниты и синуситы. Наиболее часто назначают следующие макролиды:
- азитромицин;
- кларитромицин;
- джозамицин;
- спирамицин.
Среди побочных эффектов отмечено транзиторное повышение показателей печеночных ферментов, угнетение кроветворения и диспепсические симптомы, которые обычно проходят после окончания курса терапии.
Фторхинолоны
Фторхинолоны - группа антибактериальных препаратов с выраженным бактерицидным эффектом. Они характеризуются хорошими показателями эффективности в ситуациях, когда антибиотики первого ряда не оказали нужного положительного действия.
 Спектр действия фторхинолонов включает большинство грамотрицательных бактерий и штаммов стафилококков. Данные антибиотики проникают через плацентарный барьер и могут оказывать токсическое действие на плод, из-за чего их используют для беременных только по жизненным показаниям.
Спектр действия фторхинолонов включает большинство грамотрицательных бактерий и штаммов стафилококков. Данные антибиотики проникают через плацентарный барьер и могут оказывать токсическое действие на плод, из-за чего их используют для беременных только по жизненным показаниям.
Терапию фторхинолонами обычно проводят в стационарных условиях под контролем функциональных показателей организма. Назначают эти антибиотики в ситуациях, когда этого требует тяжелое состояние больного (обычно из-за развития осложнений основной патологии). Преимущественно используют один из следующих препаратов:
- ципрофлоксацин;
- ломефлоксацин;
- спарфлоксацин;
- гемифлоксацин;
- моксифлоксацин.
Фторхинолоны при их системном применении могут негативно влиять на функционирование выделительной и гепатобилиарной систем организма. Именно поэтому их не советуют при наличии функциональных нарушений со стороны печени и почек у взрослых.
Также иногда из-за них возникают нейротоксические симптомы (головная боль, головокружение, шум в ушах), диспепсические расстройства и боли в мышцах.
Карбапенемы
Карбапенемы относятся к антибиотикам резерва при заболеваниях ЛОР-органов. Они являются представителями бета-лактамных препаратов с бактерицидным действием против патогенной флоры. Карбапенемы хорошо проникают в ткани организма, а также через гематоэнцефалический барьер. Основные представители карбапенемов:
- меропенем;
- имипенем.
 Основное показание для их назначение - генерализация инфекции (сепсис). При этом патологическом процессе бактерии активно проникают с первичного источника воспаления в ЛОР-органах в кровь и распространяются по организму, что приводит к поражению различных органов и систем.
Основное показание для их назначение - генерализация инфекции (сепсис). При этом патологическом процессе бактерии активно проникают с первичного источника воспаления в ЛОР-органах в кровь и распространяются по организму, что приводит к поражению различных органов и систем.
По данным статистики, наиболее часто возбудителем при сепсисе выступает золотистый стафилококк, многие штаммы которого развили стойкость против основных антибактериальных препаратов. Карбапенемы же сохранили активность, и поэтому остаются медикаментами выбора в таких ситуациях.
Почему азитромицин остается препаратом выбора при внебольничных инфекциях нижних дыхательных путей
Инфекционно-воспалительные заболевания дыхательных путей занимают первое место в структуре инфекционной патологии. Пневмония является наиболее частой инфекционной причиной смерти в мире. В России ежегодно около 1,5 млн человек переносят пневмонию. В связи с этим остается актуальной проблема рационального выбора антибактериального средства для лечения инфекций нижних дыхательных путей. Выбор препарата для антибактериальной терапии должен основываться на его спектре действия, охватывающем выделенный или предполагаемый возбудитель, чувствительный к данному антибиотику, фармакокинетических свойствах антибактериального средства, обеспечивающих его проникновение в терапевтической концентрации в соответствующие ткани, клетки и жидкости организма, данных о безопасности антибиотика (побочных эффектах, противопоказаниях и возможном нежелательном взаимодействии с другими лекарствами), характеристиках лекарственной формы, способе введения и режиме дозирования, обеспечивающих высокий комплаенс терапии, фармакоэкономических аспектах лечения .
Инфекции нижних дыхательных путей и принципы выбора антибиотика
При неспецифических внебольничных инфекциях выбор антибактериального препарата в большинстве случаев основывается на статистических данных о наиболее частых их возбудителях, а также сведениях о подтвержденной в контролируемых клинических исследованиях эффективности тех или иных антибиотиков при инфекциях известной этиологии. Вынужденно эмпирический подход к лечению связан с отсутствием возможности микробиологического исследования в амбулаторных лечебных учреждениях, длительностью бактериологической идентификации возбудителя и определения его чувствительности к антибиотикам (3–5 дней, а в случае «атипичных» патогенов и больше), невозможностью в ряде случаев получить биологический материал для посева или бактериоскопии (например, около 30% больных пневмониями имеют непродуктивный кашель, что не позволяет исследовать мокроту), трудностями в разграничении истинных возбудителей и сапрофитов (обычно микроорганизмов ротоглотки, попадающих в исследуемый материал). Сложности выбора лекарственного средства в амбулаторных условиях определяются также отсутствием полноценного наблюдения за течением заболевания и, следовательно, своевременной коррекции лечения при его неэффективности. Антибиотики по-разному проникают в различные ткани и биологические жидкости. Лишь некоторые из них хорошо проникают в клетку (макролиды, тетрациклины, фторхинолоны, в меньшей степени - клиндамицин и сульфаниламиды). Поэтому, даже если препарат in vitro проявляет высокую активность в отношении данного возбудителя, но не достигает в месте его локализации уровня, превышающего минимальную подавляющую концентрацию (МПК) для данного микроорганизма, клинического эффекта он не окажет, хотя микробная резистентность к нему будет вырабатываться. Не менее важным аспектом антибактериальной терапии является ее безопасность, особенно для амбулаторного больного, лишенного повседневного медицинского наблюдения. В амбулаторных условиях следует отдавать предпочтение пероральному приему антибиотиков. В педиатрической практике имеют значение органолептические свойства препарата. Для повышения исполняемости пациентом врачебных назначений режим дозирования антибиотика должен быть максимально простым, т. е. предпочтительнее препараты с минимальной кратностью приема и коротким курсом лечения.
Возбудители неспецифических внебольничных инфекций нижних дыхательных путей
Острые респираторные вирусные инфекции (ОРВИ), протекающие с синдромом бронхита, в ряде случаев, чаще в детском возрасте, могут осложняться присоединением бактериальной флоры с развитием острого бронхита. Возбудителями острого бактериального бронхита в детском возрасте являются пневмококк, микоплазма или хламидия, реже гемофильная палочка, моракселла или стафилококк. Острый бактериальный бронхиолит у детей вызывают моракселла, микоплазма и возбудитель коклюша. Острый гнойный трахеобронхит у взрослых в 50% случаев вызывает гемофильная палочка, в остальных случаях пневмококк, реже моракселла (5–8% случаев) или внутриклеточные микроорганизмы (5% случаев).
Среди бактериальных возбудителей обострений хронического бронхита главную роль играют Haеmophilus influenzae (30–70% случаев), Streptococcus pneumoniae и Moraxella catarrhalis. Для курильщиков наиболее характерна ассоциация H. influenzae и M. catarrhalis. В отягощенных клинических ситуациях (возраст старше 65 лет, многолетнее течение болезни - более 10 лет, частые обострения - более 4 раз в год, сопутствующие заболевания, выраженные нарушения бронхиальной проходимости - объем форсированного выдоха за первую секунду (ОФВ1) < 50% должных величин, постоянное отделение гнойной мокроты, алкоголизм, иммунодефицитные состояния) преобладают продуцирующие бета-лактамазу штаммы H. influenzae и M. catarrhalis, этиологическое значение приобретают Enterobacteriaceae (Klebsiella pneumoniae), Pseudomonas aeruginosa, Staphylococcus aureus.
Наиболее частым возбудителем внебольничной пневмонии у взрослых остается пневмококк (30,5% случаев), реже этиологическими агентами являются микоплазмы (от 12,5% до 20–30%), хламидии (от 2–8% до 12,5%) или гемофильная палочка. У лиц молодого возраста пневмонии чаще вызываются монокультурой возбудителя (обычно S. pneumoniae), а у пожилых людей или больных с факторами риска - ассоциациями бактерий, зачастую представленными сочетанием грамположительных и грамотрицательных микроорганизмов (21% - C. pneumoniae, 16% - M. pneumoniae, 6% - Legionella pneumophila, до 11% - H. influenzae). Крупозная (долевая) пневмония в 100% случаев вызывается пневмококком. M. pneumoniae или C. pneumoniae часто встречаются у людей в возрасте до 35 лет (до 20–30%), а их этиологическая роль у пациентов старших возрастных групп менее значительна (1–9%). H. influenzae (4,5–18% случаев) чаще вызывает пневмонию у курильщиков, а также на фоне хронического обструктивного бронхита. У них же в 1–2% случаев этиологическим агентом является M. catarrhalis. L. pneumophila - редкий возбудитель внебольничной пневмонии (2–10%, в среднем 4,8% случаев), однако легионелезная пневмония занимает второе место (после пневмококковой) по летальности. Enterobacteriaceae (3–5% случаев), такие как K. pneumoniae, Escherichia сoli, крайне редко другие энтеробактерии, встречаются у пациентов с факторами риска (возраст старше 65 лет, иммунодефицитные состояния, сахарный диабет, алкоголизм, почечная, печеночная или застойная сердечная недостаточность, хронические обструктивные заболевания легких, применение антибиотиков в течение предшествующих трех месяцев и др.). S. aureus является редким возбудителем «домашней» пневмонии (менее 5%). Вероятность стафилококковой пневмонии возрастает у больных пожилого возраста, при наркомании или алкоголизме, у больных на гемодиализе или у людей, переносящих грипп. Другие возбудители обнаруживаются не более чем в 2% случаев. В 39,5% случаях возбудителя выделить не удается. При этом следует учитывать увеличившуюся роль атипичных возбудителей (хламидий и микоплазм), бактериологическое выделение которых требует специальных условий .
Антибактериальная активность азитромицина
Спектр антимикробного действия всех макролидов одинаков (табл. 1). Хотя характер действия макролидов в основном бактериостатический, азитромицин, создающий высокие концентрации в тканях, проявляет бактерицидную активность в отношении ряда возбудителей: H. influenzae, M. catarrhalis, N. gonorrhoeae, S. pneumoniae, S. pyogenes, S. agalactiae, Campylobacter spp., H. pylori, B. pertussis, C. diphtheriae.
Азитромицин высокоактивен в отношении вероятных возбудителей инфекций нижних дыхательных путей: пневмококка (МПК 0,03–0,12 мкг/мл), микоплазмы (МПК 0,001–0,01 мкг/мл), хламидии (МПК 0,06–0,25 мкг/мл), гемофильной палочки (МПК 0,25–1 мкг/мл), моракселлы (МПК 0,03–0,06 мкг/мл), стафилококка (МПК 0,06–0,5 мкг/мл), легионеллы (МПК 0,5 мкг/мл).
Азитромицин стоит на первом месте среди макролидов по активности в отношении H. influenzae, M. catarrhalis, N. gonorrhoeae, R. rickettsii, B. melitensis, включая их бета-лактомазопродуцирующие штаммы. По действию на H. influenzae он уступает аминопенициллинам и цефалоспоринам, но превосходит эритромицин в 2–8 раз. При концентрации 1 мкг/мл азитромицин подавляет рост 100%, эритромицин - 16%, а рокситромицин - 5% штаммов H. influenzae. Минимальная бактерицидная концентрация (МБК), приводящая к гибели 99,9% штаммов гемофильной палочки, для азитромицина составляет 4 мкг/мл, для эритромицина - 16 мкг/мл, для рокситромицина - 64 мкг/мл.
Хотя по активности в отношении хламидий, микоплазм, уреаплазм и легионелл in vitro азитромицин стоит на втором месте после кларитромицина, in vivo его активность в отношении этих внутриклеточных патогенов превышает активность других макролидов из-за его чрезвычайно высокой способности проникать в клетки. МБК азитромицина в отношении C. pneumoniae варьирует от 0,06 до 0,125 мкг/мл. Азитромицин превосходит кларитромицин по активности против Coxiella burnetii, вызывающей атипичную пневмонию. По действию на микоплазмы азитромицин превосходит доксициклин.
Для азитромицина и других макролидов характерен постантибиотический эффект, т. е. сохранение антимикробного действия препарата после его удаления из среды . Это обусловлено необратимыми изменениями рибосом возбудителя, ведущими к блокированию транслокации. Азитромицин (в меньшей степени эритромицин и кларитромицин) обладает и суб-МПК-постантибиотическим эффектом - влиянием на микроорганизмы после воздействия субингибирующих концентраций антибиотика. Под влиянием концентраций этих препаратов даже ниже МПК микроорганизмы, в том числе обычно резистентные к ним (синегнойная палочка), становятся более чувствительными к факторам иммунной защиты. Азитромицин проявляет постантибиотический и суб-МПК-постантибиотический эффект в отношении S. pyogenes, S. pneumoniae, H. influenzae, L. pneumophila, по продолжительности которого превосходит кларитромицин.
Азитромицин и другие макролиды обладают иммуномодулирующим и противовоспалительным действием . Макролиды повышают активность Т-киллеров. В частности, установлено усиление киллинга хламидий под действием азитромицина. Макролиды накапливаются в нейтрофилах, моноцитах и макрофагах, усиливают их миграцию в очаг воспаления, повышают их фагоцитарную активность, стимулируют секрецию интерлейкинов IL-1, IL-2, IL-4. Макролиды влияют на окислительные реакции в фагоцитах (повышают продукцию супероксида нейтрофилами) и способствуют их дегрануляции. Азитромицин, кроме того, ускоряет апоптоз нейтрофилов после ликвидации патогена. После санации очага инфекции макролиды повышают продукцию противовоспалительного цитокина (интерлейкина IL-10) моноцитами, уменьшают выработку провоспалительных цитокинов (интерлейкинов IL-1, IL-2, IL-6, IL-8, TNF-альфа) моноцитами и лимфоцитами, снижают образование высокоактивных соединений кислорода (NO) и медиаторов воспаления - простагландинов, лейкотриенов и тромбоксанов, что способствует прекращению воспалительной реакции. Противовоспалительное действие проявляется даже при субтерапевтических концентрациях макролидов и сравнимо с эффектом нестероидных противовоспалительных средств. С ним связано уменьшение под действием макролидов гиперреактивности дыхательных путей, всегда сопровождающей бронхолегочные инфекции .
Микробная резистентность
Все макролиды неэффективны в отношении микроорганизмов, природно-устойчивых к эритромицину . При формировании приобретенной устойчивости к макролидам после прекращения контакта с антибиотиком со временем чувствительность к нему восстанавливается. Устойчивость микроорганизмов к макролидам внутригрупповая перекрестная. Перекрестная устойчивость с макролидами наблюдается также у линкозамидов. 90–95% госпитальных штаммов пневмококка, резистентных к пенициллину, устойчивы и к макролидам. Резистентность грамположительных кокков к макролидам в России значительно ниже, чем в других странах. Согласно результатам Международного многоцентрового исследования PROTEKT (2002 г.), распространенность S. pneumoniae, резистентного к эритромицину, в странах Западной Европы составляет в среднем 31,5% (1–4% в Швеции и Нидерландах, 12,2% - в Великобритании, 36,6% - в Испании, 58,1% - во Франции) . В Гонконге и Сингапуре она достигает 80%. Резистентность пневмококка к пенициллину и макролидам в нашей стране невысока, но отмечается значительная устойчивость его к тетрациклину и ко-тримоксазолу (табл. 2). Резистентность пневмококка к доксициклину в России превышает 25% . Метициллин-резистентные штаммы стафилококка устойчивы ко всем макролидам. В отличие от грамположительных микроорганизмов, не выявлено развития приобретенной устойчивости к макролидам у H. influenzae, M. catarrhalis и внутриклеточных возбудителей (микоплазм, хламидий, легионелл).
Особенности фармакокинетики азитромицина
Азитромицин характеризуется более высокой кислотоустойчивостью (в 300 раз большей, чем у эритромицина), чем другие макролиды, которые частично инактивируются под действием соляной кислоты желудка. Все макролиды хорошо растворяются в липидах и хорошо абсорбируются из кишечника, но частично подвергаются биотрансформации первого прохождения. Биодоступность азитромицина 37%, у других препаратов этой группы она колеблется от 10 до 68%. Максимальная концентрация азитромицина в плазме крови после приема внутрь составляет 0,3–0,62 мкг/мл и достигается через 2,5–2,9 ч (после приема 500 мг максимальная концентрация 0,41–0,5 мкг/мл создается через 2,2 ч). После однократного приема регистрируются два пика максимальной концентрации. Второй пик (нередко превышающий первый) обусловлен способностью макролидов накапливаться в желчи с последующим повторным всасыванием из кишечника. После внутривенной капельной инфузии в течение 1 ч концентрация азитромицина в крови достигает 3,6 мкг/мл, снижаясь через 24 ч до 0,2 мкг/мл.
Степень связывания азитромицина с белками плазмы относительно невелика и варьирует от 7% (при концентрации 1–2 мкг/мл) до 51% (при концентрации 0,02–0,1 мкг/мл). Как известно, чем меньше степень связывания лекарства с белком, тем больше его активная концентрация и тем скорее оно покидает сосудистое русло, проникая в ткани. Для сравнения, среди макролидов в наибольшей степени с сывороточными белками связывается рокситромицин (на 92–96%). Благодаря хорошей растворимости в липидах азитромицин легко проникает в ткани, накапливаясь в них, о чем свидетельствует большой объем распределения - 31,1 л/кг. AUC0–24 азитромицина 4,3 мкг´ч/мл. По способности проникать через гистогематические барьеры (кроме гематоэнцефалического) азитромицин превосходит бета-лактамы и аминогликозиды. Среди макролидов азитромицин создает самую высокую тканевую концентрацию (в десятки и сотни раз превышающую сывороточную, в большинстве тканей от 1 до 9 мкг/г), поэтому уровень его в плазме крови низкий. Наибольшая сывороточная концентрация отмечается при приеме рокситромицина, вследствие его меньшего проникновения в ткани. Азитромицин обнаруживается в высоких концентрациях в лeгких, мокроте, альвеолярной жидкости. Через 48–96 ч после однократного приeма 500 мг азитромицина его концентрация в слизистой оболочке бронхов в 195–240 раз, в лeгочной ткани - более чем в 100 раз, а в бронхиальном секрете - в 80–82 раза превышает сывороточную .
В отличие от большинства других антибиотиков, макролиды (в наибольшей степени азитромицин) хорошо проникают внутрь клеток и создают длительно сохраняющиеся высокие внутриклеточные концентрации. У эритромицина они в 17 раз, у кларитромицина - в 16–24 раза, у азитромицина - в 1200 раз превышают концентрацию в крови. Макролиды накапливаются в разных клетках, включая фибробласты, эпителиальные клетки и макрофаги. В особенно больших количествах они накапливаются в фосфолипидном слое мембран лизосом фагоцитирующих клеток крови (нейтрофилов, моноцитов) и тканей (альвеолярных макрофагов) (табл. 3). Фагоциты, нагруженные макролидами, при миграции под влиянием секретируемых бактериями хемотаксических факторов транспортируют их в инфекционно-воспалительный очаг, создавая в нем концентрацию антибиотика выше, чем в здоровых тканях. Она коррелирует с выраженностью воспалительного отека. Процесс диффузии в макрофаги рокситромицина и кларитромицина занимает 15–20 мин, азитромицина - до 24 ч, но максимальная его концентрация в клетках сохраняется около 48 ч. Макролиды высвобождаются из макрофагов, нейтрофилов и моноцитов в процессе фагоцитоза под действием бактериальных стимулов. Часть абсорбируется ими вновь, часть поступивших внутрь макрофагов макролидов необратимо связывается с белками лизосом. Направленная доставка антибиотика имеет особое значение в случае инфекции в ограниченных локусах.
У азитромицина самый длинный Т1/2 (после первого приема 10–14 ч, в интервале от 8 до 24 ч после приeма - 14–20 ч, от 24 до 72 ч - 35–55 ч, при многократном приeме - 48–96 ч, в среднем 68–71 ч), что позволяет назначать антибиотик только один раз в сутки. Период полувыведения из тканей значительно больше. Терапевтическая концентрация азитромицина в тканях сохраняется в течение 5–7 дней после отмены (эритромицина - 1–3 дня). Макролиды имеют, в основном, внепочечный путь элиминации. Они подвергаются биотрансформации (деметилированию, гидроксилированию) в печени при участии цитохрома Р-450 (преимущественно его изофермента CYP3A4) и выводятся с желчью в высоких концентрациях в виде активных (кларитромицин, мидекамицин) или неактивных метаболитов и в неизменeнном виде. Азитромицин частично подвергается биотрансформации в печени (известно 10 его метаболитов), а 50% дозы выводится с желчью в неизменeнном виде. Небольшая часть дозы (у азитромицина - 6% пероральной и 11–14% внутривенной дозы) выделяется с мочой.
Почечная недостаточность и цирроз печени не влияют на фармакокинетику азитромицина. В отношении других макролидов может потребоваться коррекция режима дозирования. У пациентов пожилого возраста фармакокинетика макролидов существенно не меняется и коррекции режима дозирования у них не требуется .
Безопасность применения
Азитромицин, как и вообще макролиды, относится к наименее токсичным антибиотикам . Общая частота развития побочных эффектов азитромицина - около 9% (при использовании эритромицина - 30–40%, кларитромицина - 16%). Частота побочных эффектов азитромицина, требующих отмены препарата, составляет в среднем 0,8%.
Данные метаанализа исследований, проведенных в Западной Европе, Северной и Южной Америке, Африке и Азии, показали, что с азитромицином связана достоверно более низкая частота нежелательных эффектов, чем с препаратами сравнения при лечении как взрослых, так и детей (7,6% и 8,7% для азитромицина, 9,8% и 13,8% для других антибиотиков). Досрочное прекращение лечения потребовалось у 0,1–1,3% больных, получавших азитромицин, и у 1–2,6% больных, получавших препараты сравнения.
Безопасность азитромицина изучалась также в 46 исследованиях, проведенных в Центральной и Восточной Европе. В них были включены 2650 взрослых и 1006 детей, получавших азитромицин, и 831 взрослый и 375 детей, получавших эритромицин, рокситромицин, кларитромицин, мидекамицин, джозамицин, феноксиметилпенициллин, амоксициллин, ко-амоксиклав, цефаклор, доксициклин или ципрофлоксацин. Нежелательные эффекты были отмечены у 5,3% взрослых и 7,2% детей, получавших азитромицин, и у 14,9% взрослых и 19,2% детей, получавших препараты сравнения. Досрочное прекращение лечения потребовалось у 0,09% взрослых и 0,4% детей, получавших азитромицин, и у 2,3% взрослых и 2,1% детей, получавших другие антибиотики.
В других 15 исследованиях участвовали 1616 больных, получавших азитромицин, и 1613 больных, получавших рокситромицин, кларитромицин, амоксициллин, ко-амоксиклав или цефаклор. Нежелательные эффекты были отмечены у 10,5% пациентов, получавших азитромицин, и у 11,5% пациентов, получавших препараты сравнения. Досрочное прекращение лечения потребовалось у 0,4% пациентов, получавших азитромицин, и у 2,1% пациентов, получавших препараты сравнения.
В клиническом исследовании переносимости азитромицина, проведенном двойным слепым методом у 2598 детей, побочные эффекты наблюдались у 8,4% больных. Они встречались достоверно чаще у детей, получавших препараты сравнения (12,9%) - ко-амоксиклав, ампициллин, феноксиметилпенициллин, цефалексин, цефаклор, доксициклин, диклоксациллин, флуклоксациллин, джозамицин и эритромицин .
Со стороны желудочно-кишечного тракта нежелательные явления при применении азитромицина встречаются в 6–9% случаев, кларитромицина - в 12%, эритромицина - в 20–32%. При лечении азитромицином легкие или умеренные абдоминальные боли, тошнота, рвота или диарея отмечались у 5% детей (при приеме эритромицина и других 14-членных макролидов, являющихся стимуляторами мотилиновых рецепторов, диарея встречается значительно чаще).
Гепатотоксическое действие нехарактерно для азитромицина, но возможно в редких случаях при длительном применении джозамицина, спирамицина, кларитромицина и высоких доз эритромицина.
Нежелательные эффекты со стороны центральной нервной и сердечно-сосудистой систем нетяжелые и встречаются в менее чем 1% случаев.
В отличие от терапии бета-лактамными антибиотиками, дисбактериоз и связанные с ним осложнения при лечении азитромицином нехарактерны, поскольку он, как и остальные макролиды, не оказывает влияния на нормальную микрофлору кишечника.
Аллергические реакции на азитромицин и другие макролиды встречаются очень редко (менее 1% случаев) и, как правило, ограничиваются кожными проявлениями. В то же время на пенициллины они развиваются у 10%, а на цефалоспорины - у 4% больных. Перекрeстная аллергия с пенициллинами и цефалоспоринами отсутствует, но отмечается перекрeстная аллергия с другими макролидами.
Азитромицин противопоказан лишь при повышенной чувствительности к макролидам, печеночной недостаточности, в первом триместре беременности (за исключением случаев, когда ожидаемая польза для матери превышает потенциальный риск для плода) и в период кормления грудью.
Взаимодействие на уровне биотрансформации в печени наиболее клинически значимо для эритромицина, олеандомицина, кларитромицина и джозамицина, в меньшей степени - для рокситромицина и мидекамицина и нехарактерно для азитромицина, диритромицина и спирамицина. При использовании макролидов у пациентов, одновременно принимающих препараты, которые метаболизируются при участии цитохрома Р-450, может замедляться их элиминация. Это приводит к увеличению концентрации этих лекарств в сыворотке крови и повышению риска побочных эффектов. При этом, в частности, усиливается противосвертывающий эффект непрямых антикоагулянтов (варфарина, аценокумарола, фениндиона, этила бискумацетата), нефротоксическое действие иммунодепрессантов (циклоспорина и такролимуса), увеличивается длительность действия глюкокортикоидов, повышается риск развития рабдомиолиза под действием статинов, частота побочных эффектов дизопирамида, антагонистов кальция (нифедипина и верапамила), бромокриптина, противовирусных препаратов, применяемых при ВИЧ-инфекции, снотворных и противосудорожных средств (карбамазепина, вальпроевой кислоты, фенитоина), транквилизаторов (мидазолама, триазолама, зопиклона), повышается плазменный уровень цизаприда, пимозида, антигистаминных препаратов (терфенадина, астемизола, эбастина). Это может приводить к удлинению интервала QT на ЭКГ и сердечным аритмиям, включая желудочковую тахикардию, фибрилляцию желудочка, трепетание или мерцание желудочков. Макролиды (кроме азитромицина и мидекамицина) вызывают повышение концентрации теофиллина в сыворотке крови (на 10–50%) и теофиллиновую интоксикацию.
В связи с тем, что азитромицин не является ингибитором цитохрома Р-450, он не взаимодействует с теофиллином, снотворными и противосудорожными средствами, транквилизаторами, непрямыми антикоагулянтами, антигистаминными препаратами . Это достоверно подтверждено в специально проведенных контролируемых исследованиях.
Клиническая эффективность
В течение 10 лет эффективность азитромицина при инфекциях нижних дыхательных путей (см. табл. 4 и табл. на стр. 26 «Эффективность азитромицина при инфекциях нижних дыхательных путей у взрослых») изучалась в 29 крупных рандомизированных контролируемых исследованиях у 5901 больного, в том числе 762 детей . В 12 исследований были включены больные с различными инфекциями, в 9 - больные с обострением хронического бронхита, в 9 - больные с пневмонией. В 22 исследованиях изучалась эффективность 3-дневного курса терапии азитромицином, в 5 - 5-дневного, в 2 - ступенчатой терапии (внутривенно, а затем внутрь) и в 1 - однократного приема. В качестве препаратов сравнения в 8 исследованиях использовали макролиды (эритромицин, кларитромицин, рокситромицин, диритромицин), в 13 - пенициллины (ко-амоксиклав, амоксициллин, бензилпенициллин), в 4 - пероральные цефалоспорины (цефаклор, цефуроксим аксетил, цефтибутен), в 1 - фторхинолоны (моксифлоксацин). Чаще всего (в 9 исследованиях) азитромицин сравнивали с ко-амоксиклавом. Длительность применения препаратов сравнения обычно составляла 10 дней. Эффективность как 3-дневного, так и 5-дневного курсов терапии азитромицином была высокой и в большинстве исследований оказалась сопоставимой с таковой 10-дневных курсов лечения препаратами сравнения. В 5 исследованиях азитромицин превосходил по эффективности препараты сравнения (ко-амоксиклав, эритромицин, бензилпенициллин и цефтибутен). Переносимость терапии в основных и контрольных группах была в целом сопоставимой, хотя в 4 исследованиях азитромицин вызывал нежелательные эффекты реже, чем ко-амоксиклав или цефуроксим аксетил. Разница была в основном обусловлена более низкой частотой желудочно-кишечных расстройств при лечении азитромицином.
В одном из последних крупных международных рандомизированных исследований с двойным слепым контролем азитромицин (500 мг 1 раз в сутки в течение 3 дней) сравнивался с кларитромицином (500 мг 2 раза в сутки в течение 10 дней) при обострении хронической обструктивной болезни легких (ХОБЛ). Клиническая эффективность азитромицина и кларитромицина при следующих возбудителях соответственно составляла: при H. influenzae - 85,7% и 87,5%, M. catarrhalis - 91,7% и 80%, S. pneumoniae - 90,6% и 77,8% .
Эффективность азитромицина при инфекциях нижних дыхательных путей у детей, таких как острый гнойный бронхит и внебольничная пневмония, так же высока, как и у взрослых . Результаты сравнительных контролируемых исследований свидетельствуют о том, что по клинической эффективности, которая превышает 90%, азитромицин при таких инфекциях не уступает эритромицину, джозамицину, ко-амоксиклаву и цефаклору.
В частности, в многоцентровом двойном слепом исследовании выявлена высокая эффективность азитромицина при микоплазменных пневмониях у детей. При внебольничных пневмониях у детей (39 человек получали азитромицин 10 мг/кг 1 раз в день и 34 - ко-амоксиклав 40 мг/кг в 3 приема) клиническая эффективность составила соответственно 100% и 94% . В сравнительном исследовании азитромицина (10 мг/кг 1 раз в день) и ко-амоксиклава (40 мг/кг в 3 приема) у 97 и 96 детей с инфекциями нижних отделов дыхательных путей клиническая эффективность составила 97% и 96% соответственно . При этом у детей, получавших азитромицин, выздоровление наступало достоверно быстрее, а частота побочных эффектов терапии была меньше. В целом показана равная эффективность короткого курса азитромицина и традиционных курсов лечения внебольничных пневмоний у детей .
Свидетельством высокой эффективности коротких курсов азитромицина (3-дневный курс при назначении внутрь 1 раз в сутки 500 мг взрослым и 10 мг/кг - детям) при лечении острых инфекций верхних и нижних дыхательных путей различной локализации являются результаты проспективного несравнительного исследования препарата в 235 медицинских центрах у 1574 взрослых и 781 ребенка. Излечение или быстрое улучшение наблюдалось более чем в 96% случаев, эрадикация возбудителей - в 85,4% .
В итоге в сравнительных исследованиях макролидов продемонстрирована сходная клиническая и бактериологическая эффективность азитромицина, кларитромицина, диритромицина, мидекамицина, мидекамицина ацетата, рокситромицина, джозамицина, эритромицина у взрослых и детей при инфекциях нижних дыхательных путей, включая острый бронхит, обострение хронического бронхита, внебольничную пневмонию, в том числе микоплазменную. Однако диспепсические явления, вызываемые эритромицином, часто требовали замены препарата .
Приверженность лечению (комплаенс)
Одним из условий эффективности антибактериальной терапии является выполнение пациентами назначений врача. По имеющимся оценкам, 40% больных не выполняют предписанный режим антибиотикотерапии. Это особенно характерно для амбулаторной практики. К типичным нарушениям относятся пропуск приeма, изменение дозы или времени приeма, преждевременная отмена препарата при улучшении самочувствия. Из числа пациентов, принявших менее 80% назначенного курса терапии, только у 59% достигается желаемый эффект антибиотика. У остальных возможно удлинение периода выздоровления, развитие осложнений, рецидивов, микробной резистентности, хронизация инфекционно-воспалительного процесса, может потребоваться назначение другого антибиотика, и, в конечном счeте, подрывается доверие пациента к рекомендациям врача. Соблюдение назначенного графика приeма антибиотика напрямую зависит от его удобства для пациента. Известно, что чем меньше кратность приeма и короче курс лечения, тем больше больных соблюдают врачебные назначения. Таким образом, среди макролидов азитромицин имеет наилучший комплаенс, так как применяется только 1 раз в сутки, в среднем в течение 3 дней.
Стандарты лечения
В стандарте медицинской помощи больным пневмонией (Приказ Минздравсоцразвития РФ от 23.11.2004 г. № 263) азитромицин определeн в качестве средства медикаментозного лечения пневмонии наряду с кларитромицином, амоксициллином с клавулановой кислотой, цефотаксимом, моксифлоксацином . В стандарте медицинской помощи больным ХОБЛ (Приказ Минздравсоцразвития РФ от 23.11.2004 г. № 271) азитромицин указан в числе антибиотиков для лечения обострений наряду с кларитромицином, амоксициллином с клавулановой кислотой, моксифлоксацином .
Заключение
Таким образом, азитромицин обладает высокой активностью в отношении практически всех вероятных неспецифических бактериальных возбудителей внебольничных инфекций нижних дыхательных путей. В отличие от бета-лактамных антибиотиков, он эффективен против внутриклеточных патогенов, а по сравнению с другими макролидами - обладает выраженной активностью в отношении гемофильной палочки. Приобретенная микробная резистентность к азитромицину в России остаeтся на низком уровне. Азитромицин существенно отличается от других антибиотиков своей фармакокинетикой, прежде всего накоплением в высоких концентрациях в тканях, особенно в клетках, и длительным периодом полувыведения из организма. Это позволяет применять азитромицин 1 раз в сутки коротким курсом. Побочные эффекты азитромицина нетяжeлые и встречаются редко. Он мало взаимодействует с другими лекарствами и имеет минимальные противопоказания. Все это обеспечивает хорошую переносимость и приверженность больных к лечению. Клиническая эффективность и безопасность азитромицина (Сумамеда) при инфекциях нижних дыхательных путей доказаны в многочисленных качественных клинических исследованиях. Азитромицин включeн в утвержденные стандарты лечения.
Азитромицин показан для монотерапии острого бронхита и бронхиолита бактериальной этиологии. При обострении хронического бронхита азитромицин, благодаря активности в отношении гемофильной палочки, является альтернативным препаратом. При нетяжeлом течении внебольничной пневмонии азитромицин относится к препаратам первого ряда для монотерапии. При наличии клинических или эпидемиологических данных о микоплазменной, хламидийной или легионеллезной (атипичной) пневмонии он является препаратом выбора. При тяжeлом течении пневмонии приeм азитромицина может дополнять парентеральное введение бета-лактамных антибиотиков.
Литература
Белоусов Ю. Б., Шатунов С. М. Антибактериальная химиотерапия. М.: Ремедиум, 2001. 473 с.
Буданов С. В. Азитромицин (сумамед): основные свойства и особенности применения в терапии внебольничной пневмонии // Антибиотики и химиотерапия. 2000. № 10. С. 28–37.
Карбон К., Пул М. Д. Значение новых макролидов при лечении внебольничных инфекций дыхательных путей: обзор экспериментальных и клинических данных // КМАХ. 2000. Т. 2, № 1.
Карпов О. И. Комплаенс антибиотикотерапии инфекций дыхательных путей // Антибиотики и химиотерапия. 1999. № 8. С. 37–45.
Лукьянов С. В. Выбор антибиотиков при внебольничных инфекциях дыхательных путей // Заместитель главного врача. 2007. № 8. С. 101–108.
Лукьянов С. В. Клиническая фармакология макролидов // Consilium medicum. 2004. Т. 6, № 10. С. 769–773.
Лукьянов С. В. Макролиды в терапии внебольничных инфекций дыхательных путей // Consilium medicum. 2005. Приложение: Пульмонология. С. 3–7.
Лукьянов С. В. Фармакология и клиническое применение азитромицина у детей //Consilium medicum. 2005. Приложение: № 10. С. 18–25.
Моисеев С. В., Левшин И. Б. Азитромицин: старые и новые показания // Клиническая фармакология и терапия. 2001. Т. 10, № 5.
Практическое руководство по антиинфекционной химиотерапии / Под ред. Л. С. Страчунского, Ю. Б. Белоусова, С. Н. Козлова. М.: Боргес, 2002. 379 с.
Синопальников А. И. Макролиды в лечении внебольничных инфекций нижних дыхательных путей // Consilium medicum. 2004. Приложение: Т. 6, № 5.
Страчунский Л. С., Козлов С. Н. Макролиды в современной клинической практике // Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript .
Foulds G., Johnson R. B. Selection of dose regimens of azithromycin // J. Antimicrob. Chemother. 1993. V. 31 (Suppl. E). P. 39–50.
Hopkins S. J. Clinical Toleration and Safety of Azithromycin in Adults and Children // Rev. Contemp. Pharmacother. 1994. V. 5. P. 383–389.
Swanson R. N., Lainez-Ventosilla A., De Salvo M. C. et al. Once-daily azithromycin for 3 days compared with clarithromycin for 10 days for acute exacerbation of chronic bronchitis: a multicenter, double-blind, randomized study. Treat. Respir. Med. 2005. № 4. P. 31–39.
Tredway G., Goyo R., Suares J. et al. Comparative study of azithromycin and amoxicillin/clavulanic acid (co-amoxiclav) in the treatment of community-asquired in peadiatric patients // Zithromax ICMAS Poster Book. 1996. P. 82–83.
С. В. Лукьянов , доктор медицинских наук, профессор ФГУ «Консультативно-методический центр лицензирования» Росздравнадзора, Москва
C.В. Яковлев, Московская медицинская академия им. И.М.Сеченова
Введение
Острые инфекции верхних дыхательных путей являются самыми частыми заболеваниями в амбулаторной практике, с которыми встречаются не только отоларингологи, но терапевты и педиатры. В большинстве случаев при этих инфекциях врачи назначают системные антибиотики. В медицинской практике на долю острых респираторных инфекций приходится около 75% назначений системных антибиотиков . При этом не все острые инфекции верхних дыхательных путей имеют бактериальную этиологию. Часть инфекций вызываются вирусами, на которые системные антибиотики не действуют. По данным различных фармакоэпидемиологических исследований, в 20-50% случаев острых респираторных инфекций назначение системных антибиотиков признано неоправданным .
Переоценка практическими врачами эффекта системных антибиотиков при острых инфекциях верхних дыхательных путей объясняется высокой частотой спонтанного выздоровления пациентов при этих инфекциях и ошибочным мнением, что системные антибиотики предотвращают развитие бактериальной суперинфекции при вирусных заболеваниях .
Степень неадекватности назначения системных антибиотиков при острых респираторных инфекциях различна. Назначение системных антибиотиков при простуде или острых респираторных вирусных инфекциях (ОРВИ), остром ларингите, трахеите, бронхите и рините почти всегда не оправдано, так как в большинстве случаев это - вирусные инфекции. В то же время назначение системных антибиотиков при остром синусите и фарингите в ряде случаев оправдано, однако должно быть веско обосновано.
Можно выделить потенциальную пользу и вред назначения системных антибиотиков при острых инфекциях верхних дыхательных путей, характеризующихся высоким уровнем спонтанного выздоровления (табл. 1).
Таблица 1. Последствия назначения антибиотиков
В плацебо-контролируемых исследованиях у взрослых пациентов и детей с острыми инфекциями верхних дыхательных путей существенных преимуществ системных антибиотиков, как в частоте выздоровления, так и в сроках исчезновения симптомов заболевания, выявлено не было . Доказано, что системные антибиотики при вирусных инфекциях верхних дыхательных путей не предотвращают бактериальные осложнения, такие как пневмония или острый средний отит. Некоторые серьезные осложнения острого риносинусита, такие как менингит и абсцесс мозга, очень редки, и в настоящее время отсутствуют данные, подтверждающие эффективность системных антибиотиков в профилактике развития этих осложнений .
Если польза от применения системных антибиотиков при многих острых респираторных инфекциях кажется сомнительной, то потенциальный вред неоправданной системной антибиотикотерапии сложно переоценить. Побочные эффекты на фоне применения системных антибиотиков наблюдаются нередко, особенно со стороны желудка и кишечника. Некоторые побочные эффекты потенциально жизнеопасны - в частности, удлинение интервала QT, наблюдающееся при применении макролидов и некоторых фторхинолонов.
Аллергические реакции при применении пенициллинов имеют место примерно в 5%. Некоторые аллергические реакции наблюдаются редко, но потенциально фатальны - например, синдром Стивенса-Джонсона на фоне применения ко-тримоксазола. Наконец, избыточное применение системных антибиотиков способствует возникновению и распространению в популяции резистентных штаммов микроорганизма, в частности наиболее значимых респираторных патогенов - Streptococcus pneumoniae и Streptococcus pyogenes .
Этиология и патофизиология
Возбудителями острых инфекций верхних дыхательных путей могут быть вирусы и бактерии, среди последних доминируют Streptococcus pneumoniae, Haemophilus influenzae, Streptococcus pyogenes. Этиологическая структура заболеваний может различаться в зависимости от локализации инфекции (табл. 2).
Таблица 2. Этиологическая структура инфекций верхних дыхательных путей
|
Инфекции |
Острый фарингит |
Острый риносинусит |
Острый трахеобронхит |
Острый ларингит |
ОРВИ или простуда |
|
Ведущие возбудители |
Вирусы S. pyogenes |
S. pneumoniae , вирусы H. influenzae |
|||
|
Менее значимые возбудители |
Mycoplasma pneumoniae , Chlamydia spp. |
M. catarrhalis , S. pyogenes , S. aureus , анаэробы |
H. influenzae , S. pneumoniae |
||
| Примечание. Микроорганизмы в каждом ряду указаны в порядке уменьшения значимости. | |||||
Однако даже в случаях "банальной" простуды чисто вирусная этиология может только предполагаться. Известно, что слизистая оболочка ротоглотки не является стерильной средой и, даже в норме, заселена бактериями. У пациентов с хроническими заболеваниями ЛОР-органов, у часто болеющих детей возможны дисбиотические нарушения, при которых на слизистой оболочке постоянно персистирует и патогенная микрофлора. В какой момент патологического процесса при ОРВИ происходит активация патогенной бактериальной флоры и основным этиологическим фактором становятся не просто вирусы, а вирусно-бактериальные ассоциации, определить практически невозможно. В любом случае такая вероятность существует.
Этапы развития бактериальной респираторной инфекции заключаются в адгезии микробов к клеткам респираторного эпителия с помощью специфических бактериальных структур - адгезинов (у S. pyogenes эту функцию выполняет комплекс липотейхоевых кислот и М-протеина) в результате чего возникает микробная колонизация эпителия.
Важнейшим свойством респираторных патогенов является способность к активной инвазии клеток эпителия, что происходит при нарушении барьерных функций в результате неспецифического воспаления, ишемии, вирусных поражений респираторного тракта. Бактериальная инвазия сопровождается активацией клеточных и гуморальных неспецифических факторов противоинфекционной резистентности, в результате чего развивается воспалительная реакция слизистых дыхательных путей (отек, гиперемия, повышенная секреция), которая и обусловливает появление характерной симптоматики.
Таким образом, воспаление имеет важное значение в клинической картине острых инфекций верхних дыхательных путей.
Резистентность
В последние 10 лет все более актуальной проблемой становится резистентность респираторных патогенов. Наиболее значимой является резистентность S. pneumoniae к пенициллину, макролидам, ко-тримоксазолу, S. pyogenes - к макролидам, тетрациклину. Резистентность S. pneumoniae к пенициллину и макролидам в некоторых странах Европы достигает 40-50%, резистентность S. pyogenes к макролидам составляет 30-40%, что ограничивает возможности эффективной терапии инфекций верхних дыхательных путей.
В частности, показано снижение клинической и бактериологической эффективности макролидов при респираторных инфекциях, вызванных резистентными штаммами S.pneumoniae или S.pyogenes . Уровень резистентности (высокой и умеренной) S.pneumoniae к пенициллину в России составляет около 20%, сходный уровень резистентности (в пределах 20%) отмечается среди S.pyogenes к макролидным антибиотикам .
Наиболее важным фактором, способствующим возникновению и селекции резистентности в популяции, является широкое, часто неоправданное, использование системных антибиотиков.
Так, в некоторых фармакоэпидемиологических исследованиях была показана прямая зависимость между предшествующим применением b-лактамных антибиотиков и частотой колонизации верхних дыхательных путей пенициллин-резистентными штаммами S.pneumoniae . Сходные данные приводятся о прямой зависимости между частотой использования макролидов и носительством пневмококков, резистентных к макролидам и пенициллину . Следует также учитывать, что системные антибиотики способствуют селекции резистентных штаммов нормальной микрофлоры полости рта, кожи и кишечника.
В частности, установлено, что стрептококки группы Viridans являются "резервуаром" резистентности к эритромицину и другим антибиотикам и способны передавать факторы резистентности другим микроорганизмам - S.pneumoniae и S.pyogenes .
В то же время ограничительная политика использования системных антибиотиков способствует уменьшению частоты антибиотико-резистентных штаммов респираторных патогенов. В Японии в 1970-80-х гг. наблюдали выраженное снижение частоты резистентных к эритромицину штаммов S. pyogenes с 61,8 до 1-3% после сокращения потребления макролидов со 170 до 65-85 т. ежегодно . В Финляндии снижение частоты использования макролидов на 50% привело к снижению резистентности S. pyogenes к эритромицину в 2 раза .
Когда показаны системные антибиотики
Учитывая глобальную угрозу распространения антибиотико-резистентных штаммов респираторных патогенов в обществе и прямую связь этого явления с чрезмерным использованием этих лекарственных препаратов, ряд неправительственных организаций - Центр по контролю заболеваний (США; CDC), Альянс за разумное использование антибиотиков (APUA), Всемирная организация здравоохранения (ВОЗ) - сформулировали стратегию ограничительной политики применения системных антибиотиков при амбулаторных респираторных инфекциях как реальную меру сдерживания резистентности.
Основная цель данной концепции заключается в ограничении неоправданного назначения системных антибиотиков при острых инфекциях верхних дыхательных путей. Материалы по рациональному применению антибиотиков представлены в документах "Principles of Judicious Use of Antimicrobial Agents for Pediatric Upper Respiratory Tract Infections" (CDC, 1998) и "Principles of Appropriate Antibiotic Use for Treatment of Acute Respiratory Tract Infections in Adults" (2001) .
Основные положения первого документа сформулированы ниже.
- Системные антибиотики не следует назначать при вирусных инфекциях, таких как простуда и ОРВИ. Применение системных антибиотиков при вирусном риносинусите не предотвращает бактериальные осложнения.
- Простуда часто сопровождается ринитом со слизисто-гнойным отделяемым. Это не является показанием для назначения системных антибиотиков, если симптоматика не сохраняется более 10-14 дней.
- Неспецифический кашель и бронхит у детей независимо от длительности не требуют системной антибактериальной терапии.
Наиболее важные положения второго документа.
Острая неспецифическая инфекция верхних дыхательных путей у взрослых:
- данные инфекции имеют преимущественно вирусную этиологию, и при них осложнения наблюдаются редко. Системные антибиотики не следует назначать для лечения неспецифических инфекций верхних дыхательных путей у ранее здоровых взрослых.
Острый синусит у взрослых:
- острый бактериальный синусит не требует системной антибактериальной терапии, особенно если симптоматика легкая или умеренная;
- системная антибиотикотерапия показана больным острым синуситом с выраженной или длительно сохраняющейся симптоматикой. В этом случае на первом этапе предпочтительно использовать системные антибиотики узкого спектра.
Острый фарингит у взрослых:
- все пациенты с острым фарингитом должны получать в адекватных дозах анальгетики, антипиретики и другие симптоматические средства;
- системные антибиотики показаны только в случае высокой вероятности стрептококковой этиологии фарингита (бета-гемолитический стрептококк группы А - БГСА);
- экспресс-диагностика с помощью исследования антигена БГСА желательна при подозрении на стрептококковую этиологию фарингита.
Антибиотикотерапия
В тех случаях, когда имеется высокая вероятность вирусно-бактериальной этиологии инфекций верхних дыхательных путей или высокий риск осложнений, показано применение антибиотиков.
Системная антибиотикотерапия при инфекциях верхних дыхательных путей показана, в основном, только в следующих случаях:
- острый синусит среднетяжелого/тяжелого течения или синусит с длительно сохраняющейся симптоматикой;
- острый тонзиллофарингит предполагаемой или установленной стрептококковой этиологии (возбудитель - бета-гемолитический стрептококк группы А-БСГА).
При выборе системного антибиотика следует учитывать современные тенденции антибиотикорезистентности и тот факт, что некоторые антибиотики способствуют селекции в популяции резистентных штаммов респираторных патогенов. В этой связи при нетяжелом течении заболевания предпочтительны антибиотики узкого спектра (например, амоксициллин), активные в отношении основных целевых патогенов - S. pneumoniae, S. pyogenes, H. influenzae. Антибактериальные препараты с более широким спектром, такие как амоксициллин/клавуланат, цефалоспорины II-III поколений, респираторные фторхинолоны, следует резервировать для более тяжелых случаев или высокой вероятности устойчивых микроорганизмов.
Учитывая современные рекомендации по ограничению назначения системных антибиотиков при острых неосложненных инфекциях верхних дыхательных путей, реальной альтернативой является применение местных антимикробных средств. Среди местных антибиотиков следует выделить фузафунгин, фрамицетин и биклотимол.
Наиболее важными свойствами фузафунгина является активность в отношении практически всех респираторных патогенов (стрептококков, пневмококков, стафилококков, микоплазмы, гемофильной палочки) и наличие местного противовоспалительного действия. На фоне применения фузафунгина не отмечено селекции штаммов, устойчивых к нему или другим антибиотикам. Местное применение фузафунгина при острых инфекциях верхних дыхательных путей отвечает современным рекомендациям по сдерживанию антибиотикорезистентности в популяции, так как в результате целенаправленной доставки антибиотика к очагу инфекции отсутствует системное воздействие и имеется меньший риск селекции резистентных штаммов нормальной микрофлоры.
По уровню антимикробной активности против основных возбудителей острых респираторных инфекций фрамицетин и комбинированные препараты, содержащие неомицин и полимиксин, уступают фузафунгину.
Следует отметить, что широко распространенная в некоторых медицинских учреждениях практика введения в околоносовые пазухи растворов системных антибиотиков, предназначенных для парентерального применения, не может быть признана рациональной. Эти препараты не предназначены для полостного введения. При их местном применении создаются неравномерные концентрации в разных участках околоносовых пазух, что может способствовать селекции резистентных штаммов. Кроме того, режим дозирования системных антибиотиков при местном применении не изучен и следует помнить о возможном неблагоприятном воздействии больших доз антибиотиков на функцию мерцательного эпителия.
Этих недостатков лишены антибиотики, специально разработанные для местного применения, в частности фузафунгин. Эффективность фузафунгина при острых респираторных инфекциях (ринофарингит, риносинусит) подтверждена в 4-х двойных слепых плацебо-контролируемых исследованиях . Показано, что фузафунгин при местном применении приводит к достоверно более быстрому, чем плацебо, исчезновению симптомов инфекции. Кроме того, при назначении фузафунгина на ранних стадиях острых респираторных инфекций достоверно снижается частота назначения практикующими врачами системных антибиотиков, а также уменьшается потребность в анальгетиках и местных глюкокортикоидах .
Таким образом, при острых нетяжелых бактериальных инфекциях верхних дыхательных путей возможно излечение пациентов при назначении фузафунгина без добавления системных антибиотиков. Данное утверждение подтверждено в проведенном нами сравнительном исследовании.
Оценка клинической и бактериологической эффективности фузафунгина при острых инфекциях верхних дыхательных путей
Нами проведено открытое рандомизированное исследование по изучению сравнительной эффективности фузафунгина (Биопарокса) при острых респираторных инфекциях в режиме монотерапии и в комбинации с макролидным антибиотиком кларитромицином.
Задачами исследования являлись:
- изучение сравнительной эффективности фузафунгина в режиме монотерапии и в комбинации с кларитромицином;
- оценка быстроты исчезновения симптомов заболевания и переносимости сравнимаемых режимов терапии;
- изучение бактериологической эффективности фузафунгина и риска селекции резистентных штаммов микроорганизмов в процессе терапии.
В исследование включались пациенты старше 18 лет с документированным диагнозом острой инфекции дыхательных путей нетяжелого течения:
- острый фарингит/тонзиллит;
- острый риносинусит;
- острый трахеобронхит.
В исследование не включались пациенты с хроническими или аллергическими заболеваниями дыхательных путей, а также с инфекцией, вызванной S. pyogenes.
Фузафунгин назначали в виде ингаляций (по 4 дозированные ингаляции в каждый носовой ход и 4 ингаляции через рот для орошения задней стенки глотки и миндалин) 4 раза в день. Кларитромицин назначали внутрь в дозе 500 мг 2 раза в сутки.
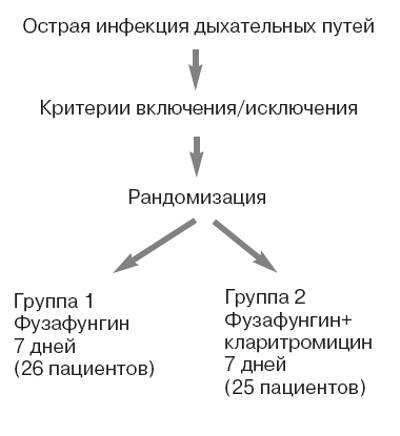
Рандомизация пациентов в одну из групп лечения осуществляли методом конвертов (рис. 1).
Рис. 1. Дизайн исследования.
Оценка клинических симптомов проводилась до лечения и ежедневно во время лечения. Оценивали наличие и выраженность симптомов (головная боль, заложенность носа, количество отделяемого из носа, чихание, отечность миндалин, гиперемия задней стенки глотки) по качественной балльной шкале:
- 0 - симптом отсутствует;
- 1 - симптом слабо выражен;
- 2 - симптом выражен умеренно;
- 3 - симптом сильно выражен.
Динамику других симптомов оценивали с помощью количественной шкалы.
Характер отделяемого из носа и характер мокроты:
- 0 - отделяемого нет;
- 1 - слизистый характер;
- 2 - слизисто-гнойный характер;
- 3 - гнойный характер.
Количество мокроты:
- 0 - мокроты нет;
- 1 - до 10 мл/сут;
- 2 - 10-50 мл/сут;
- 3 - более 50 мл/сут.
Потребность в деконгестантах и анальгетиках:
- 0 - не используются;
- 1 - 1 раз в сутки;
- 2 - 2-3 раза в сутки;
- 3 - более 3 раз в сутки.
У всех пациентов до и после лечения брали мазок из носа или зева для бактериологического исследования. Определяли чувствительность выделенных микроорганизмов к антибактериальным препаратам дискодиффузионным методом.
Оценку эффективности лечения проводили на 7-й день терапии и через 10-14 дней после окончания лечения.
Результаты исследования
В исследование были включены 60 пациентов с острой инфекцией верхних дыхательных путей. Итоговая оценка эффективности лечения проведена у 51 пациента, из них 26 пациентов (1-я группа) получали фузафунгин, 25 пациентов (2-я группа) - фузафунгин и кларитромицин. Девять пациентов выбыли из исследования, так как не пришли на последующие визиты.
Характеристика пациентов, закончивших исследования, представлена в табл. 3.
Таблица 3. Характеристика пациентов
|
Характеристика |
Группа 1 (фузафунгин) |
Группа 2 (фузафунгин+ кларитромицин) |
| Количество пациентов | 26 | 25 |
| Пол: | ||
| женщины, % | 46,1 | 68,0 |
| мужчины, % | 53,9 | 32,0 |
| Возраст, годы | 18-79 | 18-72 |
| Средний возраст, годы | 39,9±16,2 | 34,5±11,5 |
| Курящие, % | 42,3 | 24,0 |
| Диагноз: | ||
| фарингит/тонзиллит | 11 | 9 |
| риносинусит | 10 | 9 |
| трахеобронхит | 5 | 7 |
На фоне лечения у большинства пациентов был достигнут быстрый и отчетливый клинический эффект. Результаты оценки клинической эффективности на 7-й день лечения и через 10-14 дней по окончании лечения представлены в табл. 4.
Таблица 4. Клиническая и бактериологическая эффективность и переносимость сравниваемых режимов терапии острых респираторных инфекций
|
Оценка лечения |
Группа 1 (фузафунгин) n=26 |
Группа 2 (фузафунгин + кларитромицин) n=25 |
| Клиническая оценка на 7-й день лечения, % | ||
| выздоровление | 22 (84,6%) | 18 (76,0%) |
| улучшение | 4 (15,4%) | 6 (20,0%) |
| без эффекта | 0 | 1 (4,0%) |
| Бактериологическая оценка на 7-й день лечения* | ||
| эрадикация | 9 (64,3%) | 12 (75,0%) |
| персистирование | 5 (35,7%) | 4 (25,0%) |
| Клиническая оценка через 10-14 дней после лечения | ||
| выздоровление | 25 (96,2%) | 24 (96,0%) |
| без эффекта | 0 | 1 (4,0%) |
| рецидив | 1 (3,8%) | 0 |
| Побочные эффекты | ||
| всего зарегистрированных | 2 (7,7%) | 5 (20,0%) |
| вероятно, связанных с лечением | 1 (3,8%) | 4 (16,0%) |
| Примечание. *Оценка проведена у 14 и 16 пациентов 1-й и 2-й групп, у которых до лечения были выявлены клинически значимые микроорганизмы. | ||
Клинические результаты лечения не различались у больных 1-й и 2-й групп как при оценке в конце терапии (84,6 и 76%), так и через 10-14 дней по окончании терапии (96,2 и 96%). Небольшие различия, отмеченные в конце лечения в пользу пациентов 1-й группы, не были достоверны.
Клинический эффект отсутствовал у одного пациента 2-й группы с диагнозом "острый трахеобронхит", что потребовало назначения амоксициллина. У одного пациента 1-й группы, получавшего фузафунгин по поводу острого риносинусита, отмечен положительный клинический эффект в конце лечения, однако через неделю наблюдался рецидив инфекции. При первичном исследовании мазка из носа у него выявлен стрептококк группы А, который персистировал к концу лечения и выделен также во время рецидива инфекции.
Бактериологическая эффективность двух режимов терапии также была одинаковой, небольшие различия в уровне эрадикации возбудителей в пользу пациентов 2-й группы (64,3 и 75%) были недостоверны. У пациентов 1-й группы на фоне лечения фузафунгином наблюдалась эрадикация 3 из 3 штаммов S. pneumoniae, 2 из 4 штаммов S. aureus, 1 из 2 штаммов S. pyogenes и 1/1 штамма H. influenzae. В случае персистирования микроорганизмов ни в одном случае не наблюдалось формирования устойчивости к пенициллинам или макролидам. У пациентов 2-й группы достигнута эрадикация 5 из 7 штаммов S. pneumoniae, штамма S. aureus и 3 штаммов грамотрицательных бактерий.
Нами проанализирована динамика исчезновения симптомов при различных инфекциях: остром тонзиллите/фарингите (рис. 2), остром риносинусите (рис. 3), остром трахеобронхите (рис. 4).
Рис. 2. Динамика исчезновения симптомов острого тонзиллита/фарингита.
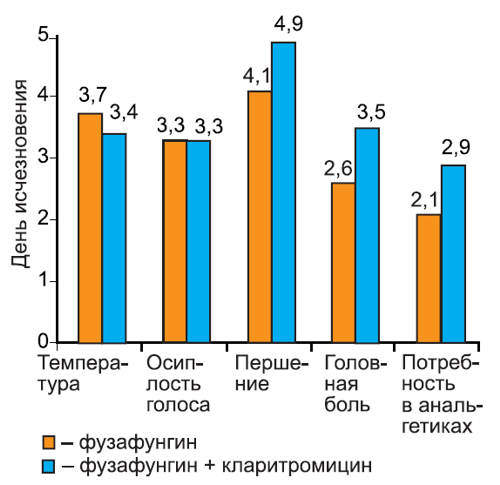
Рис. 3. Динамика исчезновения симптомов острого риносинусита.
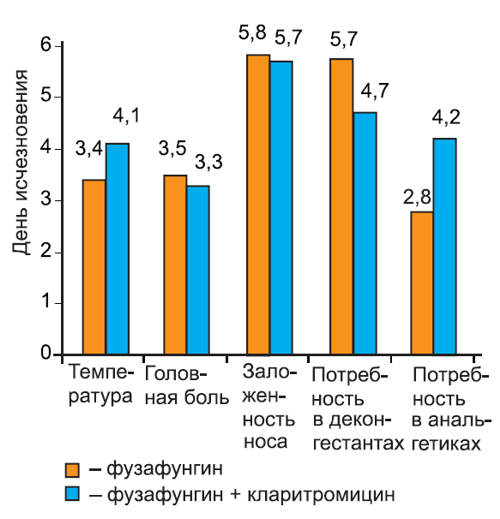
Рис. 4. Динамика исчезновения симптомов острого трахеобронхита.
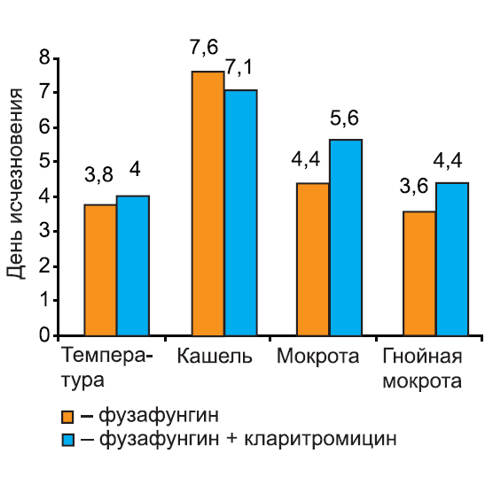
На графиках видно, что скорость исчезновения основных симптомов инфекции не различалась среди пациентов 1-й и 2-й групп. Более того, у пациентов с тонзиллитом/фарингитом и риносинуситом, получавших кларитромицин, дольше сохранялась потребность в анальгетиках (в среднем на 1 сут, различия недостоверны). Это можно объяснить более длительным сохранением головной боли на фоне кларитромицина, так как реакции со стороны центральной нервной системы являются характерным нежелательным явлением при применении некоторых макролидных антибиотиков. В то же время у пациентов с риносинуситом отмечено более быстрое прекращение использования сосудосуживающих препаратов, хотя различия между группами были также недостоверны.
Представленные данные показывают, что присоединение макролидного антибиотика к фузафунгину не приводит к более быстрому исчезновению симптомов заболевания.
Нежелательные явления в процессе лечения зарегистрированы у 2 пациентов 1-й группы и 5 пациентов 2-й группы, из них у 1 пациента 1-й группы (3,8%) и 4 пациентов 2-й группы (16%) эти явления были расценены как вероятно связанные с проводимой терапией. У пациента 1-й группы на фоне применения фузафунгина побочный эффект характеризовался чиханием после ингаляции препарата, такой же побочный эффект отмечен и у пациента 2-й группы, что можно также связать с действием фузафунгина. У 3 пациентов 2-й группы отмечены также явления со стороны желудочно-кишечного тракта (у 2 - тошнота и у 1 - боли в эпигастрии), что, скорее всего, связаны с приемом кларитромицина, так как являются характерными побочными эффектами для данного антибиотика. Ни в одном случае не потребовалось досрочного прекращения лечения.
Таким образом, в группе пациентов, получавших комбинированную терапию, побочные эффекты наблюдались несколько чаще.
Заключение
- Широкое использование системных антибиотиков в амбулаторной практике способствует росту резистентности.
- При многих острых неосложненных инфекциях верхних дыхательных путей назначение системных антибиотиков не улучшает результатов лечения.
- Ограничительная политика применения системных антибиотиков способствует снижению резистентности в популяции.
- В современных условиях возрастает значение местных антибиотиков для лечения острых инфекций верхних дыхательных путей (кроме стрептококкового фарингита), таких как фузафунгин.
- Результаты проведенных исследований свидетельствуют о высокой клинической и бактериологической эффективности фузафунгина в режиме монотерапии при острых бактериальных респираторных инфекциях; присоединение макролидного антибиотика к фузафунгину при нестрептококковых инфекциях верхних дыхательных путей не приводит к повышению эффективности лечения или ускорению выздоровления больных, но сопровождается увеличением частоты побочных эффектов.
ЛИТЕРАТУРА
- McCaig LF, Hughes JM. Trends in antimicrobial drug prescribing among office-based physicians in the United States. JAMA 1995; 273: 214-9.
- Ball P, Baquero F, Cars O et al. Antibiotic therapy of community respiratory tract infections: strategies for optimal outcomes and minimized resistance emergence. J Antimicrob Chemother 2002; 49 (1): 31-40.
- Schlemmer B. Impact of registration procedures on antibiotic polices. Clin Microbiol Infect Dis 2001; 7 (Suppl. 6): 5-8.
- Gonzales R, Bartlett JG, Besser RE et al. Principles of appropriate antibiotic use for treatment of acute respiratory tract infections in adults: background, specific aims, and methods. Ann Intern Med 2001; 134 (6): 479-86.
- Snow V, Gonzales R. Principles of appropriate antibiotic use for treatment of nonspecific upper respiratory tract infections in adults. Ann Intern Med 2001; 134 (6): 487-9.
- Gonzales R, Steiner JF, Sande MA. Antibiotic prescribing for adults with colds, upper respiratory tract infection, and bronchitis by ambulatory care physicians. JAMA 1997; 278: 901-4.
- Hickner JM, Bartlett JG, Besser RE et al. Principles of appropriate antibiotic use for acute rhinosinusitis in adults: background. Ann Intern Med 2001; 134 (6): 498-505.
- Williams JW, Aguilar C, Makela M et al. Antibiotic therapy for acute sinusitis: a systematic literature review. Eds. R.Douglas, C.Bridges-Webb. Acute Respiratory Infections Module of the Cochrane Database of Systematic reviews. The cochrane Library. Oxford: Updated Software; 1997.
- Zucher DR, Balk E, Engels E et al. Agency for Health Care Policy and Research Publication N.99-E016: Evidence Report/Technology Assessment Number 9. Diagnosos and treatment of acute bacterial rhinosinusitis.
- Low DE. Antimicrobial drug use and resistance among respiratory pathogens in the community. Clin Infect Dis 2001; 33 (Suppl. 3): S206-13.
- Guillemot D. How to evaluate and predict the epidemiologic impact of antibiotic use in humans: the pharmacoepidemiologic approach. Clin Microbiol Infect 2001; 7 (Suppl. 5): 19-23.
- Perez-Trallero E. Pneumococcal macrolide resistance - not a myth. J Antimicrob Chemother 2000; 45: 401-2.
- Dagan R, Piglansky L, Yagupsky P et al. Bacteriologic response in acute otitis media: comparison between azithromycin, cefaclor, amoxicillin . In Program and Abstract of the 37th Interscience Conference on Antimicrobial Agents and chemotherapy. Sep. 28 - Oct. 1, 1997, Toronto, Canada.
- Jacobs MR, Dagan R, Rose FV et al. Correlation of bacteriologic outcome and antimicrobial susceptibility of Streptococcus pneumoniae and Haemophilus influenzae in acute otitis media treated with amoxicillin-clavulanate and azithromycin . 39th Interscience Conference on Antimicrobial Agents and Chemotherapy. September 1999; 707.
- Сидоренко С.В., Яковлев С.В. Инфекции в интенсивной терапии. 2-е изд. М.: Бионика, 2003; 208.
- Baquero F. Pneumococcal resistance to beta-lactam antibiotics: a global geographic overview. Microb Drug Resist 1995; 1: 115-20.
- Guillemot D, Carbon C, Thibult N et al. Macrolide use is associated with macrolide resistant (MRSp) and penicillin resistant (PRSp) Streptococcus pneumoniae. 40th ICAAC. Toronto: ASM 2000; 1863: 1.
- Bryskier A. Viridans group Streptococci: a reservoir of resistant bacteria in oral cavities. Clin Microbiol Infect 2002; 8: 65-9.
- Fujita K, Murono K, Yoshikawa M, Murai T. Decline of erythromycin resistance of group A Streptococci in Japan. Pediatr Infect Dis J 1994; 13: 1075-8.
- Seppala H, Klaukka T, Vuopio-Varkila J et al. The effect of changes in the consumption of macrolide antibiotics on erythromycin resistance in group A Streptococci in Finland. N Engl J Med 1997; 337: 441-6.
- Dowell SF (ed.). Principles of judicious use of antimicrobial agents for children"s upper respiratory tract infections. Pediatrics 1998; 1.
- Snow V, Mottur-Pilson C, Hickner JM. Principles of appropriate antibiotic use for acute sinusitis in adults. Ann Intern Med 2001; 134 (6): 495-7.
- Snow V, Mottur-Pilson C, Cooper RJ, Hoffman JR. Principles of appropriate antibiotic use for acute pharyngitis in adults. Ann Int Med 2001; 134 (6): 506-8.
- Lund VJ, Grouin JM, Eccles R et al. Efficacy of fusafungine in acute rhinopharingitis: a pooled analysis. Rhinology 2004; 43: 207-12.
- Mosges R, Spaeth J, Berger K, Dubois F. Topical treatment of rhinosinusitis with fusafungine nasal spray. Arzneim.-Forsch. Drug Res 2002; 52 (12): 877-83.
- German-Fattal M, Mosges R. How to improve current therapeutic standarts in upper respiratory infections: value of fusafungine. Curr Med Res Opin 2004; 20 (11): 1769-76.







