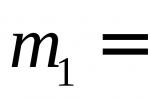De methode is gebaseerd op de bepaling van de wijnrode kleur die kenmerkend is voor de complexen gevormd door ferri-ionen en rhodanide-ionen. Deze complexen zijn onstabiel, daarom is een grote overmaat aan rhodanide-ionen vereist om de dissociatie van het complex te onderdrukken. Het proces van interactie van ferri-ionen met rhodanide-ionen verloopt volgens vergelijking (1):
|
Fe 3+ + 6 NH 4 CNS \u003d 6NH 4 + + 3- |
Er moet rekening mee worden gehouden dat naast 3- ook andere, minder intens gekleurde complexen kunnen worden gevormd, zodat de concentratie van ammoniumthiocyanaat hetzelfde moet zijn in de geanalyseerde en standaardoplossingen. Sterke oxidatiemiddelen (kaliumpermanganaat, ammoniumpersulfaat, waterstofperoxide, enz.), die het rhodanide-anion oxideren, evenals stoffen die ijzer (III) tot ijzer (II) reduceren, interfereren met de bepaling. Het beste medium is salpeterzuur, terwijl de toch al lage zuurgraad van de oplossing voldoende is om de hydrolyse van het ijzerzout te voorkomen (1-2 ml geconcentreerd salpeterzuur per 50 ml oplossing).
reagentia
Ammoniumthiocyanaat (NH4CNS), 10% oplossing;
Salpeterzuur, geconcentreerd;
Basis standaard oplossing. Om de basische standaardoplossing te bereiden, wordt 0,8634 g ijzerammoniumaluin opgelost in een kleine hoeveelheid gedestilleerd water. Als de oplossing ondoorzichtig blijkt te zijn, voeg dan enkele druppels geconcentreerd salpeterzuur toe en breng het volume op 1 liter. De oplossing bevat 0,1 mg ijzer per 1 ml;
Werkende standaard oplossing. De werkstandaardoplossing wordt bereid door de standaardvoorraadoplossing 10 keer te verdunnen. De oplossing bevat 0,01 mg ijzer per 1 ml.
Voortgang
Voeg in maatkolven van 100 ml 1 en 5 ml van de standaard werkende oplossing toe, evenals 1; 2,5 en 5 ml van de belangrijkste standaardoplossing van ijzer en breng het volume op de maat met gedestilleerd water, waarbij oplossingen worden verkregen met een concentratie van 0,1; 0,5; 1,0; 2,5; en 5,0 µg/l, respectievelijk. De bereide oplossingen en 100 ml van het testmonster worden in conische kolven van 150 ml gegoten, 5 ml geconcentreerd HN03 en 10 ml van een 10% NH4 CNS-oplossing worden aan elk toegevoegd. De oplossingen worden grondig gemengd en na 3 minuten worden ze gefotometerd bij een golflengte van λ = 450 nm, met behulp van cuvetten met een optische laagdikte van 5 mm, in verhouding tot gedestilleerd water, waaraan dezelfde reagentia zijn toegevoegd. De massaconcentratie van ijzer wordt gevonden volgens een geijkte grafiek. Er wordt een kalibratiegrafiek gemaakt, waarin de massaconcentratie van ijzer in μg / dm 3 langs de as van de abscis wordt uitgezet, en de overeenkomstige optische dichtheidswaarde langs de ordinaat-as.
Bepaling van het chroomgehalte met behulp van difenylcarbazide
methode principe:
De methode is gebaseerd op de interactie van chromaten en dichromaten in een zuur medium met difenylcarbazide om een rood-violet gekleurde verbinding te vormen, waarin chroom aanwezig is in de gereduceerde vorm van Cr(III), en difenylcarbazide wordt geoxideerd tot difenylcarbazon. De detectielimiet is 0,02 mg/l. Het bereik van gemeten hoeveelheden chroom in het monster is van 1 µg tot 50 µg.
Bij het analyseren van water in het ene monster wordt alleen Cr(vi) bepaald en in het andere het totale gehalte aan Cr(iii) en Cr(vi), waarin Cr(III) wordt geoxideerd tot Cr(VI), wordt bepaald . Ammoniumpersulfaat wordt gebruikt als oxidatiemiddel. Het oxidatieproces verloopt volgens vergelijking (2):
|
2Cr 3+ + 3S 2 O 8 2- + 7H 2 O Cr 2 O 7 2- + 6SO 4 2- + 14H + |
Het verschil in de resultaten bepaalt het gehalte aan Cr 3+.
reagentia
Bi-gedestilleerd water (gebruikt voor de bereiding van alle reagentia);
Zwavelzuur, 1:1;
Fosforzuur geconcentreerd;
Difenylcarbazide (C 13 H 14 ON 4), 0,5% oplossing in aceton (vers bereid gebruikt);
Natriumhydroxide-oplossing, 10% en 25%;
Kaliumbichromaat basische standaardoplossing K 2 Cr 2 O 7 . De standaardvoorraadoplossing wordt bereid door 2,8285 g van het reagens op te lossen, gedroogd bij 150°C, in twee-gedestilleerd water en aan te vullen tot 1 L (1 ml oplossing bevat 1 mg Cr(VI);
Standaard werkoplossing 1. Bereid door 5 ml van de standaard voorraadoplossing te verdunnen met twee-gedestilleerd water tot 100 ml (1 ml van de resulterende oplossing bevat 50 µg Cr(VI));
Standaard werkoplossing 2. Bereid door 4 ml werkstandaardoplossing 1 tot 100 ml te verdunnen met twee-gedestilleerd water (1 ml van de resulterende oplossing bevat 2 µg Cr(VI)).
Constructie van een kalibratiegrafiek
Neem in maatkolven met een inhoud van 100 ml 0; 0,5; 1,0; 2.0; 3,0; 5,0; 8,0; 10,0 ml werkende standaardoplossing 2, breng het volume van de oplossingen op 50-60 ml, stel de pH in op 8 met een alkalische oplossing, controleer met universeel indicatorpapier. Giet 1 ml H 2 SO 4 (1:1) en 0,3 ml H 3 PO 4, breng het volume op 100 ml. De resulterende oplossingen hebben een concentratie van Cr(VI) 0; tien; twintig; 40; 60; 100; 160; 200 µg/l. Voeg 2 ml 0,5% difenylcarbazide-oplossing toe aan elke kolf en meng goed. De resulterende oplossingen na 10-15 minuten. fotometrie bij een golflengte van λ=540 nm, gebruikmakend van cuvetten met een optische laagdikte van 30 mm, in verhouding tot gedestilleerd water, waaraan dezelfde reagentia zijn toegevoegd.
Definitie van inhoudCr(VI)
In een maatkolf met een volume van 100 ml wordt een zodanig volume van het monster geplaatst dat het 0,005 tot 0,1 mg chroom bevat, de pH wordt ingesteld op 8 met een zure of alkalische oplossing, gecontroleerd door universeel indicatorpapier. Giet 1 ml H 2 SO 4 (1:1) en 0,3 ml H 3 RO 4 , breng het volume op 100 ml en meng. Voeg 2 ml 0,5% difenylcarbazide-oplossing toe aan elke kolf en meng opnieuw. De resulterende oplossingen na 10-15 minuten. fotometrie zoals hierboven.
a) Reactie met kaliumhexacyanoferraat (II) - kaliumferrocyanide K 4 (farmacopee). Fe 3+-kationen in een zuur medium reageren met kaliumferrocyanide om een donkerblauw precipitaat van "Pruisisch blauw" te vormen - een complexe verbinding van hexacyanoferraat (II) ijzer (III) Fe 4 3 X H 2 O met een variabel aantal watermoleculen. Er wordt aangetoond dat, afhankelijk van de neerslagomstandigheden, het Pruisisch blauw precipitaat, net als het Turnbull blauwe precipitaat (zie hierboven), andere kationen uit de oplossing meevoert, zodat de samenstelling verandert en kan overeenkomen met de KFe 3+ formule:
Fe 3+ + K + + 4- →FeK↓
De reactie is specifiek. De reactie wordt belemmerd door oxidatiemiddelen die het reagens oxideren.
Uitvoering van de reactie. 2-3 druppels ijzer(III)zoutoplossing worden aan de reageerbuis toegevoegd, 1-2 druppels HCl-oplossing en 2 druppels K4-oplossing worden toegevoegd. De oplossing wordt blauw en een donkerblauw neerslag van "Pruisisch blauw" slaat neer.
b) Reactie met thiocyanaationen (farmacopee). Zouten van Fe 3+ vormen rood ijzer (III) thiocyanaat. De reactie wordt uitgevoerd in een zuur milieu. De samenstelling van het resulterende complex is niet constant en kan variëren van 2+ tot 3- afhankelijk van de concentratie van Fe 3+ en SCN - ionen. Deze reactie wordt soms gebruikt om ijzer te detecteren in combinatie met reactie 1, met kaliumhexacyanoferraat(II). Eerst wordt door toevoeging van NH 4 SCN een rood complex van ijzerthiocyanaat verkregen, dat vervolgens wordt overgebracht door kaliumhexacyanoferraat (II) toe te voegen aan een blauw neerslag van ijzer (III) hexacyanoferraat (II) kalium:
Fe 3+ + 3SCN - →Fe(SCN) 3
De gevoeligheid van de reactie is 0,25 µg. De reactie wordt gehinderd door anionen van zuurstofzuren (fosfor, arseen, enz.), fluoriden, die verbindingen vormen met Fe 3+ en NO 2, waardoor SCN - een rode NOSCN-verbinding - ontstaat.
Uitvoering van de reactie. 3-4 druppels ijzer (III) zoutoplossing worden toegevoegd aan de reageerbuis en 2-3 druppels ammoniumthiocyanaat NH4NCS of kalium KNCS-oplossing worden toegevoegd. De oplossing wordt blauw.
c) Reactie met natriumsulfide (farmacopee). Natriumsulfide slaat neer uit neutrale en licht alkalische oplossingen van ijzer (III) zouten een zwart neerslag Fe 2 S 3:
2Fe 3+ + 3S 2- → Fe 2 S 3 ↓
Het Fe 2 S 3 precipitaat is oplosbaar in minerale zuren.
Uitvoering van de reactie. 3-4 druppels ijzer (III) zoutoplossing worden toegevoegd aan de reageerbuis en 2-3 druppels ammoniumsulfide-oplossing of waterstofsulfidewater worden toegevoegd. Er komt een zwart neerslag van ijzer(III)sulfide vrij.
d) Reactie met hydroxiden. Het neerslag van ijzerhydroxide (III) Fe (OH) 3, dat ontstaat door de interactie van Fe 3+ met hydroxide-ionen, is onoplosbaar in alkalische oplossingen en daarom behoort Fe 3+ volgens de zuur-baseclassificatie tot de groep van kationen, waarvan de hydroxiden onoplosbaar zijn in alkaliën. Het Fe(OH)3-precipitaat is oplosbaar in verdunde zuren; we lossen niet op in een verzadigde oplossing van ammoniumchloride (in tegenstelling tot het witte neerslag van Fe (OH) 2).
Uitvoering van de reactie. 3-4 druppels ijzer(III)zoutoplossing worden aan de reageerbuis toegevoegd en 3-4 druppels NaOH worden toegevoegd. Er valt een roodbruin neerslag van ijzerhydroxide (III) Fe (OH) 3 uit.
e) Reactie met sulfosalicylzuur (farmacopee). Het Fe 3+ kation reageert in waterige oplossingen met sulfosalicylzuur bij pH ≈ 9-11,5 onder vorming van gele complexen: Fe 3+ + L 2- → 3- ,
waarbij L2- de aanduiding is van het sulfosalicylaatanion gevormd uit sulfosalicylzuur na eliminatie van twee protonen, vermoedelijk uit groepen
–COOH en –SO 3 H.
Het meest stabiele complex is geel en bevat ijzer (III) en anionen van sulfosalicylzuur in een molaire verhouding van ijzer (III): sulfosalicylaatanionen, gelijk aan 1:3, d.w.z. Er zijn drie sulfosalicylaatliganden per ijzeratoom. Dit complex domineert in de ammoniakoplossing. De exacte structuur van de complexen in oplossing is onbekend. De gevoeligheid van de reactie is 5-10mkg.
Uitvoering van de reactie. ~5 druppels ijzer(III)zoutoplossing worden toegevoegd aan de reageerbuis, ~10 druppels sulfosalicylzuuroplossing en ~0,5 ml geconcentreerde ammoniakoplossing worden toegevoegd. De oplossing krijgt een gele kleur.
Analytische reacties van magnesium (II) kationen.
a) Reactie met alkaliën. Alkali-oplossingen scheiden van oplossingen van magnesiumzouten een wit gelatineus neerslag van magnesiumhydroxide Mg (OH) 2, gemakkelijk oplosbaar in zuren en oplossingen van ammoniumzouten:
Mg(OH) 2 ↓+ 2HCI→MgCI 2 + 2H 2 O
Mg(OH) 2 ↓+ 2NH 4 CI→ MgCl 2 + 2NH 4 OH
Uitvoering van de reactie. Voeg aan 1-2 druppels van een oplossing die magnesiumionen bevat 2-3 druppels 1M NaOH toe. Er vormt zich een wit gelatineus neerslag. Het resulterende neerslag wordt in 2 reageerbuizen verdeeld. Voeg 3-4 druppels HCl toe aan de 1e buis, het neerslag lost op. We voegen 3-4 druppels NH 4 Cl toe aan het 2e buisje, ook het neerslag lost op.
b) Reactie met kaliumhypojodiet. Wanneer jodium interageert met alkali, wordt kaliumhypojodiet KIO gevormd; in dit geval verschuift het evenwicht in de oplossing naar rechts en wordt het kleurloos:
I 2 + 2OH - ↔I - + IO - + H 2 O
Wanneer een magnesiumzout wordt toegevoegd, vormen Mg 2+-ionen een neerslag van Mg (OH) 2 met OH-ionen - een neerslag van Mg (OH) 2, wat een verschuiving van het evenwicht naar links veroorzaakt. Het daarbij vrijkomende jodium wordt door het Mg(OH)2-precipitaat geadsorbeerd en kleurt het in een roodbruine kleur.
Uitvoering van de reactie. De oplossing van Lugol wordt ontkleurd door druppelsgewijze KOH-oplossing toe te voegen. Aan de verkregen kleurloze oplossing wordt een magnesiumzoutoplossing toegevoegd. Een amorf neerslag, roodbruin gekleurd, valt meteen op.
c) Reactie met natriumwaterstoffosfaat (farmacopee). Natriumwaterstoffosfaat vormt een wit kristallijn precipitaat met magnesiumionen in aanwezigheid van NH 3 bij pH ~ 9:
Bij pH > 10 kunnen Mg(OH)2 en Mg 3 (PO 4) 2 gevormd worden. Het wordt aanbevolen om NH 3 toe te voegen aan de zure geanalyseerde oplossing tot pH ~9. Door de vorming van NH 4 C1 wordt de pH van de oplossing constant gehouden. Het neerslag is oplosbaar in sterke zuren en in azijnzuur:
MgNH 4 PO 4 ↓+ 3HCI → H 3 PO 4 + MgCI 2 + NH 4 CI
MgNH 4 PO 4 ↓+ 2CH 3 COOH → Mg(CH 3 COO) 2 + NH 4 H 2 PO 4
De aantoonbaarheidsgrens voor magnesium is 10 g. Interfereren met ionen die slecht oplosbare fosfaten vormen; NH4+, K(I) en Na(I) interfereren niet.
Uitvoering van de reactie. Voeg aan 1-2 druppels van een oplossing die magnesiumionen bevat 2-3 druppels 2 M HCl, 1 druppel Na 2 HPO 4-oplossing toe en voeg onder roeren 2 M NH 3 druppelsgewijs toe totdat de geur van ammoniak verschijnt (pH ~ 9). Er valt een wit kristallijn neerslag uit.
d) Reactie met 8-hydroxychinoline (luminescerende reactie). 8-Oxyquinoline vormt met magnesiumionen bij pH 9 - 12 een fluorescerend groen licht oxyquinoline:
De aantoonbaarheidsgrens voor magnesium is 0,025 µg. De intensiteit van de gloed neemt toe wanneer een natte plek wordt behandeld met magnesiumoxychinolinaat met een oplossing van NH 3 . Al(III), Zn(II) interfereren.
Een reactie uitvoeren. Een druppel van een oplossing die magnesiumionen bevat en een druppel van een ethanoloplossing van het reagens worden op het filterpapier aangebracht. Het resulterende magnesiumhydroxychinolinaat wordt behandeld met een druppel 10% ammoniakoplossing. Bij het bekijken van een natte plek in ultraviolet licht, wordt een groene gloed waargenomen.
e) Reactie met quinalizarine (1,2,5,8-tetraoxyantrachinon)(I). Quinalizarine (1,2,5,8-tetrahydroxyantrachinon)(I) vormt met magnesiumionen een slecht oplosbare blauwe verbinding in een alkalische oplossing, waaraan de structuur (II) wordt toegeschreven:
 |
|||
 |
|||
Aangenomen wordt dat quinalizarinevernis een adsorptieverbinding is van magnesiumhydroxide met een reagens. De vorming van chelaten van wisselende samenstelling is zeer waarschijnlijk.
De detectielimiet van magnesium is 5 g. De detectie wordt niet verstoord door aardalkalimetaalionen; in aanwezigheid van een voldoende grote hoeveelheid alkali interfereren aluminiumionen niet.
Het ammoniumion verstoort de detectie van het magnesiumion omdat het de vorming van magnesiumhydroxide voorkomt. De reagensoplossing in een alkalisch medium is paars gekleurd, dus een controle-experiment is noodzakelijk.
Uitvoering van de reactie. Voeg aan 1-2 druppels van een oplossing die magnesiumionen bevat 1 druppel quinalizarine-oplossing en 2 druppels van een 30% NaOH-oplossing toe. Er ontstaat een blauw neerslag. Om een controle-experiment uit te voeren, voegt u één druppel van een quinalizarine-oplossing, 2 druppels van een 30% NaOH-oplossing toe aan 1-2 druppels water. De oplossing wordt paars.
4. Testcontrole 1
Kwalitatieve reacties voor ijzer (III)
Ionen van ijzer (III ) in oplossing kan worden bepaald met behulp van kwalitatieve reacties. Laten we er een paar doornemen. Neem voor het experiment een oplossing van ijzerchloride ( III).
1. III) - reactie met alkali.
Als de oplossing ijzerionen bevat ( III ), wordt ijzerhydroxide gevormd ( III ) Fe(OH)3. De basis is onoplosbaar in water en bruin van kleur. (ijzerhydroxide ( II ) Fe(OH)2. - ook onoplosbaar, maar grijsgroen van kleur). Een bruin neerslag duidt op de aanwezigheid van ijzerionen in de initiële oplossing ( III).
FeCl 3 + 3 NaOH = Fe(OH) 3 ↓+ 3 NaCl
2. Kwalitatieve reactie op ijzerion ( III ) - reactie met geel bloedzout.
Het gele bloedzout is hexacyanoferraatkaliumK 4 [ Fe( CN) 6]. (Voor de bepaling van ijzer (II) gebruik rood bloedzoutK 3 [ Fe( CN) 6 ]). Voeg aan een deel van een oplossing van ijzerchloride een oplossing van geel bloedzout toe. Het blauwe neerslag van Pruisisch blauw* duidt op de aanwezigheid van ferri-ionen in de oorspronkelijke oplossing.
3 Tot 4 +4 FeCl3 = K Fe ) ↓ + 12 KCl
3. Kwalitatieve reactie op ijzerion ( III ) - reactie met kaliumthiocyanaat.
Eerst verdunnen we de testoplossing - anders zien we de verwachte kleur niet. In aanwezigheid van een ijzerion (III) wanneer kaliumthiocyanaat wordt toegevoegd, wordt een rode stof gevormd. Het is ijzerthiocyanaatIII). Rhodanide van het Griekse "rodeos" - rood.
FeCl 3 + 3 KCNS= Fe( CNS) 3 + 3 KCl
Pruisisch blauw werd aan het begin van de 18e eeuw bij toeval in Berlijn verkregen door de kleurstofmaker Diesbach. Disbach kocht een ongebruikelijke potas (kaliumcarbonaat) van een handelaar: een oplossing van deze potas werd blauw als ijzerzouten werden toegevoegd. Bij controle van de potas bleek deze gebrand te zijn met runderbloed. De kleurstof bleek geschikt voor stoffen: helder, stabiel en goedkoop. Al snel werd het recept voor het verkrijgen van verf bekend: potas werd versmolten met gedroogd dierlijk bloed en ijzervijlsel. Door een dergelijke legering uit te logen werd geel bloedzout verkregen. Nu wordt Pruisisch blauw gebruikt om drukinkt en tintpolymeren te verkrijgen. .
Apparatuur: kolven, pipet.
Veiligheid . Houd u aan de regels voor het omgaan met alkalische oplossingen en oplossingen hexacyanoferraten. Vermijd contact van oplossingen van hexacyanoferraten met geconcentreerde zuren.
Ervaringsverklaring – Elena Makhinenko, tekst– Ph.D. Pavel Bespalov.
Van Wikipedia, de gratis encyclopedie
| IJzer(III)thiocyanaat | |
| Algemeen | |
|---|---|
| systematische Naam |
IJzer(III)thiocyanaat |
| traditionele namen | ijzerthiocyanaat; thiocyanaat ijzer |
| Chem. formule | Fe(SCN) 3 |
| Fysieke eigenschappen | |
| Staat | rode kristallen met een groenachtige tint |
| Molaire massa | 230,09 gram/ wrat |
| Gegevens worden verstrekt voor: standaardomstandigheden (25 °C, 100 kPa), tenzij anders vermeld. | |
IJzer(III)thiocyanaat- anorganische verbinding, metaalzout klier en thiocyaanzuur met de formule Fe(SCN) 3 , lost op in water, vormt kristallijn hydraat- rode kristallen.
Ontvangst
- uitwisselingsreacties:
- oplossing neutralisatie thiocyaanzuur vers geplant ijzer (III) hydroxide :
Fysieke eigenschappen
IJzer(III)thiocyanaat vormt Fe(SCN) 3 3H 2 O kristallijn hydraat - paramagnetisch rood hygroscopisch in water oplosbare kristallen ethanol , uitzending, matig oplosbaar in koolstofdisulfide , benzeen , chloroform , tolueen.
Waterige oplossingen bevatten Fe 6H 2 O-dimeren.
Chemische eigenschappen
- Vormt coördinatieverbindingen met thiocyanaten van andere metalen hexathiocyanatoferraten (III), bijvoorbeeld Li 3 n H 2 O, Na 3 12 H 2 O, K 3 4 H 2 O, Cs 3 2 H 2 O, (NH 4) 3 4 H 2 O.
Schrijf een recensie over het artikel "IJzer(III)thiocyanaat"
Literatuur
- Chemical Encyclopedia / Red.: Knunyants I.L. en anderen. - M.: Soviet Encyclopedia, 1990. - T. 2. - 671 p. - ISBN 5-82270-035-5.
- Ripan R., Chetyanu I. Anorganische scheikunde. Chemie van metalen. - M.: Mir, 1972. - T. 2. - 871 d.
| het artikelstub over anorganische materie. U kunt het project helpen door er iets aan toe te voegen. |
Een fragment dat ijzer (III) thiocyanaat karakteriseert
- Naar het volgende leven? - herhaalde Prins Andrei, maar Pierre gaf hem geen tijd om te antwoorden en nam deze herhaling voor een ontkenning, vooral omdat hij de voormalige atheïstische overtuigingen van Prins Andrei kende.– Je zegt dat je het rijk van goedheid en waarheid op aarde niet kunt zien. En ik heb hem niet gezien, en je kunt hem niet zien als je naar ons leven kijkt als het einde van alles. Op aarde, precies op deze aarde (Pierre wees naar het veld), is er geen waarheid - alles is een leugen en slecht; maar in de wereld, in de hele wereld, is er een koninkrijk van waarheid, en we zijn nu de kinderen van de aarde, en voor altijd de kinderen van de hele wereld. Voel ik in mijn ziel niet dat ik deel uitmaak van dit uitgestrekte, harmonieuze geheel. Heb ik niet het gevoel dat ik in dit enorme, ontelbare aantal wezens ben waarin het Goddelijke wordt gemanifesteerd - de hoogste macht, zoals je wilt - dat ik één schakel ben, één stap van lagere wezens naar hogere. Als ik zie, ik zie duidelijk deze ladder die van de plant naar de mens leidt, waarom zou ik dan veronderstellen dat deze ladder bij mij onderbroken wordt en niet verder en verder leidt. Ik voel dat ik niet alleen niet kan verdwijnen, zoals niets in de wereld verdwijnt, maar dat ik er altijd zal zijn en altijd geweest zal zijn. Ik voel dat er naast mij geesten boven mij leven en dat er waarheid in deze wereld is.
"Ja, dit is de leer van Herder," zei prins Andrei, "maar niet dat, mijn ziel, zal me overtuigen, maar leven en dood, dat is wat overtuigt. Het overtuigt dat je een dierbaar wezen ziet dat met je verbonden is, voor wie je schuldig was en hoopte jezelf te rechtvaardigen (prins Andrei beefde in zijn stem en wendde zich af) en plotseling lijdt dit wezen, lijdt en houdt op te zijn. .. Waarom? Het kan niet zo zijn dat er geen antwoord is! En ik geloof dat hij... Dat is wat overtuigt, dat is wat mij overtuigde, - zei prins Andrei.
"Nou, ja, ja," zei Pierre, "is dat niet wat ik ook zeg!"
- Niet. Ik zeg alleen dat het niet argumenten zijn die je overtuigen van de noodzaak van een toekomstig leven, maar wanneer je hand in hand met een persoon in het leven loopt, en deze persoon plotseling in het niets verdwijnt, en jijzelf stopt voor deze afgrond en er naar kijken. En ik keek...
- Nou, wat dan nog! Weet jij wat er is en wat iemand is? Er is een toekomstig leven. Iemand is God.
Prins Andrew antwoordde niet. Het rijtuig en de paarden waren allang naar de andere kant gebracht en waren al neergezet, en de zon was al tot de helft verdwenen, en de avondvorst bedekte de plassen bij de veerboot met sterren, en Pierre en Andrei, tot verbazing van de lakeien, koetsiers en vervoerders, stonden nog steeds op de veerboot te praten.
- Als er een God is en er is een toekomstig leven, dan is er waarheid, is er deugd; en het hoogste geluk van de mens is ernaar te streven ze te bereiken. We moeten leven, we moeten liefhebben, we moeten geloven, - zei Pierre, - dat we nu niet alleen op dit stuk land leven, maar dat we daar in alles hebben geleefd en voor altijd zullen leven (hij wees naar de lucht). Prins Andrei stond op de reling van de veerboot geleund en luisterde naar Pierre, zonder zijn ogen af te wenden, naar de rode weerspiegeling van de zon over de blauwe vloed. Pierre is stil. Het was helemaal stil. De veerboot was lang geleden geland en alleen de golven van de stroming raakten met een zwak geluid de bodem van de veerboot. Het leek prins Andrei dat dit spoelen van de golven tegen Pierre's woorden zei: "Dat is waar, geloof dit."
Prins Andrei zuchtte en keek met een stralende, kinderlijke, tedere blik in Pierre's blos, enthousiast, maar nog steeds timide in het bijzijn van zijn superieure vriend.
“Ja, als dat het geval was!” - hij zei. "Maar laten we gaan zitten," voegde prins Andrei eraan toe, en hij verliet de veerboot, keek naar de lucht, die Pierre hem wees, en voor de eerste keer, na Austerlitz, zag hij die hoge, eeuwige lucht, die hij zag liggen op het veld van Austerlitz, en iets dat lang sliep, iets het beste dat in hem was, werd plotseling blij en jeugdig wakker in zijn ziel. Dit gevoel verdween zodra prins Andrei weer in de gewone levensomstandigheden kwam, maar hij wist dat dit gevoel, dat hij niet wist te ontwikkelen, in hem leefde. Een ontmoeting met Pierre was voor prins Andrei een tijdperk waaruit, hoewel het uiterlijk hetzelfde was, maar in de innerlijke wereld, zijn nieuwe leven begon.
Het werd al donker toen prins Andrei en Pierre naar de hoofdingang van het Lysogorsky-huis reden. Terwijl ze aanreden, vestigde prins Andrei met een glimlach de aandacht van Pierre op de onrust die had plaatsgevonden op de achterportiek. Een gebogen oude vrouw met een knapzak op haar rug, en een korte man in een zwart gewaad en met lang haar, die een rijtuig zagen binnenrijden, haastten zich om door de poort terug te rennen. Twee vrouwen renden achter hen aan, en alle vier, omkijkend naar het rijtuig, renden ze de achterveranda op.
"Dit zijn Gods Machines", zei prins Andrei. Ze hielden ons voor hun vader. En dit is het enige waarin ze hem niet gehoorzaamt: hij beveelt deze zwervers te verdrijven, en zij accepteert ze.
- Wat is Gods volk? vroeg Pierre.
Prins Andrei had geen tijd om hem te antwoorden. De bedienden gingen hem tegemoet en hij vroeg waar de oude prins was en hoe snel ze op hem wachtten.
De oude prins was nog in de stad en ze wachtten elke minuut op hem.
Prins Andrei leidde Pierre naar zijn vertrekken, die hem altijd in perfecte staat opwachtten in het huis van zijn vader, en hij ging zelf naar de kinderkamer.
"Laten we naar mijn zus gaan," zei prins Andrei, terugkerend naar Pierre; - Ik heb haar nog niet gezien, ze verstopt zich nu en zit bij haar Godvolk. Als je haar goed dient, zal ze zich schamen, en je zult Gods volk zien. C "est curieux, ma parole. [Dit is merkwaardig, eerlijk gezegd.]
- Qu "est ce que c" est que [Wat is] Gods volk? vroeg Pierre.
- Maar je zult zien.
Prinses Mary schaamde zich echt en bloosde op sommige plekken toen ze haar binnenkwamen. In haar knusse kamer met lampen voor de iconenkasten, op de bank, bij de samovar, zat naast haar een jongen met een lange neus en lang haar, en in een monastieke soutane.
Op een fauteuil naast hem zat een gerimpelde, magere oude vrouw met een zachtmoedige uitdrukking van een kindergezicht.
- Andre, pourquoi ne pas m "avoir prevenu? [Andrey, waarom hebben ze me niet gewaarschuwd?] - zei ze met zachtmoedige verwijten, staande voor haar zwervers, als een kip voor kippen.