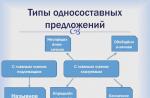
La fel ca în Chimie organica baza teoretică fundamentală este Legea periodică și Tabelul periodic al elementelor chimice ale lui D. I. Mendeleev, deci lider în chimia organică baza stiintifica servește drept teorie a structurii compusi organici Butlerov-Kekule-Cooper.
Ca orice altă teorie științifică, teoria structurii compușilor organici a fost rezultatul unei generalizări a celui mai bogat material factual pe care l-a acumulat chimia organică, care s-a conturat ca știință la începutul secolului al XIX-lea. Au fost descoperiți din ce în ce mai mulți compuși de carbon noi, al căror număr a crescut ca o avalanșă (Tabelul 1).
tabelul 1
Numărul de compuși organici cunoscuți în diferiți ani

Oamenii de știință explică această diversitate de compuși organici începutul XIX V. nu ar putea. Mai mult mai multe întrebări a provocat fenomenul de izomerie.
De exemplu, etanol iar dimetil eterul sunt izomeri: aceste substanţe au aceeași compoziție C2H60, dar structură diferită, adică ordine diferită de conectare a atomilor din molecule și, prin urmare proprietăți diferite.

F. Wöhler, deja cunoscut de tine, a descris chimia organică într-una dintre scrisorile sale către J. J. Berzelius: „Chimia organică poate acum să înnebunească pe oricine. Mi se pare o pădure deasă, plină de lucruri uimitoare, un desiș fără margini din care nu poți ieși, în care nu îndrăznești să pătrunzi...”
Dezvoltarea chimiei a fost foarte influențată de lucrările omului de știință englez E. Frankland, care, pe baza ideilor de atomism, a introdus conceptul de valență (1853).
Într-o moleculă de hidrogen H2 se formează o substanță chimică covalentă conexiune N-N, adică hidrogenul este monovalent. Valența unui element chimic poate fi exprimată prin numărul de atomi de hidrogen pe care un atom al elementului chimic îi adaugă sau îi înlocuiește. De exemplu, sulful din hidrogen sulfurat și oxigenul din apă sunt bivalenți: H2S sau H-S-H, H2O sau H-O-H, iar azotul din amoniac este trivalent:

În chimia organică, conceptul de „valență” este un analog al conceptului de „stare de oxidare”, cu care sunteți obișnuit să lucrați în cursul chimiei anorganice în școala de bază. Totuși, acesta nu este același lucru. De exemplu, în molecula de azot N2, starea de oxidare a azotului este zero, iar valența este trei:
![]()
În peroxidul de hidrogen H2O2, starea de oxidare a oxigenului este -1, iar valența este două:
![]()
În ionul de amoniu NH + 4, starea de oxidare a azotului este -3, iar valența este de patru:

De obicei, în legătură cu compușii ionici (clorură de sodiu NaCl și mulți alții substanțe anorganice cu o legătură ionică) nu folosesc termenul „valență” atomilor, ci iau în considerare starea lor de oxidare. Prin urmare, în chimia anorganică, unde majoritatea substanțelor au o structură nemoleculară, este de preferat să se folosească conceptul de „stare de oxidare”, iar în chimia organică, unde majoritatea compușilor au o structură moleculară, de regulă, conceptul de „ valenţă” este folosită.
Teoria structurii chimice este rezultatul unei generalizări a ideilor unor oameni de știință organici remarcabili din trei tari europene: germanul F. Kekule, englezul A. Cooper și rusul A. Butlerov.
În 1857, F. Kekule a clasificat carbonul ca element tetravalent, iar în 1858, împreună cu A. Cooper, a remarcat că atomii de carbon sunt capabili să se conecteze între ei în diverse lanțuri: liniare, ramificate și închise (ciclice).
Lucrările lui F. Kekule și A. Cooper au servit drept bază pentru dezvoltare teorie științifică, care explică fenomenul de izomerie, relația dintre compoziția, structura și proprietățile moleculelor de compuși organici. Această teorie a fost creată de omul de știință rus A.M. Mintea lui iscoditoare a fost cea care „a îndrăznit să pătrundă” în „pădurea deasă” a chimiei organice și să înceapă să transforme acest „desiș fără margini” într-o zonă inundată. lumina soarelui parc obișnuit cu un sistem de poteci și alei. Ideile de bază ale acestei teorii au fost exprimate pentru prima dată de A. M. Butlerov în 1861 la congresul naturaliştilor şi doctorilor germani de la Speyer.
Principalele prevederi și consecințe ale teoriei Butlerov-Kekule-Cooper asupra structurii compușilor organici pot fi formulate pe scurt după cum urmează.
1. Atomii din moleculele de substanțe sunt legați într-o anumită secvență în funcție de valența lor. Carbonul din compușii organici este întotdeauna tetravalent, iar atomii săi sunt capabili să se combine între ei, formând diverse lanțuri (liniare, ramificate și ciclice).
Compușii organici pot fi aranjați în rânduri de substanțe asemănătoare ca compoziție, structură și proprietăți - rânduri omoloage.
- Butlerov Alexandru Mihailovici (1828-1886), chimist rus, profesor la Universitatea din Kazan (1857-1868), din 1869 până în 1885 - profesor la Universitatea din Sankt Petersburg. Academician al Academiei de Științe din Sankt Petersburg (din 1874). Creatorul teoriei structurii chimice a compușilor organici (1861). A prezis și studiat izomeria multor compuși organici. A sintetizat multe substanțe.
De exemplu, metanul CH4 este strămoșul serii omoloage de hidrocarburi saturate (alcani). Cel mai apropiat omolog al său este etanul C2H6 sau CH3-CH3. Următorii doi membri ai seriei omoloage de metan sunt propanul C3H8, sau CH3-CH2-CH3, şi butanul C4H10, sau CH3-CH2-CH2-CH3, etc.
Este ușor de observat că pentru seria omologică se poate deriva o formulă generală pentru serie. Deci, pentru alcani asta formula generala CnH2n+2.
2. Proprietățile substanțelor depind nu numai de compoziția lor calitativă și cantitativă, ci și de structura moleculelor lor.
Această poziție a teoriei structurii compușilor organici explică fenomenul de izomerie. Este evident că pentru butanul C4H10, pe lângă o moleculă cu structură liniară CH3-CH2-CH2-CH3, este posibilă și o structură ramificată:

Aceasta este o substanță complet nouă, cu proprietăți individuale, diferite de proprietățile butanului cu o structură liniară.
Butanul, în molecula căreia atomii sunt aranjați într-un lanț liniar, se numește butan normal (n-butan), iar butanul, al cărui lanț de atomi de carbon este ramificat, se numește izobutan.

Există două tipuri principale de izomerie - structurală și spațială.
În conformitate cu clasificarea acceptată, se disting trei tipuri de izomerie structurală.
Izomeria scheletului de carbon. Compușii diferă în ordinea legăturilor carbon-carbon, de exemplu, n-butan și izobutan discutate. Acest tip de izomerie este caracteristic alcanilor.
Izomeria poziției unei legături multiple (C=C, C=C) sau a unei grupări funcționale (adică, un grup de atomi care determină dacă un compus aparține unei anumite clase de compuși organici), de exemplu:

Izomerie interclasă. Izomerii acestui tip de izomerie aparțin diferitelor clase de compuși organici, de exemplu, alcoolul etilic (clasa de alcooli monohidroxilici saturați) și dimetil eterul (clasa de eteri) discutate mai sus.
Există două tipuri de izomerie spațială: geometrică și optică.
Izomeria geometrică este caracteristică, în primul rând, compușilor cu o legătură dublă carbon-carbon, deoarece la locul unei astfel de legături molecula are o structură plană (Fig. 6).

Orez. 6.
Modelul moleculei de etilenă
De exemplu, pentru buten-2, dacă grupuri identice de atomi de la atomii de carbon de la legătura dublă sunt pe o parte a planului legăturii C=C, atunci molecula este un izomer cis, dacă pe părți opuse este un izomer trans.

Izomeria optică se observă, de exemplu, în substanțele ale căror molecule au un atom de carbon asimetric sau chiral legat la patru variat deputati. Izomerii optici sunt imagine in oglinda unul pe altul, ca două palme, și nu sunt compatibile. (Acum, evident, înțelegeți al doilea nume al acestui tip de izomerie: chiros grecesc - mână - un exemplu de figură asimetrică.) De exemplu, acidul 2-hidroxipropanoic (lactic), care conține un atom de carbon asimetric, există sub forma a doi izomeri optici.

În moleculele chirale, apar perechi izomerice în care moleculele izomerice sunt legate între ele în organizarea lor spațială în același mod ca un obiect și imaginea în oglindă este legată între ele. O pereche de astfel de izomeri are întotdeauna aceeași substanță chimică și proprietăți fizice, cu excepția activității optice: dacă un izomer rotește planul luminii polarizate în sensul acelor de ceasornic, atunci celălalt se rotește neapărat în sens invers acelor de ceasornic. Primul izomer se numește dextrogiro, iar al doilea se numește levogitor.
Importanța izomeriei optice în organizarea vieții pe planeta noastră este foarte mare, deoarece izomerii optici pot diferi semnificativ atât în activitatea lor biologică, cât și în compatibilitatea cu alți compuși naturali.
3. Atomii din moleculele de substanțe se influențează reciproc. Veți lua în considerare influența reciprocă a atomilor în moleculele compușilor organici în timpul studiului suplimentar al cursului.
Teoria modernă a structurii compușilor organici se bazează nu numai pe structura chimică, ci și pe structura electronică și spațială a substanțelor, care este discutată în detaliu la nivelul de profil al studiului chimiei.
În chimia organică, mai multe tipuri de formule chimice sunt utilizate pe scară largă.
Formula moleculară reflectă compoziție de înaltă calitate compuși, adică arată numărul de atomi ai fiecăruia dintre elementele chimice care formează molecula substanței. De exemplu, formula moleculară a propanului este: C3H8.
Formula structurală reflectă ordinea conexiunii atomilor dintr-o moleculă în funcție de valență. Formula structurală a propanului este:

Adesea nu este nevoie să descriem în detaliu legăturile chimice dintre atomii de carbon și hidrogen, așa că în cele mai multe cazuri sunt utilizate formule structurale prescurtate. Pentru propan, această formulă este scrisă după cum urmează: CH3-CH2-CH3.
Structura moleculelor de compuși organici este reflectată folosind diverse modele. Cele mai cunoscute sunt modelele volumetrice (la scară) și modelele cu bile și baston (Fig. 7).

Orez. 7.
Modele de molecule de etan:
1 - minge-și-tijă; 2 - scară
Cuvinte și concepte noi
- Izomerie, izomeri.
- Valenţă.
- Structura chimică.
- Teoria structurii compușilor organici.
- Seria omoloagă și diferența omoloagă.
- Formule moleculare și structurale.
- Modele de molecule: volumetrice (scara) și ball-and-stick.
Întrebări și sarcini
- Ce este valența? Cum diferă de starea de oxidare? Dați exemple de substanțe în care valorile stării de oxidare și ale valenței atomilor sunt numeric aceleași și diferite,
- Determinați valența și starea de oxidare a atomilor din substanțele ale căror formule sunt Cl 2, CO 2, C 2 H 6, C 2 H 4.
- Ce este izomerismul; izomeri?
- Ce este omologia; omologi?
- Cum, folosind cunoștințele de izomerie și omologie, se explică diversitatea compușilor de carbon?
- Ce se înţelege prin structura chimica molecule de compuși organici? Formulați prevederile teoriei structurii, care explică diferența de proprietăți ale izomerilor. Formulați prevederile teoriei structurii, care explică diversitatea compușilor organici.
- Ce contribuție a avut fiecare dintre oamenii de știință – fondatorii teoriei structurii chimice – la această teorie? De ce contribuția chimistului rus a jucat un rol principal în dezvoltarea acestei teorii?
- Pot exista trei izomeri ai compoziției C 5 H 12. Notează-le formulele structurale complete și prescurtate,
- Pe baza modelului moleculei de substanță prezentat la sfârșitul paragrafului (vezi, Fig. 7), compuneți formulele sale moleculare și structurale prescurtate.
- Calculați fracția de masă a carbonului din moleculele primilor patru membri ai seriei omoloage de alcani.
Teoria A.M. Butlerov
1. Atomii din molecule sunt legați între ei într-o anumită secvență prin legături chimice în conformitate cu valența lor. Ordinea în care atomii se leagă se numește structura lor chimică. Carbonul din toți compușii organici este tetravalent.
2. Proprietățile substanțelor sunt determinate nu numai de calitative și compoziţia cantitativă molecule, dar și structura lor.
3. Atomii sau grupurile de atomi se influențează reciproc, ceea ce determină reactivitatea moleculei.
4. Structura moleculelor poate fi stabilită pe baza studiului proprietăților lor chimice.
Compușii organici au un număr de trasaturi caracteristice, care le deosebesc de cele anorganice. Aproape toate (cu rare excepții) sunt inflamabile; Majoritatea compușilor organici nu se disociază în ioni, ceea ce se datorează naturii legăturilor covalente din substanțele organice. Legătura de tip ionic se realizează numai în sărurile acizilor organici, de exemplu, CH3COONa.
Seria omologa- aceasta este o serie nesfârșită de compuși organici care au o structură similară și, prin urmare, asemănătoare Proprietăți chimiceși diferă unele de altele prin orice număr de grupe CH2– (diferență omoloagă).

Chiar înainte de crearea teoriei structurii, erau cunoscute substanțe cu aceeași compoziție elementară, dar cu proprietăți diferite. Astfel de substanțe au fost numite izomeri, iar acest fenomen în sine a fost numit izomerie.
Baza izomerismului, așa cum arată A.M. Butlerov, constă diferența în structura moleculelor constând din același set de atomi.
Izomerie- acesta este fenomenul existenței compușilor care au aceeași compoziție calitativă și cantitativă, dar structuri diferite și, prin urmare, proprietăți diferite.


Există 2 tipuri de izomerie: structural izomerie şi spațială izomerie.
Izomerie structurală
Izomeri structurali– compuși de aceeași compoziție calitativă și cantitativă, care diferă în ordinea legăturilor atomilor, adică structura chimică.

Izomerie spațială
Izomeri spațiali(stereoizomerii) cu aceeași compoziție și aceeași structură chimică diferă aranjare spatiala atomi dintr-o moleculă.
Izomerii spațiali sunt izomeri optici și cis-trans (geometrici).
Izomerie cis-trans
constă în posibilitatea de a plasa substituenți pe una sau laturile opuse ale planului unei duble legături sau a inelului nearomatic izomeri cis substituenții sunt pe o parte a planului inelului sau a legăturii duble, în izomeri trans- în diverse feluri.

În molecula butenă-2 CH3–CH=CH–CH3, grupările CH3 pot fi localizate fie pe o parte a dublei legături - în izomerul cis, fie pe părți opuse - în izomerul trans.
Izomerie optică
Apare atunci când un carbon are patru substituenți diferiți.
Dacă schimbați oricare dintre ele, obțineți un alt izomer spațial cu aceeași compoziție. Caracteristici fizico-chimice Acești izomeri diferă semnificativ. Compușii de acest tip se disting prin capacitatea lor de a roti planul luminii polarizate transmise printr-o soluție de astfel de compuși cu o anumită cantitate. În acest caz, un izomer rotește planul luminii polarizate într-o direcție, iar izomerul său se rotește în direcția opusă. Datorită unor astfel de efecte optice, acest tip de izomerie se numește izomerie optică. 
Teoria structurii compușilor organici: omologie și izomerie (structurală și spațială). Influența reciprocă a atomilor în molecule
Teoria structurii chimice a compușilor organici de A. M. Butlerov
Așa cum pentru chimia anorganică baza dezvoltării este Legea periodică și Tabelul periodic al elementelor chimice ale lui D. I. Mendeleev, pentru chimia organică teoria structurii compușilor organici a lui A. M. Butlerov a devenit fundamentală.
Principalul postulat al teoriei lui Butlerov este poziția despre structura chimică a unei substanțe, care se referă la ordinea, succesiunea conexiunii reciproce a atomilor în molecule, adică. legătură chimică.
Structura chimică se referă la ordinea combinării atomilor elementelor chimice dintr-o moleculă în funcție de valența acestora.
Această ordine poate fi afișată folosind formule structurale în care valențele atomilor sunt indicate prin liniuțe: o liniuță corespunde unității de valență a unui atom al unui element chimic. De exemplu, pentru materie organică metan, având formula moleculară $CH_4$, formula structurala arata asa:
Principalele prevederi ale teoriei lui A. M. Butlerov
- Atomii din moleculele de substanțe organice sunt legați unul de celălalt în funcție de valența lor. Carbonul din compușii organici este întotdeauna tetravalent, iar atomii săi sunt capabili să se combine între ei, formând diverse lanțuri.
- Proprietățile substanțelor sunt determinate nu numai de compoziția lor calitativă și cantitativă, ci și de ordinea conexiunii atomilor din moleculă, adică de structura chimică a substanței.
- Proprietățile compușilor organici depind nu numai de compoziția substanței și de ordinea conexiunii atomilor din molecula sa, ci și de influența reciprocă a atomilor și a grupurilor de atomi unul asupra celuilalt.
Teoria structurii compușilor organici este o doctrină dinamică și în curs de dezvoltare. Pe măsură ce cunoștințele despre natură se dezvoltă legătură chimică, influența structurii electronice a moleculelor de substanțe organice a început să fie folosită, pe lângă empiricȘi structurale, electronice formule. Astfel de formule indică direcția deplasării perechi de electroniîntr-o moleculă.
Chimia cuantică și chimia structurii compușilor organici au confirmat doctrina direcției spațiale a legăturilor chimice ( cis-Și izomerie trans), studiat caracteristicile energetice tranzițiile reciproce ale izomerilor, au făcut posibilă evaluarea influenței reciproce a atomilor în molecule diverse substanțe, a creat premisele pentru prezicerea tipurilor de izomerie și a direcției și mecanismului de apariție reacții chimice.
Substanțele organice au o serie de caracteristici:
- Toate substanțele organice conțin carbon și hidrogen, așa că atunci când sunt arse se formează dioxid de carbon si apa.
- Substanțele organice sunt complexe și pot avea o greutate moleculară uriașă (proteine, grăsimi, carbohidrați).
- Substanțele organice pot fi aranjate în rânduri de omologi similari ca compoziție, structură și proprietăți.
- Pentru substanțele organice este caracteristic izomerie.
Izomeria și omologia substanțelor organice
Proprietățile substanțelor organice depind nu numai de compoziția lor, ci și de ordinea conexiunii atomilor din moleculă.

Izomerie este un fenomen al existenței diferite substanțe- izomeri cu aceeași compoziție calitativă și cantitativă, i.e. cu aceeași formulă moleculară.
Există două tipuri de izomerie: structuralȘi spaţială (stereoizomerie). Izomerii structurali diferă între ei în ordinea legăturilor atomilor din moleculă; stereoizomeri - aranjarea atomilor în spațiu cu aceeași ordine de legături între ei.
Se disting următoarele tipuri de izomerie structurală: izomerie ale scheletului carbonic, izomerie pozițională, izomerie a diferitelor clase de compuși organici (izomerie interclasă).
Izomerie structurală
Izomeria scheletului de carbon se datorează ordinii diferite a legăturilor dintre atomii de carbon care formează scheletul moleculei. După cum sa arătat deja, formulă moleculară$С_4Н_(10)$ corespunde a două hidrocarburi: n-butan și izobutan. Pentru hidrocarbura $С_5Н_(12)$ sunt posibili trei izomeri: pentan, izopentan si neopentan:
$CH_3-CH_2-(CH_2)↙(pentan)-CH_2-CH_3$

Pe măsură ce numărul de atomi de carbon dintr-o moleculă crește, numărul de izomeri crește rapid. Pentru hidrocarbură $С_(10)Н_(22)$ există deja 75$, iar pentru hidrocarbură $С_(20)Н_(44)$ - 366.319$.
Izomerie de poziție datorită poziției diferite a legăturii multiple, substituentului, grupării funcționale cu același schelet de carbon al moleculei:
$CH_2=(CH-CH_2)↙(buten-1)-CH_3$ $CH_3-(CH=CH)↙(buten-2)-CH_3$
$(CH_3-CH_2-CH_2-OH)↙(alcool n-propilic(propanol-1))$

Izomeria diferitelor clase de compuși organici (izomerie interclasă) este cauzată de poziții și combinații diferite de atomi în molecule de substanțe care au aceeași formulă moleculară, dar aparțin unor clase diferite. Astfel, formula moleculară $C_6H_(12)$ corespunde hidrocarburilor nesaturate hexen-1 și ciclohexanului de hidrocarbură ciclică:

Izomerii sunt o hidrocarbură înrudită cu alchinele - butină-1 și o hidrocarbură cu două legături duble în lanțul butadienă-1,3:
$CH≡C-(CH_2)↙(butin-1)-CH_2$ $CH_2=(CH-CH)↙(butadien-1,3)=CH_2$
Eterul dietil și alcoolul butilic au aceeași formulă moleculară $C_4H_(10)O$:
$(CH_3CH_2OCH_2CH_3)↙(\text"eter dietilic")$ $(CH_3CH_2CH_2CH_2OH)↙(\text"alcool n-butilic (1-butanol)")$
Izomerii structurali sunt amino acid aceticși nitroetan, corespunzător formulei moleculare $C_2H_5NO_2$:

Izomerii de acest tip conțin diferite grupe funcționale și aparțin unor clase diferite de substanțe. Prin urmare, ele diferă în proprietățile fizice și chimice mult mai mult decât izomerii scheletului de carbon sau izomerii de poziție.
Izomerie spațială
Izomerie spațială se împarte în două tipuri: geometrice și optice. Izomeria geometrică este caracteristică compușilor care conțin duble legături și compuși ciclici. Deoarece rotația liberă a atomilor în jurul unei duble legături sau într-un inel este imposibilă, substituenții pot fi localizați fie pe o parte a planului dublei legături sau a inelului ( cis-poziție), sau pe părți opuse ( transă-poziţie). Denumiri cis-Și transă- de obicei denumită o pereche de substituenți identici:

Izomerii geometrici diferă în proprietăți fizice și chimice.
Izomerie optică apare atunci când molecula este incompatibilă cu imaginea sa din oglindă. Acest lucru este posibil atunci când atomul de carbon din moleculă are patru substituenți diferiți. Acest atom este numit asimetric. Un exemplu de astfel de moleculă este molecula de acid $α$-aminopropionic ($α$-alanină) $CH_3CH(NH_2)COOH$.
Molecula $α$-alanină nu poate coincide cu imaginea în oglindă, indiferent de modul în care se mișcă. Astfel de izomeri spațiali se numesc oglindă, antipozi optici, sau enantiomeri. Toate proprietățile fizice și aproape toate proprietățile chimice ale acestor izomeri sunt identice.
Studiul izomeriei optice este necesar atunci când se iau în considerare multe reacții care apar în organism. Majoritatea acestor reacții apar sub acțiunea enzimelor – catalizatori biologici. Moleculele acestor substanțe trebuie să se potrivească cu moleculele compușilor asupra cărora acționează, ca o cheie a unei încuietori, prin urmare, structura spațială aranjament reciproc zonele de molecule și alți factori spațiali influențează cursul acestor reacții mare importanță. Astfel de reacții se numesc stereoselectiv.
Majoritatea compușilor naturali sunt enantiomeri individuali și ai lor efect biologic diferă puternic de proprietățile antipodilor lor optici obținute în laborator. Această diferență în activitatea biologică este de mare importanță, deoarece stă la baza cea mai importantă proprietate toate organismele vii – metabolism.
Seria omologa este o serie de substanțe dispuse în ordinea crescătoare a relativei lor greutăți moleculare, asemănătoare ca structură și proprietăți chimice, unde fiecare membru diferă de cel precedent prin diferența omologică $CH_2$. De exemplu: $CH_4$ - metan, $C_2H_6$ - etan, $C_3H_8$ - propan, $C_4H_(10)$ - butan etc.
Tipuri de legături în moleculele de substanțe organice. Hibridarea orbitalilor atomici de carbon. Radical. Grup functional.
Tipuri de legături în moleculele de substanțe organice.
În compușii organici, carbonul este întotdeauna tetravalent. În starea excitată, o pereche de electroni $2s^3$ este ruptă în atomul său și unul dintre ei se deplasează la orbitalul p:

Un astfel de atom are patru electroni nepereche și poate participa la formarea a patru legături covalente.
Pe baza formulei electronice date pentru nivelul de valență al unui atom de carbon, ne-am aștepta ca acesta să conțină un $s$-electron (orbital simetric sferic) și trei $p$-electroni având orbitali reciproc perpendiculari ($2р_х, 2р_у, 2p_z). $- orbital). În realitate, toți cei patru electroni de valență ai atomului de carbon complet echivalent iar unghiurile dintre orbitalii lor sunt egale cu $109°28"$. În plus, calculele arată că fiecare dintre cele patru legături chimice ale carbonului dintr-o moleculă de metan ($CH_4$) este $25%$ $s-$ și $75%$ $p $-conexiune, i.e. amestecarea$s-$ și $p-$ stări ale electronilor. Acest fenomen se numește hibridizare,și orbitali mixți - hibrid.
Un atom de carbon în starea $sp^3$-valență are patru orbiti, fiecare dintre care conține câte un electron. În conformitate cu teoria legăturilor covalente, are capacitatea de a forma patru legături covalente cu atomii oricăror elemente monovalente ($CH_4, CHCl_3, CCl_4$) sau cu alți atomi de carbon. Astfel de conexiuni se numesc $σ$-conexiuni. Dacă un atom de carbon are o legătură $C-C$, atunci se numește primar($Н_3С-СН_3$), dacă doi - secundar($Н_3С-СН_2-СН_3$), dacă trei - terţiar ( ), iar dacă patru - cuaternar (
), iar dacă patru - cuaternar ( ).
).
Una dintre trăsăturile caracteristice ale atomilor de carbon este capacitatea lor de a forma legături chimice prin împărțirea doar cu $p$ electroni. Astfel de conexiuni se numesc $π$-conexiuni. Legăturile $π$ în moleculele de compuși organici se formează numai în prezența legăturilor $σ$ între atomi. Astfel, în molecula de etilenă $H_2C=CH_2$ atomii de carbon sunt legați prin $σ-$ și o legătură $π$, în molecula de acetilenă $HC=CH$ - printr-o legătură $σ-$ și două $π$ . Legăturile chimice formate cu participarea legăturilor $π$ se numesc multipli(într-o moleculă de etilenă - dubla, într-o moleculă de acetilenă - triplu), și compuși cu legături multiple - nesaturat.
Fenomen$sp^3$-, $sp^2$- Și$sp$ - hibridizarea atomului de carbon.
Când se formează legături $π$, starea hibridă se schimbă orbitali atomici atom de carbon. Deoarece formarea legăturilor $π$ are loc datorită electronilor p, atunci în moleculele cu o legătură dublă electronii vor avea $sp^2$-hibridare (a existat $sp^3$, dar un electron p merge la $π$- orbital), iar cu unul triplu - $sp$-hibridare (doi p-electroni au mers la $π$-orbital). Natura hibridizării schimbă direcția legăturilor $σ$. Dacă în timpul hibridizării $sp^3$ formează structuri ramificate spațial ($a$), atunci în timpul hibridizării $sp^2$ toți atomii se află în același plan și unghiurile dintre legăturile $σ$ sunt egale cu $120° $(b) , iar cu $sp$-hibridare molecula este liniară (c):

În acest caz, axele $π$-orbitalilor sunt perpendiculare pe axa legăturii $σ$.

Atât legăturile $σ$- cât și $π$-sunt covalente, ceea ce înseamnă că trebuie să fie caracterizate prin lungime, energie, direcție spațială și polaritate.
Caracteristicile legăturilor simple și multiple dintre atomii de C.
Radical. Grup functional.
Una dintre caracteristicile compușilor organici este că în reacțiile chimice moleculele lor nu fac schimb de atomi individuali, ci de grupuri de atomi. Dacă acest grup de atomi este format numai din atomi de carbon și hidrogen, atunci se numește radical de hidrocarbură, dacă are atomi de alte elemente, atunci se numește grup functional. Deci, de exemplu, metil ($СН_3$-) și etil ($С_2Н_5$-) sunt radicali hidrocarburi, iar gruparea hidroxi (-$ОН$), gruparea aldehidă (  ), gruparea nitro (-$NO_2$), etc. sunt grupele funcționale ale alcoolilor, aldehidelor și respectiv compușilor care conțin azot.
), gruparea nitro (-$NO_2$), etc. sunt grupele funcționale ale alcoolilor, aldehidelor și respectiv compușilor care conțin azot.
De obicei, grupul funcțional determină proprietățile chimice ale unui compus organic și, prin urmare, este baza clasificării acestora.
Tema: Principii de bază ale teoriei structurii compușilor organici de A. M. Butlerov.
Teoria structurii chimice a compușilor organici, prezentată de A. M. Butlerov în a doua jumătate a secolului trecut (1861), a fost confirmată de lucrările multor oameni de știință, inclusiv studenții lui Butlerov și el însuși. S-a dovedit a fi posibil pe baza ei să explice multe fenomene care până atunci nu aveau nicio interpretare: omologia, manifestarea tetravalenței de către atomii de carbon din substanțele organice. Teoria și-a îndeplinit și funcția predictivă: pe baza ei, oamenii de știință au prezis existența unor compuși încă necunoscuți, le-au descris proprietățile și le-au descoperit. Deci, în 1862–1864. A. M. Butlerov a examinat alcoolii propilici, butilici și amilici, a determinat numărul de izomeri posibili și a derivat formulele acestor substanțe. Existența lor a fost ulterior dovedită experimental, iar unii dintre izomeri au fost sintetizați de însuși Butlerov.
Pe parcursul secolului al XX-lea. prevederile teoriei structurii chimice compuși chimici au fost dezvoltate pe baza unor noi vederi care s-au răspândit în știință: teoria structurii atomice, teoria legăturilor chimice, idei despre mecanismele reacțiilor chimice. În prezent, această teorie este universală, adică este valabilă nu numai pentru substanțele organice, ci și pentru cele anorganice.
Prima poziție. Atomii din molecule sunt combinați într-o anumită ordine în funcție de valența lor. Carbonul din toți compușii organici și cei anorganici este tetravalent.
Evident, ultima parte a primei poziții a teoriei poate fi ușor explicată prin faptul că în compuși atomii de carbon sunt în stare excitată:
Atomii de carbon tetravalenți se pot combina între ei pentru a forma lanțuri diferite:

Ordinea conexiunii atomilor de carbon din molecule poate fi diferită și depinde de tipul de legătură chimică covalentă dintre atomii de carbon - simplu sau multiplu (dublu și triplu):

Această poziție explică fenomenul.
Substanțele care au aceeași compoziție, dar structuri chimice sau spațiale diferite și, prin urmare, proprietăți diferite, se numesc izomeri.
Principalele tipuri:
Izomerie structurală, în care substanțele diferă în ordinea legăturilor atomilor din molecule: schelet de carbon

![]()
![]()
![]()

![]()
![]()
Poziția a treia. Proprietățile substanțelor depind de influența reciprocă a atomilor din molecule.
De exemplu, în acidul acetic doar unul dintre cei patru atomi de hidrogen reacţionează cu un alcalin. Pe baza acestui fapt, se poate presupune că doar un atom de hidrogen este legat de oxigen:
Pe de altă parte, din formula structurală a acidului acetic putem concluziona că acesta conține un atom mobil de hidrogen, adică este monobazic.Principalele direcții de dezvoltare ale teoriei structurii compușilor chimici și semnificația acesteia.
Pe vremea lui A.M Butlerov, chimia organică a fost utilizată pe scară largă
formule empirice (moleculare) și structurale. Acestea din urmă reflectă ordinea conexiunii atomilor dintr-o moleculă în funcție de valența lor, care este indicată prin liniuțe.
Pentru ușurința înregistrării, se folosesc adesea formule structurale prescurtate, în care liniuțele indică doar legăturile dintre atomii de carbon sau carbonul și oxigenul.
Și fibre, produse din care sunt folosite în tehnologie, viața de zi cu zi, medicină, agricultură. Semnificația teoriei structurii chimice a lui A. M. Butlerov pentru chimia organică poate fi comparată cu semnificația lege periodicăși Tabelul periodic al elementelor chimice al lui D.I. Mendeleev pentru chimia anorganică. Nu degeaba ambele teorii au atât de multe în comun în modurile de formare, direcțiile de dezvoltare și semnificația științifică generală.
Baza pentru crearea teoriei structurii chimice a compușilor organici este A.M. Butlerov a servit stiinta atomo-moleculara(lucrări de A. Avagadro şi S. Cannizzaro). Ar fi greșit să presupunem că înainte de crearea sa, nu se știa nimic în lume despre substanțele organice și nu s-a făcut nicio încercare de fundamentare a structurii compușilor organici. Până în 1861 (anul în care A.M. Butlerov a creat teoria structurii chimice a compușilor organici), numărul compușilor organici cunoscuți a ajuns la sute de mii, iar identificarea chimiei organice ca știință independentă a avut loc încă din 1807 (J. Berzelius).
Condiții preliminare pentru teoria structurii compușilor organici
Un studiu amplu al compușilor organici a început în secolul al XVIII-lea cu lucrările lui A. Lavoisier, care a arătat că substanțele obținute din organismele vii constau din mai multe elemente - carbon, hidrogen, oxigen, azot, sulf și fosfor. De mare valoare a avut introducerea termenilor „radical” și „izomerism”, precum și formarea teoriei radicalilor (L. Guiton de Morveau, A. Lavoisier, J. Liebig, J. Dumas, J. Berzelius), succese în sinteza compușilor organici (uree, anilină, acid acetic, grăsimi, substanțe asemănătoare zahărului etc.).
Termenul „structură chimică”, precum și elementele de bază teoria clasică structura chimică au fost publicate pentru prima dată de A.M. Butlerov la 19 septembrie 1861 în raportul său la Congresul naturaliştilor şi medicilor germani din Speyer.
Principii de bază ale teoriei structurii compușilor organici A.M. Butlerov
1. Atomii care formează o moleculă a unei substanțe organice sunt legați între ei într-o anumită ordine, iar una sau mai multe valențe de la fiecare atom sunt cheltuite pentru legarea între ele. Nu există valențe libere.
Butlerov a numit succesiunea conexiunilor atomilor „structură chimică”. Grafic, conexiunile dintre atomi sunt indicate printr-o linie sau un punct (Fig. 1).
Orez. 1. Structura chimică a moleculei de metan: A – formula structurală, B – formula electronică
2. Proprietățile compușilor organici depind de structura chimică a moleculelor, adică. Proprietățile compușilor organici depind de ordinea conexiunii atomilor din moleculă. După ce ați studiat proprietățile, puteți descrie substanța.
Să luăm un exemplu: o substanță are o formulă brută de C 2 H 6 O. Se știe că atunci când această substanță interacționează cu sodiul, se eliberează hidrogen, iar când acționează asupra ei un acid se formează apă.
C2H6O + Na = C2H5ONa + H2
C2H6O + HCI = C2H5CI + H2O
Această substanță poate avea două formule structurale:
CH3-O-CH3 - acetonă (dimetilcetonă) și CH3-CH2-OH - alcool etilic (etanol),
Pe baza proprietăților chimice caracteristice acestei substanțe, ajungem la concluzia că este vorba despre etanol.
Izomerii sunt substanțe care au aceeași compoziție calitativă și cantitativă, dar structuri chimice diferite. Există mai multe tipuri de izomerie: structurală (liniară, ramificată, schelet de carbon), geometrică (izomerie cis și trans, caracteristică compușilor cu o legătură dublă multiplă (Fig. 2)), optică (oglindă), stereo (spațială, caracteristică substanțelor , capabile să fie situate diferit în spațiu (Fig. 3)).

Orez. 2. Exemplu de izomerie geometrică
3. Proprietățile chimice ale compușilor organici sunt influențate și de alți atomi prezenți în moleculă. Astfel de grupuri de atomi sunt numite grupări funcționale, datorită faptului că prezența lor în molecula unei substanțe îi conferă proprietăți chimice speciale. De exemplu: -OH (grupare hidroxi), -SH (grupare tio), -CO (grupare carbonil), -COOH (grupare carboxil). Mai mult, proprietățile chimice ale unei substanțe organice depind mai puțin de scheletul de hidrocarbură decât de grupul funcțional. Grupele funcționale sunt cele care asigură diversitatea compușilor organici, datorită cărora sunt clasificați (alcooli, aldehide, acizi carboxilici etc. Legăturile carbon-carbon (multiple duble și triple) sunt uneori incluse printre grupele funcționale. Dacă există mai multe grupe funcționale identice, atunci se numește homopolifuncțională (CH 2 (OH)-CH(OH)-CH 2 (OH) - glicerol), dacă mai multe, dar diferite - heteropolifuncționale (NH 2 -CH(R)-COOH - amino acizi).

Fig.3. Exemplu de stereoizomerie: a – ciclohexan, forma „scaun”, b – ciclohexan, forma „cadă”
4. Valența carbonului în compușii organici este întotdeauna de patru.