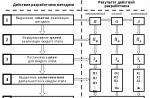
Interacțiunea mai multor substanțe medicamentoase în procesul de distribuție a acestora în organism poate fi considerată drept una dintre etapele farmacocinetice importante care caracterizează biotransformarea lor, ducând în majoritatea cazurilor la formarea de metaboliți.
Metabolism (biotransformare) - procesul de modificare chimică a medicamentelor din organism.
Reacțiile metabolice sunt împărțite în nesintetice (când substanțele medicinale suferă transformări chimice, suferă oxidare, reducere și clivaj hidrolitic sau mai multe dintre aceste transformări) - Faza I a metabolismului și sintetic (reacție de conjugare etc.) - faza II. De obicei, reacțiile nesintetice reprezintă doar etapele inițiale ale biotransformării, iar produsele rezultate pot participa la reacțiile sintetice și apoi pot fi eliminate.
Produsele reacțiilor nesintetice pot avea activitate farmacologică. Dacă activitatea nu este substanța în sine introdusă în organism, ci un anumit metabolit, atunci se numește promedicament.
|
Anumite substanțe medicamentoase, ale căror produse metabolice au o activitate terapeutică importantă |
|
|
Substanță medicinală |
Metabolit activ |
|
Alopurinol |
Alloxantina |
|
Amitriptilină |
Nortriptilină |
|
Acid acetilsalicilic* |
Acid salicilic |
|
Acetohexamida |
Hidroxiexamidă |
|
Glutetimidă |
4-hidroxiglutetimidă |
|
Diazelam |
Desmetildiazepam |
|
Digitoxină |
Digoxină |
|
Imipramină |
Desipramină |
|
Cortizon |
Hidrocortizon |
|
Lidocaina |
Destillidocaină |
|
Metildopa |
Metilnoradrenalină |
|
Prednison * |
Prednison |
|
Propranolol |
4-hidroxiprolanolol |
|
Spironolactonă |
Canrenon |
|
Trimeperidină |
Normperidina |
|
Fenacetină * |
Acetaminofen |
|
Fenilbutazonă |
Oxifenbutazonă |
|
Flurazepam |
Desetilflurazepam |
|
Hidrat de clor * |
Tricloroetanol |
|
Clordiazepoxid |
Desmetilclorodiazepoxid |
|
* promedicamente, efectul terapeutic este exercitat în principal de produsele metabolismului lor. |
|
Reacțiile metabolice nesintetice ale medicamentelor sunt catalizate de sistemele enzimatice microsomale ale reticulului endoplasmatic al ficatului sau ale sistemelor enzimatice non-microsomale. Aceste substanțe includ: amfetamină, warfarină, imipramină, meprobamat, procainamidă, fenacetină, fenitoină, fenobarbital, chinidină.
În reacțiile sintetice (reacții de conjugare), un medicament sau metabolit este un produs al unei reacții nesintetice, care se combină cu un substrat endogen (glucuronic, acizi sulfurici, glicină, glutamină) pentru a forma conjugați. Aceștia, de regulă, nu posedă activitate biologică și, fiind compuși foarte polari, sunt bine filtrați, dar slab reabsorbiți în rinichi, ceea ce contribuie la excreția rapidă a acestora din corp.
Cele mai frecvente reacții de conjugare sunt: acetilare (principala cale metabolică a sulfonamidelor, precum și a hidralazinei, izoniazidului și procainamidei); sulfatare (reacție între substanțe cu grupări fenolice sau alcoolice și sulfat anorganic. Sursa acestuia din urmă poate fi acizii care conțin sulf, cum ar fi cisteina); metilare (unele catecolamine, niacinamida, tiouracilul sunt inactivate). Exemple de diferite tipuri de reacții ale metaboliților medicamentului sunt prezentate în tabel.
|
Tipuri de reacții ale metabolismului medicamentului |
|
|
Tipul de reacție |
Substanță medicinală |
|
I. REACȚII NESINTETICE (catalizate de enzimele reticulului endoplasmatic sau enzimele non-microsomale) |
|
|
Oxidare |
|
|
Hidroxilarea alifatică sau oxidarea lanțului lateral al moleculei |
Tiolental, metohexital, pentazocină |
|
Hidroxilarea aromatică sau hidroxilarea unui inel aromatic |
Amfetamină, lidocaină, acid salicilic, fenacetină, fenilbutazonă, clorpromazină |
|
O-dezalchilare |
Fenacetină, codeină |
|
N-dezalchilarea |
Morfină, codeină, atropină, imipramină, izoprenalină, ketamină, fentanil |
|
S-dezalchilare |
Derivați ai acidului barbituric |
|
N-oxidare |
Aminazină, imipramină, morfină |
|
S-oxidare |
Aminazin |
|
Deaminare |
Fenamina, gisgamina |
|
Desulfurare |
Tibarbiturice, tioridazină |
|
Dehalogenare |
Halotan, metoxifluran, enfluran |
|
Recuperare |
|
|
Recuperarea grupului azo |
Sulfanilamidă |
|
Recuperarea grupului nitro |
Nitrazepam, cloramfenicol |
|
Reducerea acizilor carboxilici |
Prednison |
|
Reducere catalizată de alcool dehidrogenază |
Etanol, hidrat de clor |
|
Hidroliza eterului |
Acid acetilsalicilic, norzpinefrină, cocaină, procainamidă |
|
Hidroliza amidelor |
Lidocaină, pilocarpină, izoniazidă novocainamidă fentanil |
|
II. REACȚII SINTETICE |
|
|
Conjugare cu acid glucuronic |
Acid salicilic, morfină, paracetamol, nalorfină, sulfonamide |
|
Conjugarea sulfatului |
Izoprenalină, morfină, paracetamol, salicilamidă |
|
Conjugarea aminoacizilor: |
|
|
Acid salicilic, acid nicotinic |
|
Acid izonicotinic |
|
Paracetamol |
|
Acetilare |
Novocainamidă, sulfonamide |
|
Metilare |
Noradrenalină, histamină, tiouracil, acid nicotinic |
Transformarea unor substanțe medicamentoase administrate pe cale orală depinde în mod semnificativ de activitatea enzimelor produse de microflora intestinală, unde se hidrolizează glicozide cardiace instabile, ceea ce reduce semnificativ efectul lor cardiac. Enzimele produse de microorganisme rezistente catalizează reacțiile de hidroliză și acetilare, în urma cărora agenții antimicrobieni își pierd activitatea.
Există exemple în care activitatea enzimatică a microflorei contribuie la formarea substanțelor medicamentoase care își arată activitatea. Deci, ftalazolul (ftalilsulfatiazolul) practic nu prezintă activitate antimicrobiană în afara corpului, dar sub influența enzimelor microflorei intestinale, este hidrolizat pentru a forma norsulfazol și acid ftalic, care au un efect antimicrobian. Cu participarea enzimelor mucoasei intestinale, reserpina și acidul acetilsalicilic sunt hidrolizate.
Cu toate acestea, principalul organ în care se efectuează biotransformarea substanțelor medicamentoase este ficatul. După absorbția în intestin, aceștia intră în ficat prin vena portă, unde suferă transformări chimice.
Prin vena hepatică, substanțele medicamentoase și metaboliții acestora intră în circulația sistemică. Combinația acestor procese se numește „primul efect de trecere”, sau eliminarea presistemică, în urma căreia cantitatea și eficacitatea unei substanțe care intră în fluxul sanguin general se pot modifica.
Trebuie avut în vedere faptul că, atunci când medicamentele sunt administrate pe cale orală, biodisponibilitatea lor este individuală pentru fiecare pacient și variază pentru fiecare medicament. Este posibil ca substanțele care suferă transformări metabolice semnificative în timpul primului pasaj în ficat să nu aibă un efect farmacologic, de exemplu, lidocaină, nitroglicerină. În plus, metabolismul primului pas poate fi efectuat nu numai în ficat, ci și în alte organe interne. De exemplu, clorpromazina este mai metabolizată în intestin decât în \u200b\u200bficat.
Cursul eliminării presistemice a unei substanțe este adesea influențat de alte substanțe medicamentoase. De exemplu, clorpromazina reduce „primul efect de trecere” al propranololului, ca urmare, concentrația de β-blocant în sânge crește.
Absorbția și eliminarea presistemică determină biodisponibilitatea și, în mare măsură, eficacitatea substanțelor medicamentoase.
Rolul principal în biotransformarea substanțelor medicinale îl joacă enzimele reticulului endoplasmatic al celulelor hepatice, care sunt adesea numite enzime microsomale. Se cunosc peste 300 de substanțe medicamentoase care pot schimba activitatea enzimelor microsomale... Se numesc substanțe care își cresc activitatea inductori.
Inductorii enzimelor hepatice sunt: \u200b\u200bhipnotice (barbiturice, hidrat de clor), tranchilizante (diazepam, clordiazepoxid, meprobamat), antipsihotice (clorpromazină, trifluoperazină), anticonvulsivante (fenitoină), antiinflamator (fenilbutazonă), unele antibiotice (rifampicină), diuretice (spironolactonă) etc.
Aditivii alimentari, doze mici de alcool, cafea, insecticide clorurate (diclorodifeniltricloretan (DDT), hexacloran) sunt, de asemenea, considerați inductori activi ai sistemelor de enzime hepatice. În doze mici, unele medicamente, precum fenobarbitalul, fenilbutazona, nitrații, își pot stimula propriul metabolism (autoinducție).
Odată cu numirea în comun a două substanțe medicamentoase, dintre care una induce enzime hepatice, iar cea de-a doua este metabolizată în ficat, doza acestora din urmă trebuie crescută, iar atunci când inductorul este anulat, trebuie redus. Un exemplu clasic al acestei interacțiuni este combinația de anticoagulante indirecte și fenobarbital. Studiile speciale au arătat că, în 14% din cazuri, cauza sângerării în timpul tratamentului cu anticoagulante este abolirea medicamentelor care induc enzimele microsomale hepatice.
Antibioticul rifampicină are o activitate inductoare foarte ridicată a enzimelor hepatice microsomale, iar fenitoina și meprobamatul sunt oarecum mai puțin active.
Fenobarbitalul și alți inductori ai enzimelor hepatice nu sunt recomandați în asociere cu paracetamol și alte substanțe medicamentoase, ale căror produse de biotransformare sunt mai toxice decât compușii originali. Uneori se folosesc inductori ai enzimelor hepatice pentru a accelera biotransformarea compușilor (metaboliților) care sunt străini corpului. Astfel, fenobarbitalul, care promovează formarea de glucuronide, poate fi utilizat pentru a trata icterul cu conjugarea afectată a bilirubinei cu acidul glucuronic.
Inducerea enzimelor microsomale trebuie adesea considerată ca un fenomen nedorit, deoarece accelerarea biotransformării medicamentelor duce la formarea de compuși inactivi sau mai puțin activi și la o scădere a efectului terapeutic. De exemplu, rifampicina poate reduce succesul tratamentului cu glucocorticosteroizi, rezultând o doză crescută de medicament hormonal.
Mult mai rar ca rezultat al biotransformării unei substanțe medicamentoase, se formează compuși mai activi. În special, în timpul tratamentului cu furazolidonă, dihidroxietilhidrazina se acumulează în organism timp de 4-5 zile, care blochează monoaminooxidaza (MAO) și aldehidă dehidrogenază, care catalizează oxidarea aldehidelor în acizi. Prin urmare, pacienții care iau furazolidonă nu ar trebui să bea băuturi alcoolice, deoarece concentrația de acetaldehidă din sânge, formată din alcool etilic, poate atinge un astfel de nivel la care se dezvoltă un efect toxic pronunțat al acestui metabolit (sindromul acetaldehidă).
Substanțele medicamentoase care reduc sau blochează complet activitatea enzimelor hepatice se numesc inhibitori.
Medicamentele care inhibă activitatea enzimelor hepatice includ analgezice narcotice, unele antibiotice (actinomicină), antidepresive, cimetidină etc. Ca urmare a utilizării unei combinații de medicamente, dintre care unul inhibă enzimele hepatice, rata metabolică a altui medicament încetinește în jos, concentrația sa crește în sânge și riscul de efecte secundare. Astfel, antagonistul receptorilor H2 de histamină cimetidină, în funcție de doză, inhibă activitatea enzimelor hepatice și încetinește metabolismul anticoagulantelor indirecte, ceea ce crește probabilitatea de sângerare, precum și a β-blocantelor, ceea ce duce la bradicardie severă și hipotensiune arterială . Poate inhibarea metabolismului anticoagulantelor indirecte de către chinidină. Efectele secundare care se dezvoltă odată cu această interacțiune pot fi severe. Cloramfenicolul inhibă schimbul de tolbutamidă, difenilhidantoină și neodocumarină (biscumacetat de etil). Este descrisă dezvoltarea comei hipoglicemiante în timpul terapiei combinate cu cloramfenicol și tolbutamidă. Sunt cunoscute cazuri fatale atunci când pacienților li se prescriu simultan azatioprină sau mercaptopurină și alopurinol, care inhibă xantina oxidaza și încetinește metabolismul medicamentelor imunosupresoare.
Capacitatea unor substanțe de a perturba metabolismul altora este uneori folosită în mod specific în practica medicală. De exemplu, disulfiramul este utilizat în tratamentul alcoolismului. Acest medicament blochează metabolismul alcoolului etilic în stadiul acetaldehidă, a cărui acumulare provoacă disconfort. Metronidazolul și agenții antidiabetici din grupul derivaților sulfonilureici acționează, de asemenea, într-un mod similar.
Un fel de blocaj al activității enzimatice este utilizat pentru otrăvirea cu alcool metilic, a cărui toxicitate este determinată de formaldehida formată în organism sub influența enzimei alcool dehidrogenază. De asemenea, catalizează conversia alcoolului etilic în acetaldehidă, iar afinitatea enzimei pentru alcoolul etilic este mai mare decât pentru alcoolul metilic. Prin urmare, dacă ambii alcooli sunt prezenți în mediu, enzima catalizează în principal biotransformarea etanolului, iar formaldehida, care are o toxicitate semnificativ mai mare decât acetaldehida, se formează într-o cantitate mai mică. Astfel, alcoolul etilic poate fi folosit ca antidot (antidot) pentru otrăvirea alcoolului metilic.
Alcoolul etilic modifică biotransformarea multor substanțe medicamentoase... Utilizarea sa unică blochează inactivarea diferitelor substanțe medicamentoase și le poate spori efectul. În stadiul inițial al alcoolismului, activitatea enzimelor hepatice microsomale poate crește, ceea ce duce la o slăbire a acțiunii substanțelor medicinale datorită accelerării biotransformării acestora. Dimpotrivă, în etapele ulterioare ale alcoolismului, când multe funcții ale ficatului sunt afectate, trebuie avut în vedere faptul că efectul substanțelor medicamentoase, a căror biotransformare în ficat este afectată, poate crește semnificativ.
Interacțiunea substanțelor medicamentoase la nivel metabolic poate fi realizată printr-o schimbare a fluxului sanguin hepatic. Se știe că factorii care limitează metabolismul medicamentelor cu efect pronunțat de eliminare primară (propranolol, verapamil etc.) sunt cantitatea de flux sanguin hepatic și, într-o măsură mult mai mică, activitatea hepatocitelor. În acest sens, orice substanță medicinală care reduce circulația hepatică regională, reduce rata metabolică a acestui grup de medicamente și mărește conținutul acestora în plasma sanguină.
Interacțiunile care reduc concentrația de substanțe medicamentoase includ:
Scăderea absorbției în tractul gastro-intestinal.
Inducerea enzimelor hepatice.
Scăderea absorbției celulare.
I. Scăderea absorbției în tractul gastro-intestinal.
Colestiramina rășină schimbătoare de anioni leagă preparatele de hormoni tiroidieni și glicozide cardiace din tractul gastro-intestinal, prevenind astfel absorbția lor. Poate că acest agent interacționează și cu alte medicamente, deci este recomandabil să treacă cel puțin 2 ore între administrarea colestiraminei și alte medicamente.
Ionii de aluminiu conținuți în antiacizi formează complexe insolubile cu tetracicline, prevenind și absorbția lor.
Ionii de fier bivalenți inhibă, de asemenea, absorbția tetraciclinelor.
Caolinul / pectina în suspensie leagă digoxina, reducând absorbția acesteia de 2 ori. Cu toate acestea, acest efect nu apare dacă se ia caolin / pectină nu mai devreme de 2 ore după digoxină.
Ketoconazolul este o bază slabă care se disociază numai într-un mediu acid. Prin urmare, blocanții H2 (ranitidină, famotidină etc.), care reduc aciditatea conținutului gastric, previn disocierea și absorbția ketoconazolului.
O scădere a acidității conținutului gastric nu afectează absorbția fluconazolului.
Acidul aminosalicilic, administrat pe cale orală, printr-un mecanism neclar, reduce absorbția rifampicinei.
II.Inducerea enzimelor hepatice.
Dacă principala cale de eliminare a medicamentului este metabolismul, atunci accelerarea metabolismului duce la o scădere a concentrației medicamentului în organele țintă. Majoritatea medicamentelor sunt metabolizate în ficat, un organ cu o masă celulară mare, flux sanguin ridicat și conținut de enzime. Prima reacție în metabolismul multor medicamente este catalizată de enzimele microsomale hepatice asociate cu citocromul P450 și conținute în reticulul endoplasmatic. Aceste enzime oxidează moleculele medicamentului prin diferite mecanisme - hidroxilarea inelului aromatic, N-demetilare, O-demetilare și sulfooxidare. Moleculele produselor acestor reacții sunt de obicei mai polare decât moleculele precursorilor lor și, prin urmare, sunt mai ușor de îndepărtat de rinichi.
Expresia unor izoenzime ale citocromului P450 este reglementată, iar conținutul lor în ficat poate crește sub influența anumitor medicamente.
O substanță tipică care induce inducerea enzimelor microsomale hepatice este fenobarbitalul. La fel fac și alte barbiturice. Efectul inductiv al fenobarbitalului se manifestă deja la o doză de 60 mg / zi.
Inducerea enzimelor hepatice microsomale este cauzată și de rifampicină, carbamazepină, fenitoină, glutetimidă; este observat la fumători, atunci când este expus la insecticide care conțin clor, cum ar fi DDT și la utilizarea constantă a alcoolului.
Fenobarbitalul, rifampicina și alți inductori ai enzimelor hepatice microsomale determină o scădere a concentrației serice a multor medicamente, inclusiv warfarină, chinidină, mexiletină, verapamil, ketoconazol, itraconazol, ciclosporină, dexametazonă, metilprednisolonă, prednisolonă, steroizi activi steroizi) și metirapona. Aceste interacțiuni au o mare importanță clinică. Deci, dacă un pacient pe fondul anticoagulanților indirecți atinge nivelul adecvat de coagulabilitate a sângelui, dar în același timp ia un inductor de enzime microsomale hepatice, atunci dacă acesta din urmă este anulat (de exemplu, la externare), concentrația serică a anticoagulantului va crește. Ca urmare, poate să apară sângerări.
Există diferențe individuale semnificative în inducibilitatea enzimelor în metabolismul medicamentelor. La unii pacienți, fenobarbitalul crește brusc acest metabolism, la alții nu are aproape niciun efect.
Fenobarbitalul nu numai că induce inducerea unor izoenzime ale citocromului P450, dar îmbunătățește și fluxul sanguin hepatic, stimulează secreția bilei și transportul anionilor organici în hepatocite.
Unele substanțe medicamentoase pot îmbunătăți, de asemenea, conjugarea altor substanțe cu bilirubina.
III.Diminuarea absorbției celulare.
Derivații de guanidină utilizați pentru tratamentul hipertensiunii arteriale (guanetidină și guanadrel) sunt transferați către neuronii adrenergici datorită transportului activ al aminelor biogene. Rolul fiziologic al acestui transport este recaptarea mediatorilor adrenergici, dar cu ajutorul acestuia, mulți alți compuși similari din punct de vedere structural, inclusiv derivații de guanidină, pot fi transportați și împotriva gradientului de concentrație.
Inhibitorii recaptării noradrenalinei previn absorbția acestor medicamente de către neuronii adrenergici, blocând astfel acțiunea acestora. Antidepresivele triciclice sunt inhibitori puternici ai recaptării norepinefrinei. În acest sens, în timp ce se iau antidepresive triciclice (desipramină, imipramină, protriptilină, nortriptilină și amitriptilină) și guanetidină sau guanadrel, efectul hipotensiv al acestuia din urmă este aproape complet suprimat. Doxepina și clorpromazina într-o măsură mai mică blochează recaptarea norepinefrinei, dar au și un efect antagonist dependent de doză în raport cu derivații de guanidină. Efedrina are același efect. La pacienții cu hipertensiune arterială severă, astfel de interacțiuni medicamentoase pot duce la eșecul tratamentului, criză hipertensivă și accident vascular cerebral.
Efectul antihipertensiv al clonidinei este, de asemenea, parțial inhibat de antidepresivele triciclice. Clonidina acționează asupra centrului cardiovascular al medularei oblongate, provocând o scădere a tonusului simpatic. Aici efectul său este blocat de antidepresivele triciclice.
Vezi si:
INTERACȚIUNI CU DROGURI
Mecanismele de absorbție (absorbție) enumerate „funcționează”, de regulă, în paralel, dar contribuția predominantă este de obicei făcută de unul dintre ele (difuzie pasivă, filtrare, transport activ, pinocitoză). Deci, în cavitatea bucală și în stomac, difuzia pasivă se realizează în principal, într-o măsură mai mică - filtrare. Alte mecanisme nu sunt practic utilizate.
În intestinul subțire nu există obstacole în calea implementării tuturor mecanismelor de absorbție; pe care o domină depinde de drog.
Procesele de difuzie pasivă și filtrare predomină în intestinul gros și rect. Ele sunt, de asemenea, principalele mecanisme de absorbție a medicamentelor prin piele.
Utilizarea oricărui medicament în scopuri terapeutice sau profilactice începe cu introducerea acestuia în corp sau cu aplicarea pe suprafața corpului. Rata de dezvoltare a efectului, severitatea și durata acestuia depind de căile de administrare. Căile de administrare existente sunt de obicei împărțite în ENTERAL (adică prin tractul digestiv: administrare prin gură, sub limbă, în duoden, în rect sau rectal) și PARENTERAL (adică ocolind tractul digestiv: intravenos administrare, intravenoasă arterială, intramusculară, subcutanată, inhalări - aerosoli, gaze, pulberi); administrare intratecală sau subarahnoidiană; în cele din urmă, utilizarea locală a medicamentelor: intrauterină, vaginală, vezicală, intraperitoneală etc.).
Calea de administrare a medicamentului depinde în mare măsură dacă acesta poate ajunge la locul de acțiune (în biofază) (de exemplu, în centrul inflamației) și poate avea un efect terapeutic.
II. DISTRIBUȚIA MEDICAMENTELOR ÎN CORP. BARIERE BIOLOGICE. DEPOZIT
După absorbție, substanțele medicinale pătrund de obicei în fluxul sanguin și apoi sunt transportate către diferite organe și țesuturi. Distribuția unui medicament este determinată de mulți factori, în funcție de care medicamentul va fi distribuit în organism în mod egal sau inegal. Ar trebui spus că majoritatea medicamentelor sunt distribuite inegal și doar o mică parte este distribuită relativ uniform (medicamente pentru inhalare pentru anestezie). Cei mai importanți factori care afectează distribuția medicamentului sunt: \u200b\u200b1) solubilitatea lipidelor,
2) gradul de legare la proteinele plasmatice din sânge, 3) intensitatea fluxului sanguin regional.
Solubilitatea lipidică a unui medicament determină capacitatea acestuia de a pătrunde în barierele biologice. Acestea sunt, în primul rând, peretele capilar și membranele celulare, care sunt principalele structuri ale diferitelor bariere histohematogene, în special, cum ar fi barierele hematoencefalice și placentare. Medicamentele liposolubile neionizate pătrund cu ușurință în membranele celulare și sunt distribuite în toate fluidele corpului. Distribuția medicamentelor care pătrund slab membranele celulare (medicamente ionizate) nu este distribuită atât de uniform.
Permeabilitatea BBB crește odată cu creșterea presiunii osmotice a plasmei sanguine. Diferite boli pot modifica distribuția medicamentelor în organism. Deci, dezvoltarea acidozei poate facilita pătrunderea medicamentelor în țesuturi - acizi slabi, care sunt mai puțin disociați în astfel de condiții.
Uneori distribuția unei substanțe medicamentoase depinde de afinitatea medicamentului pentru anumite țesuturi, ceea ce duce la acumularea lor în anumite organe și țesuturi. Un exemplu este formarea unui depozit de țesuturi în cazul utilizării preparatelor care conțin iod (J) în țesuturile glandei tiroide. Când se utilizează tetracicline, acestea din urmă se pot acumula selectiv în țesutul osos, în special în dinți. În acest caz, dinții, în special la copii, pot căpăta o culoare galbenă.
Această selectivitate de acțiune se datorează afinității tetraciclinelor față de substraturile biologice ale țesutului osos, și anume formarea complexelor de calciu de tetraciclină de tip chelat (hela - gheara cancerului). Aceste fapte sunt importante de reținut, în special pentru medicii pediatri și obstetricieni-ginecologi.
Unele medicamente se pot acumula în cantități mari în interiorul celulelor, formând depozite de celule (acriquine). Acest lucru se întâmplă datorită legării medicamentului la proteinele intracelulare, nucleoproteinele, fosfolipidele.
Unele medicamente pentru anestezie, datorită lipofilicității lor, pot forma depozite de grăsimi, care ar trebui, de asemenea, luate în considerare.
Medicamentele sunt depozitate, de regulă, datorită legăturilor reversibile, care, în principiu, determină durata șederii lor în depozitele de țesuturi. Cu toate acestea, dacă se formează complexe stabile cu proteine \u200b\u200bdin sânge (sulfadimetoxină) sau țesuturi (săruri ale metalelor grele), atunci prezența acestor fonduri în depozit se prelungește semnificativ.
De asemenea, trebuie avut în vedere faptul că, după absorbția în circulația sistemică, cea mai mare parte a substanței medicamentoase din primele minute intră în acele organe și țesuturi care sunt perfuzate cel mai activ de sânge (inimă, ficat, rinichi). Saturația mai lentă a medicamentului în mușchi, mucoase, piele și țesut adipos. Este nevoie de timp de la câteva minute până la câteva ore pentru a obține concentrații terapeutice de medicamente în aceste țesuturi.
Cea mai evidentă influență a stării hemodinamicii asupra distribuției medicamentelor este urmărită în condițiile patologiei. Faptul este că tulburările hemodinamice pot modifica semnificativ cinetica distribuției. Deci, cu șoc hemoragic sau cu insuficiență cardiacă congestivă, perfuzia majorității organelor este redusă. Încălcarea ratei de filtrare glomerulară și a fluxului sanguin hepatic duce la o scădere a clearance-ului renal și, respectiv, hepatic, care va afecta imediat creșterea concentrației medicamentului în plasma sanguină. În consecință, intensitatea și durata medicamentului vor fi crescute. Un exemplu este creșterea duratei acțiunii tiopentalului în șoc.
Multe substanțe medicinale au o puternică afinitate fizică și chimică pentru diferite proteine \u200b\u200bdin plasma sanguină. Cele mai importante în acest sens sunt albumina și, într-o măsură mai mică, alfa-glicoproteina acidă. Un astfel de medicament duce în cele din urmă la faptul că, după absorbție, poate circula în sânge nu numai sub formă liberă, ci și într-o formă asociată cu proteinele. Acesta este așa-numitul depozit EXTRACELULAR (extracelular) al unei substanțe medicinale, tipul său de rezervor din sânge. Fracțiunea medicamentului legat de proteinele plasmatice este un depozit temporar și previne fluctuații accentuate ale concentrației de substanțe nelegate în sânge și fluide corporale. Legarea medicamentelor de proteinele plasmatice limitează concentrația acestora în țesuturi și la locul de acțiune, deoarece numai medicamentul liber (nelegat) poate trece prin membrane. O substanță dintr-un complex cu o proteină este lipsită de activitate specifică. Legarea de proteine \u200b\u200breduce difuzia medicamentului în celulă și, prin urmare, încetinește procesul de metabolism. Legarea de proteine \u200b\u200breduce cantitatea de medicament care poate fi filtrată în glomerulii renali, în urma căreia procesul de excreție (excreție) încetinește, de asemenea.
Este practic sesizabil dacă medicamentul se leagă de proteine \u200b\u200bfoarte activ, adică cu mai mult de 90%. Puterea interacțiunii proteinelor din sânge și a medicamentelor se exprimă prin afinitate sau afinitate. Din această definiție (prevedere) rezultă o concluzie importantă:
Dacă A este un medicament,
iar O este proteină, apoi A + B \u003d AO
După cum se poate observa din această ecuație, părțile libere și legate ale medicamentului se află într-o stare de echilibru dinamic. Deoarece medicamentul este activ numai în stare liberă, este inactiv din cauza proteinelor. O comparație oarecum simplificată poate fi presupusă că, într-o stare liberă, medicamentul acționează asupra receptorilor farmacologici ai țesuturilor ca o cheie a unui blocaj și, în legătură cu o proteină, această cheie nu funcționează.
Gradul de afinitate, adică puterea de legare a medicamentului de proteină depinde de:
1) rata de intrare a substanței medicamentoase în țesuturi. Deoarece activitatea unui medicament este determinată de partea capabilă de difuzie, medicamentele cu un grad ridicat de afinitate, afinitate mare pentru proteine, cum ar fi sulfonamidele cu acțiune îndelungată (afinitate\u003e 90%), acționează lent și sunt conținute în interstițial ( intercelulare) lichid și celule tisulare în concentrații scăzute.
Un alt exemplu este glicozida cardiacă (digitoxina), care se leagă 97% de proteine. După ce a luat acest medicament în interior, acesta începe să acționeze numai după 5-6-7 ore.
2) Durata acțiunii lor depinde de gradul de afinitate al medicamentului cu proteinele plasmatice. Digitoxina, după o singură doză, are un efect farmacologic în 2-3 zile, iar efectul său rezidual se realizează chiar și după câteva săptămâni (14-21 zile). Dacă în insuficiența cardiacă cronică, legarea medicamentelor de proteinele plasmatice scade, atunci în insuficiența pulmonară cronică sau în perioada postoperatorie crește (cu aproximativ 10%). La pacienții cu funcție renală redusă, procentul de legare de proteine \u200b\u200ba medicamentelor acide cu proprietăți acide scade.
3) Gradul de afinitate al unui medicament cu proteinele din sânge afectează diferența efectelor medicamentelor la persoanele cu patologii diferite. De exemplu, atunci când un pacient cu o boală de arsură dezvoltă hipoproteinemie profundă, fracția substanței medicamentoase libere crește, ceea ce într-o astfel de situație necesită o reducere a dozelor terapeutice ale medicamentului. O situație similară se poate dezvolta în timpul postului, când, dacă doza de medicament nu este redusă, se va produce un efect toxic asupra dozei sale obișnuite (în mod similar cu boala de radiații).
4) Utilizarea simultană a medicamentelor care se leagă de aceiași radicali ai moleculelor de proteine \u200b\u200bpoate provoca efectul competiției lor pentru conexiunea lor cu proteinele. Dacă, în acest caz, aceste medicamente au capacitate de legare diferită, adică afinitate diferită, poate apărea o creștere bruscă a concentrației unuia dintre ele, uneori la un nivel periculos. Deci, dacă pacientul primește un anticoagulant indirect (un medicament precum fenilina, neodocumarina), al cărui potențial de coagulare este corectat, atunci cu administrare suplimentară (inflamația articulațiilor) salicilați sau butadionă în plasma sanguină, nivelul liberului medicamentul (anticoagulant) poate crește semnificativ datorită deplasării sale de către salicilat (butadionă) dintr-un complex cu proteine. În consecință, există riscul de sângerare. Acest lucru poate fi prezentat schematic după cum urmează:
A + O \u003d AO + B \u003d BO + A, unde B este butadion.
Aceste date farmacocinetice au devenit cunoscute abia în ultimii ani.
Care este soarta ulterioară a drogurilor în organism? După hrănire și distribuție, medicamentele pot:
1) metabolizat sub influența enzimelor adecvate;
2) se schimbă spontan, transformându-se în alte substanțe fără influența enzimelor;
3) fie poate fi excretat din corp (fie excretat) nemodificat.
Unele substanțe medicamentoase se schimbă spontan (embihin), transformându-se în alte substanțe cu modificări corespunzătoare ale acidității mediului în organism. Astfel, într-un organism viu, substanțele medicinale suferă anumite modificări sau BIOTRANSFORMARE. Biotransformarea (sau transformarea sau metabolismul) este înțeleasă ca un complex de transformări fizico-chimice și biochimice ale substanțelor medicinale care contribuie la conversia lor în componente (metaboliți) mai simple, ionizate, mai polare și, prin urmare, solubile în apă, care sunt mai ușor de îndepărtat din corpul. Cu alte cuvinte, indiferent de structura pe care o posedă xenobioticul, enzima adecvată întâlnită cu ea o transformă într-o stare convenabilă pentru excreția din corp (de regulă, xenobioticul devine mai puțin lipofil) sau într-o stare pentru utilizare ca energie și material plastic (cocarboxilază, nucleinat de sodiu) ... Deși unele substanțe medicamentoase sunt biotransformate, ele formează metaboliți care sunt mai activi decât cei introduși în organism, marea majoritate a medicamentelor sunt inactivate, descompuse, transformate în metaboliți mai simpli, farmacologic mai puțin activi și mai puțin toxici. Biotransformarea medicamentelor administrate are loc în principal în ficat, dar se poate produce în rinichi, peretele intestinal, plămâni, mușchi și alte organe. Procesele de biotransformare sunt complexe și implică de obicei o serie de etape secvențiale, fiecare dintre ele fiind mediată de o anumită enzimă din sânge.
Există două (2) tipuri de reacții de metabolizare a medicamentelor în organism: NESINTETIC și SINTETIC.
1. Reacțiile nesintetice includ OXIDAREA, REDUCEREA și HIDROLIZA. Toate reacțiile metabolice nesintetice, numite și transformarea metabolică a medicamentelor, pot fi, de asemenea, împărțite în 2 grupe, în funcție de localizarea celor două sisteme principale de biotransformare:
a) principalul grup de reacții prin care cele mai multe medicamente sunt biotransformate sunt reacții catalizate de enzime ale reticulului endoplasmatic al hepatocitelor sau reacții MICROSOMALE;
b) reacții catalizate de enzime de altă localizare, reacții NON-MICROSOMALE.
Adică, dacă sistemul de biotransformare microsomală este reprezentat de enzime ale reticulului endoplasmatic al hepatocitelor hepatice, atunci sistemul non-microsomal este reprezentat de enzime de localizare diferită.
Reacțiile microsomale de oxidare sau reducere a medicamentelor sau, mai degrabă, grupurile lor active individuale în structura unei molecule de medicament, apar cu participarea sistemelor monooxigenază, ale căror componente principale sunt citocromul P-450 și nicotina amidadenina dinucleotidă fosforilată redusă (NADPH H ).
Acești citocromi sunt componentele principale ale sistemului enzimei oxidative monooxigenază. În majoritatea cazurilor, activitatea farmacologică a acestor metaboliți devine mai mică decât cea a substanței mamă.
O oxidare suplimentară a substanțelor medicamentoase are loc sub influența altor enzime oxidative, cum ar fi OXIDASE și REDUCTASE, cu participarea obligatorie a NADP și a oxigenului molecular.
Enzimele microsomale catalizează în principal procesele de oxidare a multor medicamente, apoi reacțiile de RESTAURARE și HIDROLIZĂ ale acestor medicamente sunt asociate nu numai cu enzimele microsomale, ci și non-microsomale. Deși enzimele non-microsomale sunt implicate în biotransformarea unui număr mic de medicamente, ele joacă în continuare un rol important în metabolismul lor. Biotransformarea non-microsomală a medicamentelor are loc și în ficat, dar poate apărea în plasma sanguină și în alte țesuturi (stomac, intestine, plămâni). De exemplu, putem cita biotransformarea acetilcolinei în plasma sanguină, efectuată de enzima ESTERASE, în cazul nostru - ACETILCOLINESTERAZA. Conform acestor reacții, un număr de medicamente utilizate în mod obișnuit sunt biotransformate, de exemplu, aspirina și sulfonamidele.
Reacțiile sintetice se bazează pe formarea de esteri asociați de medicamente cu acizi glucuronic, sulfuric, acetic, precum și cu glicină și glutation, care vă ajută să vă creați
compuși copolari, ușor solubili în apă, ușor solubili în lipide, care pătrund slab în țesuturi și, în majoritatea cazurilor, inactivi din punct de vedere farmacologic. În mod natural, acești metaboliți sunt bine excretați din corp. Astfel, reacțiile sintetice duc la formarea, sinteza unui nou metabolit și se efectuează folosind reacții de conjugare, acetilare, metilare etc.
De exemplu, biotransformarea medicamentelor prin reacții sintetice poate avea următoarea ilustrație. În ficatul adulților, antibioticul cloramfenicol este conjugat 90% cu acid glucuronic și doar 10% este excretat în urină nemodificat. Glucuronidele rezultate sunt ușor biotransformate și excretate. În același mod, medicamentele estrogenice și glucocorticoide, alcaloizii din opiu, salicilații, barbituricele și alte medicamente sunt eliminate din organism.
Din punct de vedere al evoluției, calea mai veche a biotransformării este adăugarea de grupări extrem de polare la xenobiotice (conjugare): acid glucuronic, sulfat, glicină, fosfat, acetil și grupări epoxidice, care fac xenobiotice mai solubile în apă. Calea evolutiv mai tânără - calea redox (reacții de oxidare, reducere, hidroliză) este considerată ca faza inițială a biotransformării. Produsele de oxidare sau reducere (faza I) sunt apoi de obicei supuse conjugării (faza II). Astfel, putem spune că reacțiile primei faze a biotransformării medicamentelor sunt de obicei nesintetice, în timp ce reacțiile celei de-a doua faze sunt sintetice.
De regulă, numai după faza II a biotransformării se formează compuși inactivi sau inactivi, prin urmare, reacțiile sintetice pot fi considerate reacții pure de detoxifiere a xenobioticelor, inclusiv medicamente.
Din punct de vedere practic, este important ca, cu ajutorul mai multor mijloace, să fie posibilă influențarea activă a proceselor de transformare microsomală a medicamentelor. Se observă că sub influența medicamentelor se pot dezvolta atât INDUCȚIA (creșterea activității), cât și DEPRESIA enzimelor microgomale. Există mult mai multe substanțe care stimulează biotransformarea prin inducerea sintezei proteinelor hepatice enzimatice decât există substanțe care suprimă această sinteză. Astfel de substanțe inductoare, dintre care peste 200 sunt descrise în prezent, includ fenobarbital, barbiturice, hexobarbital, cofeină, etanol, nicotină, butadionă, antipsihotice, difenhidramină, chinină, cordiamină, multe pesticide care conțin clor și insecticide.
Faza de glucuroniltransonă microsomală este implicată în activarea enzimelor hepatice de către aceste substanțe. În același timp, crește sinteza ARN și a proteinelor microsomale. Este important să ne amintim că inductorii sporesc nu numai metabolismul medicamentelor din ficat, ci și excreția lor în bilă.
Toate aceste substanțe accelerează procesele de metabolism hepatic de 2-4 ori numai prin inducerea sintezei enzimelor microsomale. În același timp, metabolismul nu numai al medicamentelor administrate împreună cu acestea sau pe fondul lor este accelerat, ci și al acestora. Cu toate acestea, există și un grup mare de substanțe (inhibitori) care suprimă și chiar distrug citocromul P-450, adică principala enzimă microsomală. Aceste medicamente includ un grup de anestezice locale, antiaritmice (anaprilin sau inderal, visken, eraldin), precum și cimeticină, cloramfenicol, butadionă, agenți anticolinesterazici, inhibitori MAO. Aceste substanțe prelungesc efectele medicamentelor administrate împreună cu ele. În plus, mulți dintre inhibitori provoacă fenomenul autoinhibiției metabolismului (verapamil, propranolol). Din cele spuse, este necesar să se ia în considerare această posibilitate atunci când se combină medicamente la un pacient. De exemplu, inducerea enzimelor microsomale ale celulelor hepatice de către fenobarbital stă la baza utilizării acestui medicament pentru eliminarea hiperbilirubinemiei la nou-născuții cu boală hemolitică.
Scăderea eficacității medicamentelor atunci când sunt utilizate în mod repetat se numește toleranță. Utilizarea aceluiași fenobarbatal ca o pastilă de dormit duce la dezvoltarea treptată a dependenței, adică la toleranță, care dictează necesitatea creșterii dozei de medicament. Tahifilaxia este un tip special de dependență.
TACHIFILAXIA este o dependență foarte rapidă de dependență, uneori după prima injecție a substanței. Deci, introducerea efedrinei intravenoase în mod repetat cu un interval de 10-20 minute determină o creștere mai mică a tensiunii arteriale decât la prima injecție. O situație similară se observă la instilarea soluțiilor de efedrină în nas.
Substanțele de inducție, activând enzimele microsomale, favorizează excreția crescută a vitaminei D din organism, ca urmare a căreia se poate dezvolta o înmuiere a oaselor și poate apărea o fractură patologică. Acestea sunt toate exemple de interacțiuni medicamentoase.
De asemenea, trebuie amintit faptul că agenții farmacologici pot fi împărțiți în 2 grupe în funcție de rata de inactivare a ficatului: primii sunt oxidați la o rată scăzută, de exemplu, difenină, carbamazenină; acesta din urmă - la viteză medie sau mare, de exemplu, imizină, izadrină, lidocaină, anaprilină.
În plus, metabolismul substanțelor medicinale depinde atât de speciile și genul animalelor, de rasa pacientului, cât și de vârstă, sex, nutriție (vegetarienii au o rată mai mică de biotransformare a medicamentelor, dacă alimentele conțin o mulțime de proteine , metabolismul este îmbunătățit), starea sistemului nervos, calea de administrare, de la utilizarea simultană a altor medicamente.
Mai mult, este important să ne amintim că fiecare persoană are propria sa rată de biotransformare determinată genetic. În acest sens, ne putem referi la exemplul alcoolului, atunci când există o particularitate individuală a activității alcoolului dehidrogenază la un individ. Aceste caracteristici ale activității individuale a enzimelor, în funcție de genotip, sunt studiate de farmacogenetică.
Un exemplu excelent de dependență genetică este inactivarea medicamentului anti-tuberculoză isoniazid (ftivazid) prin acetilare. S-a constatat că rata acestui proces este determinată genetic. Există indivizi care inactivează încet izoniazida. În același timp, concentrația sa în organism scade mai treptat decât la persoanele cu inactivare rapidă a medicamentului. Dintre populația europeană a acetilatorilor lenti, potrivit unor autori, se remarcă 50-58,6%, iar cele rapide - până la 30-41,4%. În același timp, dacă popoarele din Caucaz și suedezi sunt în principal acetilatori rapizi, atunci eschimoșii, dimpotrivă, se referă la acetilatori lent.
Dependența biotransformării individuale este, de asemenea, studiată de știința FARMACOGENETICĂ.
La acetilatorii lent, o anumită doză de medicament produce o concentrație mai mare în sânge și, prin urmare, pot avea mai multe efecte secundare. Într-adevăr, izoniazida dă 20% dintre pacienții cu tuberculoză, acetilatori lenti, complicații sub formă de neuropatie periferică și în acetilatori rapizi - doar în 3% din cazuri.
Bolile hepatice modifică biotransformarea substanțelor medicamentoase din acest organ. Pentru substanțele care se transformă lent în ficat, funcția celulelor hepatice joacă un rol important, al cărui nivel de activitate scade în hepatită, ciroză, reducând inactivarea acestor substanțe. Astfel de caracteristici multifactoriale ale biotransformării medicamentelor fac necesară studierea acestei probleme în fiecare caz specific.
Ultima etapă a interacțiunii medicamentelor cu un organism viu este excreția sau EXCRECȚIA lor.
Medicamentele, cu excepția medicamentelor pentru anestezia inhalatorie, sunt de obicei excretate nu prin structurile în care a avut loc absorbția (absorbția). Principalele căi de excreție sunt rinichii, ficatul, tractul gastro-intestinal, plămânii, pielea, glandele salivare, glandele sudoripare, laptele matern. Din punct de vedere clinic, ne interesează în special rinichii.
Excreția medicamentelor prin rinichi este determinată de trei procese efectuate în nefron:
1) FILTRARE glomerulară pasivă;
2) difuzie pasivă prin tubuli sau REABSORPȚIE;
3) SECRETIA tubulară activă.
După cum puteți vedea, toate procesele fiziologice din nefron sunt caracteristice medicamentelor. Medicamentele neionizate care sunt bine absorbite pot fi filtrate în glomerulii renali, dar din lumenul tubulilor renali, se pot difuza din nou în celulele care acoperă tubulii. Astfel, în urină apare doar o cantitate foarte mică de medicament.
Medicamentele ionizate care sunt slab absorbite sunt excretate aproape complet prin filtrare glomerulară și nu sunt reabsorbite.
Difuzia pasivă este un proces bidirecțional, iar substanțele medicinale se pot difuza prin peretele tubulului în orice direcție, în funcție de concentrația lor și de pH-ul mediului (de exemplu, acriquina, salicilați).
Valoarea pH-ului urinei influențează excreția anumitor acizi și baze slabe. Deci, acizii slabi sunt excretați rapid într-o reacție alcalină a urinei, de exemplu barbiturice și salicilați, iar bazele slabe sunt excretate rapid într-un mediu acid (fenamina). Prin urmare, în otrăvirea acută cu barbiturice, este necesară alcalinizarea urinei, ceea ce se realizează prin administrarea intravenoasă de soluții de bicarbonat de sodiu (sodă), acesta din urmă îmbunătățind excreția de somnifere.
Dacă pH-ul urinei nu corespunde valorii optime pentru excreția medicamentului, efectul acestor medicamente poate fi prelungit.
Cu o reacție alcalină a urinei, reabsorbția tubulară a acizilor slabi este minimă, deoarece cea mai mare parte a acestor substanțe se află într-o stare ionizată într-un mediu alcalin. Situația este similară în ceea ce privește bazele slabe cu reacție urinară acidă. Eliminarea bazelor slabe și a acizilor poate fi accelerată dacă se menține o cantitate mare de urină prin administrarea de manitol și diuretice (diuretice) și, de asemenea, corectată de valoarea pH-ului urinei la valoarea optimă pentru medicamentul dat.
Cu patologia rinichilor, capacitatea lor de a excreta substanțe medicinale scade. Ca urmare, chiar și atunci când se utilizează doze normale de medicamente, nivelul lor în sânge crește și efectul medicamentelor este prelungit. În acest sens, atunci când se prescriu medicamente precum antibiotice aminoglicozidice (streptomicină, gentamicină), anticoagulante cumarinice, pacienții cu funcție renală redusă (insuficiență renală) necesită un regim special de observare.
În concluzia acestei secțiuni, câteva cuvinte despre termenul „ELIMINARE”. În literatură, termenii „eliminare” și „excreție” sunt adesea folosiți interschimbabil. Dar trebuie amintit că ELIMINAREA este un termen mai larg care corespunde sumei tuturor proceselor metabolice (biotransformare) și excretoare, ca urmare a căreia substanța activă dispare din corp.
Consecința excreției sau eliminării insuficiente poate fi acumularea sau cumularea medicamentului în organism, în țesuturile acestuia. Cumularea - (acumulator - depozitare) este o consecință a excreției și eliminării insuficiente și, de regulă, este asociată cu patologia organului de excreție (ficat, tract gastrointestinal etc.) sau cu legarea crescută la proteinele plasmatice, ceea ce reduce cantitate dintr-o substanță care poate fi filtrată în glomeruli.
Există trei (3) modalități principale de combatere a cumulului:
1) reducerea dozei de substanță medicinală;
2) o pauză în prescrierea medicamentelor (2-3-4 zile-2 săptămâni);
3) în prima etapă, introducerea unei doze mari (doză de saturație), iar apoi transferul pacientului la o doză mică, de întreținere. Astfel, de exemplu, sunt utilizate glicozide cardiace (digitoxina).
Preferanskaya Nina Germanovna
Artă. Lector la Departamentul de Farmacologie, Facultatea de Farmacie, Academia de Medicină din Moscova. LOR. Sechenov
Hepatoprotectorii previn distrugerea membranelor celulare, previn deteriorarea celulelor hepatice prin produse de degradare, accelerează procesele reparatorii în celule, stimulează regenerarea hepatocitelor, le restabilește structura și funcțiile. Acestea sunt utilizate pentru tratarea hepatitei acute și cronice, a bolilor hepatice grase, a cirozei hepatice, a afectării hepatice toxice, inclusiv a celor asociate alcoolismului, a intoxicației cu otrăvuri industriale, medicamente, metale grele, ciuperci și alte leziuni hepatice.
Unul dintre principalele mecanisme patogenetice de afectare a hepatocitelor este acumularea excesivă de radicali liberi și produse de peroxidare a lipidelor atunci când sunt expuse la toxine de origine exogenă și endogenă, ducând în cele din urmă la deteriorarea stratului lipidic al membranelor celulare și la distrugerea celulelor hepatice.
Medicamentele utilizate pentru tratarea bolilor hepatice au mecanisme farmacologice diferite de acțiune de protecție. Efectul hepatoprotector al majorității medicamentelor este asociat cu inhibarea peroxidării enzimatice a lipidelor, cu capacitatea lor de a neutraliza diferiți radicali liberi, oferind în același timp un efect antioxidant. Alte medicamente sunt un material de construcție al stratului lipidic al celulelor hepatice, au un efect de stabilizare a membranei și restabilesc structura membranelor hepatocitelor. Altele induc enzime hepatice microsomale, cresc viteza de sinteză și activitate a acestor enzime, sporesc biotransformarea substanțelor, activează procesele metabolice, ceea ce contribuie la eliminarea rapidă a compușilor toxici străini din organism. Al patrulea medicament are un spectru larg de activitate biologică, conține un complex de vitamine și aminoacizi esențiali, mărește rezistența organismului la factorii adverse, reduce efectele toxice, inclusiv după administrarea de alcool etc.
Este foarte dificil să se izoleze medicamentele cu orice mecanism de acțiune, de regulă, aceste medicamente posedând simultan mai multe dintre mecanismele de mai sus. În funcție de origine, acestea sunt împărțite în preparate: origine pe bază de plante, medicamente sintetice, origine animală, suplimente alimentare homeopate și biologic active. Conform compoziției lor, acestea se disting în medicamente monocomponente și combinate (complexe).
Medicamente care inhibă predominant peroxidarea lipidelor
Acestea includ preparate și fitopreparări ale fructelor de ciulin (picant-pestriț). Compușii flavonoizi din plante izolați din fructe și sucul de ciulin de lapte conțin un complex de polihidroxifenolchromanoni izomeri, dintre care principalele sunt silibinina, silidianina, silicristina etc. pentru a trata diverse otrăviri. Efectul hepatoprotector al bioflavonoidelor izolate din fructele de ciulin de lapte se datorează proprietăților sale antioxidante, de stabilizare a membranei și stimulării proceselor reparatorii în celulele hepatice.
Silibinina este principalul bioflavonoid activ din ciulinul de lapte. Are efect hepatoprotector și antitoxic. Interacționează cu membranele hepatocitelor și le stabilizează, prevenind pierderea transaminazelor; leagă radicalii liberi, inhibă procesele de peroxidare a lipidelor, previne distrugerea structurilor celulare, reducând în același timp formarea malondialdehidei și absorbția oxigenului. Previne pătrunderea mai multor substanțe hepatotoxice în celulă (în special, otravă de toadstool pal). Prin stimularea ARN polimerazei, crește biosinteza proteinelor și fosfolipidelor, accelerează regenerarea hepatocitelor deteriorate. În caz de leziuni hepatice alcoolice, aceasta blochează producția de acetaldehidă și leagă radicalii liberi, păstrează rezervele de glutation, care favorizează procesele de detoxifiere în hepatocite.
Silibinin(Silibinin). Sinonime: Silymarin, Silymarin Sediko instant, Silegon, Carsil, Legalon. Disponibil în 0,07 g drajeu, 0,14 g capsule și 450 ml suspensie. Silimarina este un amestec de compuși flavonoizi izomerici (silibinină, silidianină, silicristină) cu un conținut predominant de silibinină. Bioflavonoidele activează sinteza proteinelor și enzimelor din hepatocite, afectează metabolismul hepatocitelor, au un efect stabilizator asupra membranei hepatocitelor, inhibă distrofiile și potențează procesele regenerative în ficat. Silimarina previne acumularea de hidroperoxizi lipidici, reduce gradul de deteriorare a celulelor hepatice. Reduce semnificativ nivelul crescut de transaminaze din serul sanguin, reduce gradul de degenerare grasă a ficatului. Prin stabilizarea membranei celulare a hepatocitelor, aceasta încetinește intrarea produselor metabolice toxice în ele. Silimarina activează metabolismul în celulă, ceea ce duce la normalizarea funcțiilor proteice-sintetice și lipotrope ale ficatului. Indicatorii reactivității imunologice ale organismului sunt îmbunătățiți. Silimarina este practic insolubilă în apă. Datorită proprietăților sale ușor acide, poate forma săruri cu substanțe alcaline. Mai mult de 80% din medicament este excretat în bilă sub formă de glucuronide și sulfați. Ca rezultat al scindării silimarinei eliberate cu bilă de microflora intestinală, până la 40% este reabsorbit din nou, ceea ce creează circulația sa intestin-hepatică.
Silibor - un preparat care conține suma flavonoidelor din fructul ciulinului de lapte (Silibbum marianum L). Forma de eliberare: comprimate acoperite 0,04 g fiecare.
Silimar, un extract uscat purificat obținut din fructele de ciulin (Silybum marianum L), conține flavolignani (silibinină, silidianină etc.), precum și alte substanțe, în principal flavonoide, 100 mg per tabletă. Silymar are o serie de proprietăți care determină efectul său protector asupra ficatului atunci când este expus diferiților agenți dăunători. Prezintă proprietăți antioxidante și radioprotectoare, îmbunătățește detoxifierea și funcțiile exocrine ale ficatului, are un efect antispastic și antiinflamator ușor. În intoxicația acută și cronică cauzată de tetraclorură de carbon, Silymar are un efect hepatoprotector pronunțat: suprimă creșterea enzimelor indicator, inhibă procesele de citoliză și previne dezvoltarea colestazei. La pacienții cu leziuni hepatice difuze, inclusiv geneza alcoolică, medicamentul normalizează parametrii funcționali și morfologici ai sistemului hepatobiliar. Silimar reduce degenerarea grasă a celulelor hepatice și accelerează regenerarea lor datorită activării ARN polimerazei.
Hepatofalk planta este un preparat complex care conține extracte din fructele de ciulin de lapte, celandină și termelik. Efectul farmacologic al unui preparat pe bază de plante este determinat de acțiunea combinată a componentelor sale. Medicamentul are un efect hepatoprotector, antispastic, analgezic, coleretic (coleretic și colekinetic). Stabilizează membranele hepatocitelor, crește sinteza proteinelor în ficat; are un efect antispastic distinct asupra musculaturii netede; are activitate antioxidanta, antiinflamatoare si antibacteriana. Previne pătrunderea mai multor substanțe hepatotoxice în celulă. În caz de afectare hepatică alcoolică, aceasta blochează producția de acetaldehidă și leagă radicalii liberi, păstrează rezervele de glutation, care favorizează procesele de detoxifiere în hepatocite. Alcaloidul chelidonină, conținut în celandină, are un efect antispastic, analgezic și coleretic. Curcumina - ingredientul activ al termelikului javanez are un efect coleretic (atât coleretic, cât și colekinetic) și antiinflamator, reduce saturația bilei cu colesterol, are activitate bactericidă și bacteriostatică împotriva Staphylococcus aureus, Salmonella și micobacterii.
Gepabene conține un extract de ciulin de lapte cu o cantitate standardizată de flavonoide: 50 mg de silimarină și cel puțin 22 mg de silibinină, precum și un extract de fum de farmacie care conține cel puțin 4,13 mg de alcaloizi de fum de farmacie în termeni de protopină. Proprietățile medicinale ale Hepabene sunt determinate de combinația optimă a acțiunii hepatoprotectoare a extractului de ciulin de lapte și de efectul fumului de farmacie care normalizează secreția de bilă și motilitatea tractului biliar. Normalizează atât secreția biliară prea slabă, cât și cea crescută, ameliorează spasmul sfincterului ODDI, normalizează funcția motorie a tractului biliar cu dischinezia lor, atât în \u200b\u200btipurile hiperkinetice, cât și în cele hipokinetice. Restabilește în mod eficient funcția de drenaj a tractului biliar, prevenind dezvoltarea stagnării bilei și formarea calculilor în vezica biliară. Când luați medicamentul, poate apărea un efect laxativ și creșterea cantității de urină. Disponibil în capsule. Administrat oral, în timpul meselor, o capsulă de 3 ori pe zi.
Sibektan, din care o tabletă conține: extract din tansy, pulpă de fruct de ciulin, lapte de sunătoare, mesteacăn 100 mg fiecare. Medicamentul are un efect de stabilizare, regenerare, antioxidant, hepatoprotector și coleretic al membranei. Normalizează metabolismul lipidelor și al pigmentului, îmbunătățește funcția de detoxifiere a ficatului, inhibă procesele de peroxidare a lipidelor în ficat, stimulează regenerarea membranelor mucoase și normalizează motilitatea intestinală. Ia 20-40 de minute. înainte de mese, 2 comprimate de 4 ori pe zi. Cursul este de 20-25 de zile.
Medicamentele care refac în principal structura membranelor hepatocitelor și au un efect de stabilizare a membranei. Deteriorarea hepatocitelor este adesea însoțită de o încălcare a integrității membranelor, ceea ce duce la pătrunderea enzimelor din celula deteriorată în citoplasmă. Odată cu aceasta, conexiunile intercelulare sunt deteriorate, comunicarea dintre celulele individuale este slăbită. Procesele importante pentru organism sunt perturbate - absorbția trigliceridelor necesare formării de chilomicroni și miceli, formarea bilei, scăderea producției de proteine, metabolismul și capacitatea hepatocitelor de a îndeplini o funcție de barieră sunt perturbate. Atunci când se iau medicamente din acest subgrup, regenerarea celulelor hepatice este accelerată, sinteza proteinelor și fosfolipidelor, care sunt materialul plastic al membranelor hepatocitare, este crescută și schimbul de fosfolipide ale membranelor celulare este normalizat. Aceste medicamente prezintă efecte antioxidante deoarece în ficat, interacționează cu radicalii liberi și îi transformă într-o formă inactivă, care previne distrugerea ulterioară a structurilor celulare. Compoziția acestor medicamente include fosfolipide esențiale, care sunt un material plastic pentru celulele hepatice deteriorate, constând din 80% din hepatocite.
Essentiale N și essentiale forte N... Disponibil în capsule care conțin 300 mg de "fosfolipide esențiale", pentru administrare orală la mese. Medicamentul oferă ficatului o doză mare de fosfolipide gata de asimilare, care pătrund în celulele ficatului, pătrund în membranele hepatocitelor și își normalizează funcțiile, inclusiv detoxifierea. Structura celulară a hepatocitelor este restabilită, formarea țesutului conjunctiv în ficat este inhibată, toate acestea contribuind la regenerarea celulelor hepatice. Aportul zilnic al medicamentului promovează activarea sistemelor enzimatice ale ficatului dependente de fosfolipide, reduce nivelul consumului de energie, îmbunătățește metabolismul lipidelor și proteinelor, transformă grăsimile neutre și colesterolul în forme ușor metabolizate, stabilizează proprietățile fizico-chimice ale bilei. În formele acute și severe de afectare hepatică (precoma hepatică și coma, necroza celulelor hepatice și leziunile toxice ale acesteia, în timpul operațiilor în zona hepatobiliară etc.), o soluție pentru administrare lentă intravenoasă în fiole de sticlă închisă de 5 ml conținând 250 mg este utilizate. fosfolipide esențiale ". Introduceți 5-10 ml pe zi, dacă este necesar, creșteți doza la 20 ml / zi. Nu poate fi amestecat cu alte medicamente.
Essliver forte - un preparat combinat conținând fosfolipide esențiale 300 mg și un complex de vitamine: tiamin mononitrat, riboflavină, piridoxină, tocoferol acetat 6 mg fiecare, nicotinamidă 30 mg, cianocobalamină 6 μg, are efect hepatoprotector, hipolipidemic și hipoglicemiant. Reglează permeabilitatea biomembranelor, activitatea enzimelor legate de membrană, asigurând norma fiziologică a proceselor de fosforilare oxidativă în metabolismul celular. Reface membranele hepatocitelor prin regenerare structurală și prin inhibarea competitivă a proceselor de peroxid. Acizii grași nesaturați, fiind încorporați în biomembrană, preiau efecte toxicogene în locul lipidelor membranare ale ficatului și normalizează funcția ficatului, cresc rolul său de detoxifiere.
Fosfogliv - o capsulă conține 0,065 g fosfatidilcolină și 0,038 g sare sare disodică a acidului glicerizic. Medicamentul reface membranele celulare ale hepatocitelor folosind glicerofosfolipide. Molecula de fosfatidilcolină combină glicerol, acizi grași superiori, acid fosforic și colină, toate substanțele necesare pentru construirea membranelor celulare. Molecula de acid glicirizic este similară cu structura hormonilor cortexului suprarenal (de exemplu, cortizon), datorită acestui fapt, are proprietăți antiinflamatorii și antialergice, asigură emulsificarea fosfatidilcolinei în intestin. Acidul glucuronic conținut în structura sa se leagă și inactivează produsele toxice rezultate. Se administrează oral 1-2 capsule de 3 ori pe zi timp de o lună. Doza poate fi crescută la 4 capsule la un moment dat și 12 capsule pe zi.
Livolin Forte - un preparat combinat, a cărui capsulă conține 857,13 mg de lecitină (300 mg de fosfatidilcolină) și un complex de vitamine esențiale: E, B1, B6 - 10 mg fiecare, B2 - 6 mg, B12 - 10 μg și PP - 30 mg. Fosfolipidele incluse în compoziție sunt elementele principale din structura membranei celulare și a mitocondriilor. Atunci când se utilizează medicamentul, metabolismul lipidelor și glucidelor este reglat, starea funcțională a ficatului se îmbunătățește, cea mai importantă funcție de detoxifiere a acestuia este activată, structura hepatocitelor este păstrată și restaurată, formarea țesutului conjunctiv al ficatului este inhibată. Vitaminele primite îndeplinesc funcția coenzimelor în procesele de decarboxilare oxidativă, fosforilarea respiratorie, au efect antioxidant, protejează membranele de efectele fosfolipazelor, previn formarea compușilor peroxidici și inhibă radicalii liberi. Aplicați 1-2 capsule de 2-3 ori pe zi cu mesele, cursul este de 3 luni, dacă este necesar, cursul se repetă.
Medicamente care îmbunătățesc procesele metabolice din organismAcestea oferă detoxifiere celulară, stimulează regenerarea celulară prin creșterea activității enzimelor microsomale hepatice, îmbunătățind microcirculația și nutriția celulară și, de asemenea, îmbunătățesc procesele metabolice din hepatocite.
Un medicament care afectează procesele metabolice, Acid tioctic (acid lipoic, lipamidă, tioctacid). Acțiune farmacologică - hipolipidemică, hepatoprotectoare, hipocolesterolemiantă, hipoglicemiantă. Acidul tioctic este implicat în decarboxilarea oxidativă a acizilor piruvici și a-ceto. Prin natura acțiunii biochimice, este apropiat de vitaminele din grupa B. Participă la reglarea metabolismului lipidelor și glucidelor, stimulează metabolismul colesterolului și îmbunătățește funcția ficatului. Administrat pe cale orală, la o doză inițială de 200 mg (1 comprimat) de 3 ori pe zi, o doză de întreținere de 200-400 mg / zi. Când se utilizează medicamentul, dispepsie, pot apărea reacții alergice: urticarie, șoc anafilactic; hipoglicemie (datorită absorbției îmbunătățite a glucozei). În formele severe de polineuropatie diabetică, se administrează injecție intravenoasă de 300-600 mg sau picurare intravenoasă timp de 2-4 săptămâni. În viitor, vor trece la terapia de susținere cu forme de tablete - 200-400 mg / zi. După administrarea intravenoasă, sunt posibile reacții adverse nedorite - cum ar fi dezvoltarea de convulsii, diplopie, hemoragii punctate în mucoase și piele, disfuncție a trombocitelor; cu o introducere rapidă, senzație de greutate în cap, dificultăți de respirație.
Acidul alfa-lipoic este o coenzimă a decarboxilării oxidative a acidului piruvic și a alfa-cetoacizilor, normalizează metabolismul energetic, al carbohidraților și al lipidelor, reglează metabolismul colesterolului. Îmbunătățește funcția ficatului, reduce efectul dăunător al toxinelor endogene și exogene asupra acesteia. Administrat oral intramuscular și intravenos. Pentru injecția intramusculară, doza administrată într-un singur loc nu trebuie să depășească 2 ml. Injecție intravenoasă prin picurare, după diluarea a 1-2 ml de 250 ml soluție de clorură de sodiu 0,9%. În formele severe de polineuropatie - IV, 12-24 ml zilnic timp de 2-4 săptămâni, apoi treceți la terapia de întreținere în 200-300 mg / zi. Medicamentul este fotosensibil, deci fiolele trebuie scoase din ambalaj doar imediat înainte de utilizare. Soluția perfuzabilă este adecvată pentru administrare peste 6 ore dacă este protejată de lumină.
Espa lipon disponibil în tablete filmate și soluții injectabile. Un comprimat conține 200 mg sau 600 mg, sare de etilendiamină a acidului alfa-lipoic, iar 1 ml din soluția sa conține 300 mg sau 600 mg, fiole, respectiv, 12 ml și 24 ml. Atunci când se utilizează medicamentul, acesta stimulează decarboxilarea oxidativă a acidului piruvic, a-cetoacizilor, reglează metabolismul lipidelor și carbohidraților, îmbunătățește funcția ficatului, protejează împotriva efectelor adverse ale factorilor endo și exo.
Ademetionină (Heptral) este un precursor al compușilor tiol fiziologici implicați în numeroase reacții biochimice. Această substanță endogenă, care se găsește în aproape toate țesuturile și fluidele corpului, este obținută sintetic, are efecte hepatoprotectoare, detoxifiante, regenerante, antioxidante, anti-fibroase și neuroprotectoare. Molecula sa este implicată în majoritatea reacțiilor biologice, incl. ca donator al unei grupări metil în reacții de metilare, în stratul lipidic al membranei celulare (transmetilare); ca precursor al compușilor tiolici endogeni - cisteină, taurină, glutation, coenzima A (transsulfatare); ca precursor al poliaminelor - putrescina, care stimulează regenerarea celulară, proliferarea hepatocitelor, spermidinei, sperminei, care fac parte din structura ribozomilor (aminopropilare). Oferă mecanismul redox de detoxifiere celulară, stimulează detoxifierea acizilor biliari - crește conținutul de acizi biliari conjugați și sulfați în hepatocite. Stimulează sinteza fosfatidilcolinei în ele, crește mobilitatea și polarizarea membranelor hepatocitelor. Heptral este implicat în procesele biochimice ale corpului, stimulând simultan producția de ademetionină endogenă, în principal în ficat și creier. Pătrunzând prin bariera hematoencefalică, prezintă un efect antidepresiv, care se dezvoltă în prima săptămână și se stabilizează în a doua săptămână de tratament. Terapia heptrală este însoțită de dispariția sindromului astenic la 54% dintre pacienți și de o scădere a intensității acestuia la 46% dintre pacienți. Efectele antiastenice, anticolestatice și hepatoprotectoare au persistat timp de 3 luni după întreruperea tratamentului. Disponibil în tablete de 0,4 g pulbere liofilizată. Terapie de întreținere orală 800-1600 mg / zi. între mese, înghițiți fără a mesteca, de preferință dimineața. În terapia intensivă în primele 2-3 săptămâni de tratament, este prescris intravenos 400-800 mg / zi. (foarte încet) sau i / m, pulberea este dizolvată numai într-un solvent special furnizat (soluție de L-lizină). Principalele efecte secundare administrate pe cale orală sunt arsurile la stomac, durerea sau disconfortul în regiunea epigastrică, simptomele dispeptice și reacțiile alergice sunt posibile.
Aspartat de ornitină (granule Hepa-Merz)... Acțiunea farmacologică - detoxifierea, hepatoprotectoarea, contribuie la normalizarea CBS a organismului. Participă la ciclul ornitinei de formare a ureei (formarea ureei din amoniac), folosește grupuri de amoniu în sinteza ureei și reduce concentrația de amoniac în plasma sanguină. Când luați medicamentul, se activează producția de insulină și hormon de creștere. Medicamentul este disponibil în granule pentru prepararea soluțiilor, pentru administrare orală. 1 plic conține 3 g aspartat de ornitină. Administrat oral, de 3-6 g de 3 ori pe zi după mese. Concentrat pentru perfuzie, în fiole de 10 ml, din care 1 ml conține 500 mg aspartat de ornitină. Introduceți / m la 2-6 g / zi. sau în / într-un jet la 2-4 g / zi; frecvența administrării este de 1-2 ori pe zi. Dacă este necesar, picurare intravenoasă: 25-50 g de medicament se diluează în 500-1500 ml soluție izotonică de clorură de sodiu, soluție de glucoză 5% sau apă distilată. Viteza maximă de perfuzie este de 40 picături / min. Durata cursului tratamentului este determinată de dinamica concentrației de amoniac în sânge și de starea pacientului. Cursul tratamentului poate fi repetat la fiecare 2-3 luni.
Hepasol A, un preparat combinat, în 1 litru de soluție conține: 28,9 g de L-arginină, 14,26 g de acid L-malic, 1,33 g de acid L-aspartic, 100 mg de nicotinamidă, 12 mg de riboflavină și 80 mg de piridoxină.
Acțiunea se bazează pe efectul L-argininei și al acidului L-malic asupra proceselor de metabolism și metabolism în organism. L-arginina favorizează conversia amoniacului în uree, leagă ioni toxici de amoniu formați în timpul catabolismului proteinelor în ficat. Acidul L-malic este esențial pentru regenerarea L-argininei în acest proces și ca sursă de energie pentru sinteza ureei. Riboflavina (B2) este convertită în flavină mononucleotidă și flavină adenină dinucleotidă. Ambii metaboliți sunt activi farmacologic și, ca parte a coenzimelor, joacă un rol important în reacțiile redox. Nicotinamida trece în depozit sub forma nucleididei piridinice, care joacă un rol important în procesele oxidative ale corpului. Împreună cu lactoflavina, nicotinamida participă la procesele metabolice intermediare, sub formă de nucleotidă trifosfopiridină - în sinteza proteinelor. Reduce nivelul lipoproteinelor cu densitate foarte scăzută și cu densitate scăzută și, în același timp, crește nivelul lipoproteinelor cu densitate ridicată, prin urmare este utilizat în tratamentul hiperlipidemiei. D-pantenolul, ca coenzima A, fiind baza proceselor metabolice intermediare, este implicat în metabolismul glucidic, gluconeogeneza, catabolismul acizilor grași, în sinteza sterolului, a hormonilor steroizi și a porfirinei. Piridoxina (B6) este o parte integrantă a grupurilor de numeroase enzime și coenzime, joacă un rol semnificativ în metabolismul carbohidraților și grăsimilor, este necesară pentru formarea porfirinei, precum și pentru sinteza Hb și mioglobinei. Terapia este stabilită individual, luând în considerare concentrația inițială de amoniac în sânge și este prescrisă în funcție de dinamica stării pacientului. De obicei, se prescrie picurare intravenoasă de 500 ml soluție la o rată de 40 picături / min. Introducerea medicamentului poate fi repetată la fiecare 12 ore și până la 1,5 litri pe zi.
Arginina se găsește în medicamentele hepatoprotectoare Sargenor și Citrargin.
Citrat de betaină Bofur - conține betaină și citrat (anion acid citric). Betaina este un aminoacid, un derivat al glicinei cu o grupare amino metilată, prezent în ficat și rinichi la om, principalul factor lipotrop. Promovează prevenirea degenerării grase a ficatului și reduce nivelul colesterolului din sânge, crește procesele respiratorii din celula afectată. Citratul este o verigă importantă în ciclul acidului tricarboxilic (ciclul Krebs). Disponibil în granule de 250 g pentru administrare orală.
Flumecinolul (zixorina) și un derivat al acidului barbituric fenobarbital, care are un efect anticonvulsivant și hipnotic, sunt, de asemenea, inductori ai enzimelor hepatice microsomale.
Preparate pentru animaleHepatamina, un complex de proteine \u200b\u200bși nucleoproteine \u200b\u200bizolat din ficatul bovinelor; Sirepar - hidrolizat de extract hepatic; Hepatosan - un preparat obținut din ficatul unui porc.
Preparatele de origine animală conțin un complex de proteine, nucleotide și alte substanțe active izolate din ficatul bovinelor. Normalizează metabolismul în hepatocite, cresc activitatea enzimatică. Au efect lipotrop, favorizează regenerarea țesutului parenchimatic al ficatului și au efect detoxifiant.
Materii prime pe bază de plante pentru a îmbunătăți funcția ficatului și digestia
Liv-52, care conține sucuri și decocturi ale multor plante, are efect hepatotrop, îmbunătățește funcția ficatului, apetitul și trecerea gazelor din intestine.
Dovleac conține ulei gras obținut din semințe de dovleac, care include carotenoizi, tocoferoli, fosfolipide, flavonoide; vitamine: B1, B2, C, P, PP; acizi grași: saturați, nesaturați și polinesaturați - palmitic, stearic, oleic, linoleic, linolenic, arahidonic etc. Medicamentul are efect hepatoprotector, antiaterosclerotic, antiseptic, coleretic. Disponibil în sticle de 100 ml și sticle de picurare din plastic de 20 ml. Aplicați 1 linguriță timp de 30 de minute. înainte de mese de 3-4 ori pe zi, cursul tratamentului este de 1-3 luni.
Bongigar produs în capsule de sirop și gelatină tare, conține un amestec de ingrediente pe bază de plante cu acțiune antiinflamatoare, hepatoprotectoare, stabilizatoare a membranei, detoxifiante și lipotrope. Previne deteriorarea și normalizează funcția ficatului, o protejează de factorii dăunători și de acumularea de produse metabolice toxice. Se administrează oral, după mese, 2 linguri de sirop sau 1-2 capsule de 3 ori pe zi timp de 3 săptămâni.
Remedii homeopate
Gepar compositum - un preparat complex care conține fitocomponenți: Lycopodium și Carduus marianus, preparate suis-organe ale ficatului, pancreasului și vezicii biliare, catalizatori și sulf, susține funcțiile metabolice ale ficatului.
Hepel - acest preparat conține ciulin de lapte, celandină, clubroot, hellebore, fosfor, colocint etc. Medicamentul antihomotoxic are activitate antioxidantă, protejează hepatocitele de deteriorarea radicalilor liberi, precum și efectele antiproliferative și hepatoprotectoare. Disponibil în tablete, utilizate sub limbă, 1 comprimat de 3 ori pe zi.
Medicină homeopatică complexă Galsten Se utilizează în tratamentul complex al bolilor hepatice acute și cronice, al bolilor vezicii biliare (colecistită cronică, sindrom postcolecistectomie) și pancreatitei cronice. Disponibil în sticle de 20 ml. Alocați 1 picătură copiilor sub 1 an, 5 picături la 12 ani, 10 picături adulților. În cazurile acute, este posibil să o luați la fiecare jumătate de oră sau oră până la apariția ameliorării, dar nu mai mult de 8 ori, apoi să o luați de 3 ori pe zi.
Aditivi alimentari activi biologic (BAA)Oatsol - un preparat complex care conține un extract de ovăz de coacere a laptelui în combinație cu ierburi coleretice și ulei de turmeric. Se produce sub formă de picături de 50 ml și tablete de 0,25 g. Aportul zilnic al medicamentului 1 comprimat de 2 ori cu mese timp de o lună îmbunătățește funcțiile de drenaj ale tractului biliar, elimină stagnarea și normalizează compoziția biochimică a bilei, previne formarea calculilor biliari. Suplimentul alimentar curăță delicat ficatul de toxine și produse toxice de origine endogenă și exogenă, îmbunătățește funcția metabolică a ficatului și promovează spălarea cu nisip.
Hepatrin - conține trei componente principale: extract de ciulin de lapte, extract de anghinare și fosfolipide esențiale. Suplimentul alimentar este utilizat în scop profilactic, pentru a proteja celulele hepatice de daune la consumul de droguri, alcool, de efectele adverse ale endo-, exotoxinelor și consumului de alimente excesiv de grase. Disponibil în capsule de 30 de bucăți.
Ulei esențial - ulei de pește de înaltă calitate obținut din somonul din Groenlanda prin metoda de procesare la rece și stabilizat prin oxidare cu vitamina E. O capsulă conține: acizi grași nesaturați (omega-3): 180 mg de acid eiczapentaenoic, 120 mg de acid docosahexaenoic și 1 mg de D-alfa tocoferol. Ca supliment alimentar, adulții ar trebui să ia zilnic 1-3 capsule la mese. Cursul de admitere este de 1 lună.
Formula Hepavit Life conține un complex de vitamine B și vitamine liposolubile A, E, K, un complex fosfolipidic care activează funcțiile hepatice, componente active ale materialelor vegetale cu efecte antioxidante, coleretice, detoxifiante. Disponibil în capsule (tablete), se utilizează 1 capsulă. (masa) de 1-2 ori pe zi.
Pumpkinol - supliment alimentarrealizat pe baza de uleiuri comestibile de origine marină și vegetală - eikonol și dovleac, obținute prin tehnologii casnice utilizând prelucrarea ușoară a materiilor prime. Tikveinolul conține un complex de substanțe biologic active: acizi grași saturați și polinesaturați - eicosapentaenoic, docosahexaenoic, linolenic, linoleic, palmitic, stearic, arahidonic etc., carotenoizi, tocoferoli, fosfolipide, steroli, fosfatide, vitaminele F, D, E, B1 , B2, C, P, PP. Datorită combinației de compuși activi de origine marină și vegetală, ajută la curățarea corpului de depozitele de grăsime și var, îmbunătățește circulația sângelui, mărește elasticitatea vaselor de sânge, întărește mușchiul inimii, previne infarctul miocardic, îmbunătățește vederea, zgomotul în capul dispare și are și acțiune hepatoprotectoare, coleretică, antiulceroasă, antiseptică; inhibă dezvoltarea excesivă a celulelor prostatei; ajută la reducerea proceselor inflamatorii și la accelerarea regenerării țesuturilor în afecțiunile membranei mucoase ale tractului gastrointestinal, mucoasei bucale, ale tractului biliar, ale sistemului genito-urinar și al pielii. Atunci când se iau suplimente alimentare, compoziția bilei se îmbunătățește, starea funcțională perturbată a vezicii biliare este normalizată, riscul bolii biliare și al colecistitei scade. Normalizează funcțiile secretoare și de evacuare motorie ale stomacului și îmbunătățește metabolismul. Când luați o doză terapeutică, este necesar să reduceți conținutul de ulei vegetal în dieta zilnică cu 10 g. În scopuri profilactice, se recomandă utilizarea Tykvainol în cure de 2 g pe zi timp de cel puțin 1 lună, de două ori pe an , în perioadele de toamnă-iarnă și primăvară ale anului. Tykwainol este necesar în special pentru persoanele predispuse la suprasolicitare mentală și fizică, elevii și școlarii pentru a-și spori capacitatea de învățare și toleranța la stres. Într-o doză de 1 g pe zi, Pumpkinol este util pentru prevenirea tuturor persoanelor sănătoase.
Leaver Wright conține extract de ficat 300 mg, bitartrat de colină 80 mg, extract de ciulin de lapte 50 mg, inozitol 20 mg; cisteină 15 mg; vitamina B12 6 mcg. Previne efectul hepatotoxic al acetaldehidei, un produs al metabolismului alcoolului, reface membranele endoplasmatice celulare, formate din fosfogliceride sintetizate pe bază de inozitol și colină, oxidarea lipidelor, îmbunătățește microfonul
Această acțiune a medicamentului la locul aplicării sale + poate duce la un răspuns reflex + poate fi secundară - acesta este un fel de acțiune de resorbție
Acesta este întotdeauna un efect secundar - determinat de doza de substanță + determinată de concentrația substanței
Acțiunea substanței dezvoltându-se după intrarea sa în circulația sistemică numit:
Resorptiv - reflex - etiotrop - local + general
Factori care afectează medicamentul din stomac:
Pepsină - enzime pancreatice + mediu acid - mediu moderat alcalin - enzimă insulinază
Cantitatea de medicament care intră în circulația sistemică este raportul dintre doza prescrisă și greutatea persoanei + volumul estimat de lichid corporal necesar pentru distribuirea uniformă a dozei administrate a medicamentului + raportul dintre doza luată și concentrația substanță din sânge
Volumul de sânge în care medicamentul este dizolvat
Orice acțiune directă + acțiune nedorită în cursul tratamentului - orice reflex
Sinergic - antagonist + idiosincrasie + acțiune alergică
Transportul medicamentului prin membrană din partea inferioară
se realizează concentrarea într-un spațiu cu concentrație mai mare:
Difuzie pasivă - difuzare facilitată - pinocitoză + transport activ
Transport cu cheltuială energetică - fagocitoză + transport cu participarea vectorilor
Semnificația biologică a reacțiilor de biotransformare care implică citocromi P-450:
Oxidează molecula de medicament
Acetilarea unui medicament înseamnă:
Adăugarea de reziduuri de acid acetic cu acetil-CoA - adăugare de acid glucuronic - sinonim pentru oxidare microsomală - la fel ca hidroliza - adăugare de grupări hidroxil + tip de conjugare
Tipul de transformare chimică care are loc în ficat
Neutralizat mai repede de către ficat + mai puțin neutralizat de ficat + au alți indicatori de biodisponibilitate + nu sunt distruși de enzimele gastro-intestinale
Pătrunde cu ușurință în bariera hematoencefalică
La concept« polifarmacie» următorul fenomen este relevant:
Sensibilizare - Toleranță
Rețetă nerezonabilă a unui număr mare de medicamente - retragere - idiosincrasie
Procesele de oxidare microsomală a substanțelor din ficat se caracterizează prin următoarele caracteristici:
Potențial de inducție + Posibilitate de inhibare + Nespecificitate a substratului
Specificitatea chimică strictă a substratului - adăugarea radicalilor metilici - adăugarea reziduurilor de acid acetic
Termen« captivant» corespunde la:
Consolidarea acțiunii medicamentului la administrarea repetată - conceptul de „dependență de droguri” + conceptul de „toleranță”
Slăbirea acțiunii medicamentului cu utilizare repetată - conceptul de „abstinență”
Alegeți opțiunea de răspuns ceea ce corespunde celei mai rapide eliminări a medicamentului de către rinichi:
Substanța este slab filtrată și slab reabsorbită - substanța este bine filtrată și bine reabsorbită
Substanța este bine filtrată și secretată de tubuli, dar nu
reabsorbit - substanța este bine filtrată, bine reabsorbită și secretată de tubuli
Dependența de un medicament poate rezulta din:
Inducerea enzimelor microsomale hepatice - suprimarea citocromelor P-450 - creșterea sensibilității receptorilor
Reducerea sensibilității receptorilor de organe - ținte - reducerea metabolismului acestui medicament
Dacă ce- atunci substanța inhibă sistemul de oxidare microsomală hepatică atunci te poți aștepta:
Reducerea ratei metabolismului medicamentelor + prelungirea efectului medicamentelor + posibila cumulare a substanțelor - scurtarea perioadei de eliminare
Reducerea eficacității medicamentelor
Inducerea enzimelor microsomale hepatice poate:
Necesită o reducere a dozei unor substanțe + necesită o creștere a dozei unor substanțe
Promovează pătrunderea substanțelor prin hemato
bariera encefalica + ajuta la eliminarea substantelor straine din corp
Preveniți îndepărtarea substanțelor străine din organism
Medicamentul intră în sânge ocolind bariera hepatică când se aplică ca:
Capsule + comprimate sub limbă
Injecție intravenoasă - perfuzii în interior + inhalări
Accelerarea excreției medicamentului în urină se realizează atunci când:
Filtrare crescută în glomeruli - reabsorbție tubulară crescută - utilizarea aldosteronului și vasopresinei + activarea secreției tubulare la rinichi
Creșterea legării medicamentului la proteine
Concept« farmacocinetica» include:
Absorbția unei substanțe + distribuția unei substanțe în organism + biotransformarea unei substanțe -interacțiunea cu receptorii -efecte de acțiune -mecanism de acțiune + excreția unei substanțe + timpul de înjumătățire al unei substanțe
Mecanismul efectelor secundare ale substanței
La prescrierea acidului acetilsalicilic împreună cu
acțiunea antiinflamatoare poate provoca ulcere gastrice. Acest efect poate fi descris ca fiind:
Efect simptomatic + efect secundar -carcinogenitate -embriotoxicitate + efect ulcerogen
Concept« bariere histohematogene» include:
Bariera hemato-oftalmica - membrane lizozomale + bariera placentara + bariera hematoencefalica
Eliminarea medicamentului pre-sistem– aceasta este:
Procesul de eliminare a unei substanțe din sânge de către rinichi + eliminarea medicamentului înainte ca acesta să intre în fluxul sanguin general - secreția substanței de către glandele stomacului
Biotransformarea unei substanțe în ficat după absorbția în sânge
Prelungirea efectelor substanțelor medicamentoase se realizează atunci când:
Crearea unui depozit în țesutul adipos - absorbție afectată în intestin + legare crescută de proteinele plasmatice
Creșterea filtrării glomerulare în rinichi - îmbunătățirea biotransformării în ficat
Mediatorii secundari intracelulari în acțiunea medicamentelor pot fi:
Nucleotide ciclice (cAMP, cGMP) - activatori ai canalelor ionice + ioni de calciu - adenilat ciclază
Procesul de transformare metabolică a medicamentelor include:
Oxidare-metilare
Reducere + hidroliză -acetilare
Reacția de conjugare a medicamentului implică:
Oxidare + interacțiune cu acidul glucuronic
Interacțiune cu glutation + acetilare - interacțiune cu acid clorhidric - hidroliză
Concept« afinitate» presupune:
Capacitatea de a forma complexe cu citoreceptorii - un tip de acțiune combinată a medicamentelor + afinitatea unei substanțe pentru un receptor
Capacitatea unei substanțe de a provoca sensibilizarea corpului
Transmițătorilor secundari(« mesageri») raporta:
Nucleotide ciclice (cAMP, cGMP) -adenilat ciclază + diacilglicerol (DAG)
Liganzi ai receptorilor de membrană + calciu ionizat + inozitol 1,4,5-trifosfat (NF3)
La droguri- genericele includ:
Medicamente originale care au apărut pentru prima dată pe piața farmaceutică + medicamente generice
Cele mai scumpe medicamente din acest grup farmacologic sunt medicamente clasificate în funcție de caracteristicile structurii lor chimice
Exemple de factori care pot provoca interacțiuni semnificative din punct de vedere clinic: fumatul de țigări, alcoolismul cronic, administrarea de rifampicină și unele anticonvulsivante (barbiturice, fenitoină, carbamazepină). Rata de dezvoltare și reversibilitatea inducției enzimei depinde de inductor și de rata de sinteză a noilor enzime. Acest proces de adaptare este relativ lent și poate dura de la câteva zile la câteva luni. De asemenea, poate accelera metabolismul inductorului în sine - aceasta este autoinducția.
Două medicamente inductoare sunt utilizate pe scară largă în practica unității de terapie intensivă - rifampicină și fenobarbital. Spre deosebire de fenobarbital, a cărui acțiune ca inductor necesită cel puțin câteva săptămâni, rifampicina acționează rapid ca inductor, iar acțiunea sa poate fi detectată deja după 2-4 zile și atinge maximul după 6-10 zile . Inducerea enzimei indusă de rifampicină poate duce la interacțiuni mai pronunțate cu warfarină, ciclosporină, glucocorticoizi, ketoconazol, teofilină, chinidină, digitoxină și verapamil, ceea ce necesită o monitorizare atentă a pacientului și ajustări frecvente ale dozelor medicamentului țintă. Citocromul poate fi, de asemenea, indus de anticonvulsivante, rifampicină, glucocorticoizi și unele antibiotice macrolide. De asemenea, poate duce la interacțiuni medicamentoase.
INHIBIREA ENZIMELOR MICROSOMALE DE FIEAT
Inhibarea enzimelor din grupul citocrom este cel mai frecvent mecanism responsabil pentru interacțiunile medicamentoase în practica unităților de terapie intensivă. Dacă o substanță inhibă citocromul, atunci schimbă și metabolismul medicamentului - obiectul. Acest efect constă în prelungirea timpului de înjumătățire al medicamentului țintă și, în consecință, în creșterea concentrației acestuia. Unii inhibitori afectează mai multe izoforme enzimatice deodată, de exemplu, antibioticul macrolid eritromicină. Pentru a suprima mai multe izoforme enzimatice simultan, pot fi necesare concentrații mari de inhibitor. Fluconazolul inhibă activitatea citocromului 2-9 la o doză de 100 mg pe zi, dar dacă doza este crescută la 400 mg, atunci activitatea citocromului 3-4 va fi inhibată. Cu cât este mai mare doza de inhibitor, cu atât efectul său apare mai rapid și cu atât este mai pronunțat. Inhibarea se dezvoltă în general mai repede decât inducția, de obicei poate fi înregistrată în 24 de ore de la momentul administrării inhibitorilor. Timpul de dezvoltare a inhibiției maxime a activității enzimatice depinde atât de inhibitor în sine, cât și de medicament - obiect. Deoarece izoformele enzimei diferă în gene, efectul mediului, vârsta unei persoane, bolile existente atunci când sunt expuse aceluiași inhibitor, gradul de inhibare a activității enzimei la diferiți pacienți poate varia. Aproximativ 5% din toți rezidenții SUA au o deficiență genetică a izoformei citocromului 2-6, care este implicată în metabolismul beta-blocantelor, antipsihoticelor și antidepresivelor. La acești pacienți, nu există nicio inhibare a acestei forme a enzimei de către chinidină, care se observă în restul populației. Inhibarea izoformei 3A este frecventă și este cauzată de un număr mare de medicamente utilizate adesea în practica unității de terapie intensivă. Acestea includ: ketoconazol, fluconazol, ciclosporină, ritonavir, diltiazem, nifedipină, nicardipină, fluoxetină, chinidină, verapamil și eritromicină. Aceștia sunt inhibitori rapid reversibili. Calea de administrare a medicamentului afectează rata de dezvoltare și severitatea inhibării activității enzimei. De exemplu, dacă medicamentul este administrat intravenos, interacțiunea se va dezvolta mai repede.
Substanțele foarte polare sau metaboliții solubili în apă ai substanțelor solubile în grăsimi sunt excretați prin rinichi, dar nu trebuie uitat că sunt excretați într-o măsură mai mică de ficat, cu transpirație și lapte matern. Substanțele solubile în apă din sânge pot fi excretate în urină prin filtrare glomerulară pasivă, secreție tubulară activă sau prin blocarea reabsorbției tubulare active sau mai des pasive.
Medicamentele care reduc rata de filtrare glomerulară (GFR) reduc de obicei presiunea de filtrare fie datorită scăderii volumului intravascular, fie scăderii tensiunii arteriale sau tonusului vascular al arterelor renale. O scădere a GFR de către un medicament obiect, cum ar fi furosemidul, poate, la rândul său, să limiteze filtrarea pasivă a unui medicament țintă, cum ar fi aminoglicozidele, ceea ce duce la o creștere a concentrației lor în sânge. În același timp, medicamentele nefrotoxice, cum ar fi aceleași aminoglicozide, pot reduce numărul nefronelor funcționale și pot reduce GFR, ceea ce duce la acumularea altor medicamente în organism, cum ar fi digoxina, care sunt excretate aproape exclusiv de rinichi. Deși aceasta este o interacțiune indirectă, este de o importanță capitală pentru pacienții cu terapie intensivă și poate fi evitată prin selectarea atentă a dozelor.
Mulți acizi organici solubili în apă sunt secretați activ în principal în tubul proximal. Transportul volatil activ de anioni organici și cationi este un sistem unic. Inhibarea acestor sisteme specifice de către medicamente poate duce la acumularea medicamentului țintă. Concurența pentru sistemele de transport cu substanțe endogene (de exemplu, acid uric) și exogene (peniciline, probenecide, antiinflamatoare nesteroidiene, metotrexat, sulfonamide și cefalosporine) poate duce la dezvoltarea unor interacțiuni medicamentoase semnificative clinic. Un exemplu de astfel de interacțiune poate fi urmărit la exemplul de chinidină și digoxină. După cum sa menționat mai devreme, modificările metabolismului digoxinei în organe și țesuturi pot apărea odată cu administrarea simultană a acestor două medicamente. Există o schimbare relativă în volumul de distribuție a medicamentului și, în același timp, interacțiunea de un alt tip - concurența pentru sistemele de transport în rinichi. O scădere a excreției digoxinei de către rinichi și o schimbare simultană a metabolismului medicamentului poate duce la dublarea concentrației medicamentului în sânge. Acest tip de interacțiune medicamentoasă a fost folosit în trecut în scopuri terapeutice. Medicamentul probenecid a fost utilizat pentru a crește concentrația de penicilină în organism. Reabsorbția medicamentelor filtrate și izolate are loc în partea distală a tubului și în conductele colectoare. Acest proces este influențat de modificările concentrației medicamentului, viteza volumetrică de ieșire a urinei și pH-ul urinei în comparație cu cea din ser. Când pH-ul urinei se modifică în partea distală a tubulilor, se schimbă transportul bazelor organice și al acizilor. Aceste substanțe ionizate nu trec direct prin membrana tubulară renală, ceea ce crește rata de excreție a acestora. Un exemplu important și semnificativ clinic de astfel de interacțiuni este utilizarea bicarbonatului de sodiu pentru alcalinizarea urinei și accelerarea eliminării aspirinei sau salicilaților în caz de otrăvire cu aceste substanțe. Deoarece modificările pH-ului într-o relație logaritmică, creșterea acestui indicator cu o unitate duce la o accelerare a excreției renale de zece ori. Efectul uricosuric al probenecidului este asociat cu medicamentul care blochează reabsorbția activă a acidului uric endogen din tubulii renali proximali.
Aspirina inhibă și reabsorbția acidului uric, dar dacă este utilizată împreună cu probenecidul, atunci aspirina elimină efectul uricosuric al acestuia. Interacțiunile indirecte ale medicamentelor pot afecta atât mecanismele de excreție, cât și reabsorbția. Litiu este reabsorbit în rinichi împreună cu sodiu, conform aceluiași mecanism. Cu o scădere a volumului intravascular, de exemplu, cu utilizarea diureticelor tiazidice, reabsorbția de sodiu și litiu în tubii proximali crește compensator, ceea ce în unele situații poate duce la acumularea unor cantități toxice de litiu în organism.
Ce sunt enzimele hepatice, valoarea lor de diagnostic și valorile normale?
Enzimele hepatice, în principal alanina aminotransferaza (ALT) și aspartatul aminotransferaza (AST), oferă o evaluare detaliată a funcționării organului în sănătate și boală.
Enzimele (enzimele hepatice) sunt produse în cantități mari și intră în sânge. Când funcțiile acestui organ sunt întrerupte, unele enzime cresc sau scad în sânge și acest lucru indică o boală.
Enzime - ce sunt?
Procesele metabolice sunt efectuate datorită enzimelor conținute în sistemul hepatobiliar. Enzimele hepatice microsomale în constanță dinamică determină funcționarea normală a acestui organ.
Deci, mitocondriile conțin enzime pentru ficatul metabolismului energetic. Majoritatea enzimelor sunt susceptibile de proteoliză (descompunere), unele enzime sunt excretate în bilă.
Cu ajutorul diagnosticului de laborator, se poate determina una sau alta enzimă hepatică. Analiza enzimelor hepatice se poate face oricând, există teste rapide pentru a determina indicatorii necesari. Astăzi, analiza și evaluarea obiectivă a testelor enzimatice sunt importante pentru practica clinică.
Sunt discutați inductorii enzimatici ai citolizei și inducătorii de leziuni celulare, colestază și afectarea funcției sintetice a organului.
Ce grupuri se disting?
Enzimele hepatice sunt împărțite în mai multe grupuri:
- Secretor (protrombinază, colinesterază). Acestea afectează procesul de coagulare a sângelui, dacă funcțiile sistemului hepatobiliar sunt perturbate, aceste enzime sunt reduse;
- Indicator (AST, ALT, LDG). Se găsesc în interiorul celulelor, atunci când un organ este afectat, sunt spălate din celule și nivelul lor crește în sânge;
- Excretor (fosfatază alcalină). Sunt sintetizate și excretate în bilă. Când fluxul bilei este afectat, această enzimă hepatică crește.
Ce enzime sunt de valoare diagnostic?
Cel mai adesea, pentru diagnosticarea bolilor sistemului hepatobiliar, se utilizează determinarea indicatorilor de AST, ALT, gamma-lutamil transpeptidază (GGT), lactat dehidrogenază (LDH) și fosfatază alcalină (ALP).
Enzima ficatului GGT și LDH poate fi determinată în timpul sarcinii. Enzima hepatică ALP este necesară pentru diferențierea exactă a bolilor sistemului hepatobiliar.
După efectuarea analizei, pacientul va putea merge cu datele la medic, care va evalua funcțiile organului afectat. În timpul sarcinii, este deosebit de important să se facă o analiză biochimică pentru a controla femeia și fătul pentru a identifica patologia în primele linii.
Fiecare laborator are propria sa normă, probabil indicatorii sunt măsurați în U / L, mol / L, μmol / L.
Raportul AST la ALT
Raportul aminotransferazelor este patognomonic pentru bolile sistemului hepatobiliar. Enzima ficatului AST în sine se găsește și în miocard, mușchii scheletici și rinichi. Enzima ficatului ALT se găsește numai în acest organ.
Rata ALT este U / L, rata AST este U / L.
Raportul ALT: AST \u003d 1 (nivelul alaninei aminotransferazei este mai mare sau egal cu aspartatul aminotransferazei) indică hepatită acută. Dacă ALT: AST este mai mare de 2: 1, atunci acest raport indică o boală alcoolică. Un raport AST: ALT peste 1 (AST depășește ALT) indică ciroză.
O creștere a activității AST și ALT apare cu necroza hepatocitelor de orice etiologie, icter obstructiv, degenerare grasă. Activitatea scăzută este caracteristică necrozei extinse, cirozei.
În plus, aceste enzime hepatice joacă un rol important în determinarea hepatotoxicității medicamentelor. Deci, AST și ALT cresc în timpul utilizării prelungite a anticoagulanților, barbituricelor, contraceptivelor hormonale, medicamentelor antiepileptice, acidului ascorbic, codeinei, morfinei, eritromicinei, gentamicinei, lincomicinei. Se observă o scădere a activității în timpul sarcinii.
Am citit recent un articol care vorbește despre Leviron Duo pentru tratamentul bolilor hepatice. Cu acest sirop, puteți pentru totdeauna să vindecați ficatul acasă.
Nu eram obișnuit să am încredere în nicio informație, dar am decis să verific și să comand ambalajul. Am observat schimbările după o săptămână: durerile constante, greutatea și senzațiile de furnicături din ficat care m-au chinuit înainte - s-au retras, iar după 2 săptămâni au dispărut cu totul. Starea de spirit s-a îmbunătățit, dorința de a trăi și de a te bucura de viață a apărut din nou! Încercați și voi și, dacă cineva este interesat, atunci mai jos este linkul către articol.
Ce alte teste ale funcției hepatice există?
În plus față de principalele AST și ALT, se determină nivelul GGT, ALP, LDH.
Rata GGT - până la 40 U / l. GGT se găsește în cantități mari, pe lângă organul principal, în rinichi, pancreas și pereții căilor biliare. Determinarea GGT este un test deosebit de sensibil la sarcină și la copii. O creștere a activității GGT se observă în hepatită, ciroză, tumori, în colestază, intoxicație cu alcool, icter obstructiv, colangită.
Dinamica ALT, AST, GGT, ALP în funcție de vârstă
Scăderea activității GGT - cu ciroză decompensată. GGT este un indicator extrem de sensibil, mai ales în cazul efectelor toxice. Dacă analiza se face și nivelurile de aminotransferaze sunt normale, atunci indicatorii GGT vor crește.
O creștere a indicatorului are loc cu colestază, icter obstructiv, ciroză biliară, hepatită. Creșterea în timpul sarcinii (în al treilea trimestru), cu utilizarea medicamentelor hepatotoxice. Dacă se face o analiză și nivelul fosfatazei alcaline este scăzut, atunci acest lucru indică utilizarea glucocorticosteroizilor.
Norma lactatului dehidrogenază este de până la 250 U / l. Există mai multe LDH, deci LDH 1-2 este în miocard și eritrocite, LDH 5 - în ficat, LDH 4-5 în mușchii scheletici. În caz de disfuncție a sistemului hepatobiliar, se face o analiză pentru LDH 5. Se observă o creștere a activității în hepatita acută, icter obstructiv, tumori. Există, de asemenea, o creștere a activității în timpul sarcinii, exerciții masive.
Ieșire
Cele mai indicative în boala zonei hepatobiliare sunt aminotransferazele, dar în analiza biochimică este de asemenea important să se determine fosfataza alcalină, lactatul dehidrogenază, gama-glutamil transpeptidaza.
Modificările indicatorilor trebuie monitorizate în timpul sarcinii. Norma în acest caz va indica un rezultat crescut, deoarece unii indicatori sunt în scădere. În timpul sarcinii, o femeie trebuie examinată de mai multe ori pe trimestru.
Pentru a recunoaște o patologie, trebuie să știți care este norma unei enzime sau a alteia. Aceasta are o mare valoare de diagnostic.
Biotransformarea substanțelor medicamentoase. Reacțiile etapelor I și II ale metabolismului. Inductori și inhibitori ai enzimei microsomali (exemple)
Biotransformare (metabolism) - o modificare a structurii chimice a substanțelor medicinale și a proprietăților lor fizico-chimice sub acțiunea enzimelor corpului. Accentul principal al acestui proces este transformarea substanțelor lipofile, care sunt ușor reabsorbite în tubulii renali, în compuși polari hidrofili, care sunt excretați rapid de rinichi (nu sunt reabsorbiți în tubii renali). În procesul de biotransformare, de regulă, există o scădere a activității (toxicității) substanțelor de pornire.
Biotransformarea medicamentelor lipofile are loc în principal sub influența enzimelor hepatice localizate în membrana reticulului endoplasmatic al hepatocitelor. Aceste enzime sunt numite microsomale deoarece
se dovedesc a fi asociate cu mici fragmente subcelulare ale reticulului endoplasmatic neted (microzomi), care se formează în timpul omogenizării țesutului hepatic sau al țesuturilor altor organe și pot fi izolate prin centrifugare (depuse în așa-numita fracție „microsomală” ).
În plasma sanguină, precum și în ficat, intestine, plămâni, piele, mucoase și alte țesuturi, există enzime non-microsomale localizate în citosol sau mitocondrii. Aceste enzime pot participa la metabolismul substanțelor hidrofile.
Există două tipuri principale de metabolism al substanțelor medicamentoase (etape):
Reacții nesintetice (transformare metabolică);
Reacții sintetice (conjugare).
biotransformarea (reacțiile metabolice ale primei faze), are loc sub acțiunea enzimelor - oxidare, reducere, hidroliză.
conjugare (reacții metabolice de fază 2), în care reziduurile altor molecule (glucuronic, acizi sulfurici, radicali alchil) sunt adăugate la molecula substanței, cu formarea unui complex inactiv care este ușor excretat din organism cu urină sau fecale.
Substanțele medicamentoase pot suferi fie biotransformare metabolică (în acest caz, se formează substanțe numite metaboliți), fie conjugare (se formează conjugate). Dar majoritatea LB-urilor sunt metabolizate mai întâi cu participarea unor reacții nesintetice cu formarea de metaboliți reactivi, care apoi intră în reacții de conjugare.
Transformarea metabolică include următoarele reacții: oxidare, reducere, hidroliză. Mulți compuși lipofili suferă oxidare în ficat sub influența sistemului microsomal al enzimelor cunoscute sub numele de oxidaze cu funcție mixtă sau monooxigenaze. Principalele componente ale acestui sistem sunt citocromul P450 reductază și citocromul P450 hemoproteină, care leagă moleculele medicamentului și oxigenul din centrul său activ. Această reacție are loc cu participarea NADPH. Ca rezultat, un atom de oxigen se atașează la substrat (medicament) cu formarea unei grupări hidroxil (reacție de hidroxilare).
Sub influența anumitor medicamente (fenobarbital, rifampicină, carbamazepină, griseofulvină), poate apărea inducerea (creșterea ratei de sinteză) a enzimelor hepatice microsomale. Ca urmare, odată cu administrarea simultană a altor medicamente (de exemplu, glucocorticoizi, contraceptive orale) cu inductori ai enzimelor microsomale, rata metabolică a acestora din urmă crește și efectul lor scade. În unele cazuri, rata metabolică a inductorului în sine poate crește, ca urmare a cărei efecte farmacologice (carbamazepină) scad.
Unele medicamente (cimetidină, cloramfenicol, ketoconazol, etanol) reduc activitatea (inhibitori) a enzimelor metabolizante. De exemplu, cimetidina este un inhibitor al oxidării microsomale și, prin încetinirea metabolismului warfarinei, poate crește efectul său anticoagulant și poate provoca sângerări. Substanțele cunoscute (furanocumarine) conținute în sucul de grapefruit, care inhibă metabolismul medicamentelor precum ciclosporina, midazolamul, alprazolamul și, prin urmare, le sporesc efectul. Odată cu utilizarea simultană a substanțelor medicamentoase cu inductori sau inhibitori ai metabolismului, este necesară ajustarea dozelor prescrise ale acestor substanțe.
12. Modalități de excreție a medicamentelor din organism, sens, conceptul cotei de eliminare, timpul de înjumătățire (T 1/2) și clearance-ul plasmatic total. Dependența acțiunii medicamentelor de calea excreției, exemple.
Excreția substanței medicamentoase nemodificate sau a metaboliților săi este efectuată de toate organele excretoare (rinichi, intestine, plămâni, mamare, salivare, glande sudoripare etc.).
Principalul organ pentru îndepărtarea medicamentelor din organism este rinichii. Excreția medicamentelor prin rinichi are loc prin filtrare și folosind transportul activ sau pasiv. Substanțele liposolubile sunt ușor filtrate în glomeruli, dar în tubuli sunt absorbite pasiv din nou. Medicamentele slab solubile în lipoizi sunt excretate mai repede în urină, deoarece sunt slab reabsorbite în tubii renali. Reacția acidă a urinei promovează eliminarea compușilor alcalini și îngreunează excreția celor acizi. Prin urmare, pentru intoxicația cu medicamente acide (de exemplu, barbiturice), se utilizează bicarbonat de sodiu sau alți compuși alcalini, iar pentru intoxicația cu alcaloizi alcalini, se utilizează clorură de amoniu. De asemenea, este posibilă accelerarea eliminării medicamentelor din organism prin prescrierea unor diuretice puternice, de exemplu, diuretice osmotice sau furosemid, pe fondul introducerii unei cantități mari de lichid în organism (diureză forțată). Excreția bazelor și acizilor din organism are loc prin transport activ. Acest proces are loc cu cheltuirea energiei și cu ajutorul anumitor sisteme purtătoare de enzime. Prin crearea de concurență pentru purtătorul cu orice substanță, este posibil să se încetinească excreția medicamentului (de exemplu, etamida și penicilina sunt secretate utilizând aceleași sisteme enzimatice, prin urmare etamida încetinește excreția penicilinei).
Medicamentele care sunt slab absorbite din tractul gastro-intestinal sunt excretate de intestine și sunt utilizate pentru gastrită, enterită și colită (de exemplu, astringenți, unele antibiotice utilizate pentru infecții intestinale). În plus, medicamentele și metaboliții lor din celulele ficatului intră în bilă și intră în intestin cu ea, de unde sunt fie reabsorbite, livrate în ficat, apoi cu bilă în intestin (circulație intestin-hepatică), fie sunt excretate din corpul cu fecale. Secreția directă a unui număr de medicamente și a metaboliților acestora de către peretele intestinal nu este exclusă.
Substanțele și gazele volatile (eter, oxid de azot, camfor etc.) sunt excretate prin plămâni. Pentru a accelera eliberarea lor, este necesar să creșteți volumul de ventilație pulmonară.
Multe medicamente pot fi excretate în lapte, în special bazele slabe și non-electroliții, care ar trebui luate în considerare atunci când se tratează mamele care alăptează.
Unele substanțe medicamentoase sunt parțial excretate de glandele mucoasei bucale, exercitând un efect local (de exemplu, iritant) asupra căilor de excreție. Deci, metalele grele (mercur, plumb, fier, bismut), eliberate de glandele salivare, provoacă iritarea mucoasei bucale, apar stomatite și gingivite. În plus, acestea determină apariția unei margini întunecate de-a lungul marginii gingivale, în special în zona dinților carioși, care se datorează interacțiunii metalelor grele cu hidrogenul sulfurat în cavitatea bucală și formării de sulfuri practic insolubile. Această „graniță” este un semn de diagnostic al otrăvirii cronice cu metale grele.
Cu utilizarea pe termen lung a difeninei și valproatului de sodiu (anticonvulsivante), iritarea mucoasei gingivale poate provoca gingivită hipertrofică („difenină gingivită”). Nivelul de eliminare a oricărui medicament este evaluat folosind două teste principale:
- în primul rând, se determină timpul în care este eliminată jumătate din doza administrată de medicamentul chimioterapic, adică se găsește timpul de înjumătățire al acestuia din urmă (T 1/2);
- în al doilea rând, se calculează procentul acelei părți dintr-o singură doză de medicament care este eliminată în timpul zilei (coeficient sau cotă, eliminare).
Aceste două criterii pentru eliminarea oricărui medicament nu sunt stabile, deoarece depind de un set de condiții. Dintre acestea din urmă, un rol semnificativ este atribuit proprietăților medicamentului în sine și stării corpului. Acestea depind de rata metabolismului medicamentului în țesuturile și fluidele corpului, intensitatea excreției acestuia, starea funcțională a ficatului și rinichilor, calea de administrare a medicamentului chimioterapic, durata și condițiile de depozitare, lipoidul. solubilitate, structură chimică etc.
Eliminarea medicamentelor ionizate solubile în grăsimi asociate cu proteinele se efectuează mai lent ”decât preparatele ionizabile solubile în apă, ionizate, care nu sunt asociate cu proteinele. Odată cu introducerea unor doze mari de medicamente, eliminarea lor se prelungește, ceea ce se datorează intensificării tuturor proceselor implicate în transportul, distribuția, metabolismul și eliberarea medicamentelor pentru chimioterapie.
Eliminarea majorității medicamentelor la copii este semnificativ mai mică decât la adulți. Este încetinit în special la copiii prematuri în primele luni de viață. Enzimopatiile congenitale și dobândite (deficit de glucoză-6-fosfat dehidrogenază, N-acetiltransferază etc.), boli hepatice și renale, care apar cu insuficiența funcțiilor lor, prelungesc brusc eliminarea.
Rata eliminării este influențată și de alți factori: sexul pacientului, temperatura corpului, bioritmurile fiziologice, șederea copilului în pat etc. Datele privind timpul de înjumătățire al medicamentelor permit medicului să prescrie mai rezonabil o doză unică și zilnică de un anumit medicament, frecvența administrării acestuia ...
Oxidarea microsomală crește reactivitatea moleculelor
Oxidarea microsomală este o secvență de reacții care implică oxigenaze și NADPH, ducând la încorporarea unui atom de oxigen în compoziția unei molecule nepolare și la apariția hidrofilicității în ea și crește reactivitatea acesteia ..
Reacțiile de oxidare microsomală sunt efectuate de mai multe enzime situate pe membranele reticulului endoplasmatic (în cazul in vitro se numesc membrane microsomale). Enzimele organizează un lanț scurt care se termină în citocromul P 450. Citocromul P 450 interacționează cu oxigenul molecular și include un atom de oxigen în molecula substratului, contribuind la apariția (îmbunătățirea) hidrofilității sale, iar celălalt în molecula de apă.
Reacțiile de oxidare microsomală se referă la reacțiile de fază 1 și sunt destinate să confere proprietăți polare unei molecule hidrofobe și / sau să crească hidrofilitatea acesteia, să sporească reactivitatea moleculelor pentru a participa la reacțiile de fază 2. În reacțiile de oxidare, are loc formarea sau eliberarea grupărilor hidroxil, carboxil, tiol și amino, care sunt hidrofile.
Enzimele oxidării microsomale sunt situate în reticulul endoplasmatic neted și sunt oxidaze cu funcție mixtă (monooxigenaze).
Principala proteină a acestui proces este hemoproteina - citocromul P 450. În natură, există până la 150 de izoforme ale acestei proteine, care oxidează aproximativ 3000 de substraturi diferite. Raportul diferitelor izoforme ale citocromului P 450 diferă din cauza caracteristicilor genetice. Se crede că unele izoforme sunt implicate în biotransformarea xenobioticelor, în timp ce altele metabolizează compușii endogeni (hormoni steroizi, prostaglandine, acizi grași etc.).
Principalele reacții efectuate de citocromul P 450 sunt:
- dezalchilarea oxidativă, însoțită de oxidarea grupării alchil (la atomii de N, O sau S) la aldehidă și eliminarea acesteia,
- oxidarea (hidroxilarea) compușilor nepolari cu inele alifatice sau aromatice,
- oxidarea alcoolilor la aldehidele corespunzătoare.
Activitatea citocromului P 450 este asigurată de două enzime:
Diagrama relației enzimelor de oxidare microsomală și funcția acestora
Ambele oxidoreductaze primesc electroni din echivalenții reduși corespunzători și îi transferă în citocromul P 450. Această proteină, după ce a atașat anterior o moleculă de substrat redusă, se leagă de o moleculă de oxigen. După ce a primit încă un electron, citocromul P 450 efectuează încorporarea primului atom de oxigen în substratul hidrofob (oxidarea substratului). În același timp, are loc reducerea celui de-al doilea atom de oxigen la apă.
Secvența reacțiilor de hidroxilare a substratului cu participarea citocromului P 450
O caracteristică esențială a oxidării microsomale este capacitatea de a induce sau inhiba, adică pentru a schimba puterea procesului.
Inductorii sunt substanțe care activează sinteza citocromului P 450 și transcrierea ARNm corespunzător. Sunt
1. Spectru larg de acțiune, care au capacitatea de a stimula sinteza citocromului P450 și a NADPH-citocromului P-450-oxidoreductaza, glucuronil transferaza. Reprezentantul clasic este derivații acidului barbituric - barbiturice; acesta include și diazepam, carbamazepină, rifampicină etc.
2. Un spectru îngust de acțiune, adică stimulează una dintre formele citocromului P450 - hidrocarburi policiclice aromatice (metilcolantren, spironolactonă și multe altele)
Inhibitorii de oxidare microsomală se leagă de partea proteică a citocromului sau de fierul hemului. Acestea sunt împărțite în:
- acțiune directă - monoxid de carbon (CO), antioxidanți,
- acțiune indirectă, adică influență prin produse intermediare ale metabolismului lor, care formează complexe cu citocromul P-450 - eritromicină.
Evaluarea reacțiilor de fază 1
Evaluarea oxidării microsomale poate fi efectuată în următoarele moduri:
- determinarea activității enzimelor microsomale după biopsie,
- farmacocinetica medicamentelor,
- folosind markeri metabolici (testul antipirinei).
Enzimele microsomale sunt
Hepatolog → Despre ficat → Modificări ale enzimelor hepatice în diferite patologii, valoarea lor de diagnostic
Un grup de substanțe proteice care măresc activitatea diferitelor procese metabolice se numesc enzime.
Evoluția cu succes a reacțiilor biologice necesită condiții speciale - o temperatură ridicată, o anumită presiune sau prezența anumitor metale.
Enzimele ajută la accelerarea reacțiilor chimice fără aceste condiții.
Ce sunt enzimele hepatice
Pe baza funcției lor, enzimele sunt situate în interiorul celulei, pe membrana celulară, fac parte din diferite structuri celulare și participă la reacțiile din interiorul acesteia. În funcție de funcția îndeplinită, se disting următoarele grupuri:
hidrolaze - descompun moleculele substanțelor; sintetaze - participă la sinteza moleculară; transferaze - transportă părți ale moleculelor; oxidoreductaze - afectează reacțiile redox din celulă; izomerasele - schimbă configurația moleculelor; liasele - formează legături moleculare suplimentare.
Multe enzime necesită co-factori suplimentari pentru a funcționa. Toate vitaminele și microelementele își joacă rolul.
Ce sunt enzimele hepatice
Fiecare organet celular are propriul său set de substanțe care îi determină funcția în viața celulei. Enzimele metabolismului energetic sunt localizate pe mitocondrii, reticulul endoplasmatic granular este legat de sinteza proteinelor, reticulul neted este implicat în metabolismul lipidelor, glucidelor, lizozomii conțin enzime de hidroliză.
Enzimele care pot fi detectate în plasma sanguină sunt împărțite în mod convențional în trei grupe:
Secretor. Sunt sintetizate în ficat și eliberate în sânge. Un exemplu este enzimele de coagulare a sângelui, colinesteraza. Indicator sau celular (LDH, glutamat dehidrogenază, fosfatază acidă, ALT, AST). În mod normal, numai urme ale acestora se găsesc în ser. localizarea lor este intracelulară. Deteriorarea țesuturilor determină eliberarea acestor enzime în sânge, prin numărul lor unul poate judeca adâncimea leziunii. Enzimele excretoare sunt sintetizate și excretate împreună cu bilă (fosfatază alcalină). Încălcarea acestor procese duce la creșterea parametrilor lor în sânge.
Ce enzime sunt utilizate în diagnosticare
Procesele patologice sunt însoțite de apariția sindroamelor de colestază și citoliză. Fiecare dintre ele se caracterizează prin propriile modificări ale parametrilor biochimici ai enzimelor serice.
Sindromul colestatic este o tulburare a secreției biliare. Acesta este determinat de schimbarea activității următorilor indicatori:
o creștere a enzimelor excretoare (fosfatază alcalină, GGTP, 5-nucleotidază, glucuronidază); o creștere a bilirubinei, fosfolipidelor, acizilor biliari, colesterolului.
Sindromul citolitic vorbește despre distrugerea hepatocitelor, o creștere a permeabilității membranelor celulare. Condiția se dezvoltă cu daune virale, toxice. Modificările enzimelor indicatoare sunt caracteristice - ALT, AST, aldolază, LDH.
Fosfataza alcalină poate fi de origine hepatică sau osoasă. Colestaza este indicată de o creștere paralelă a GGTP. Activitatea crește odată cu tumorile hepatice (s-ar putea să nu apară galbenitatea). Dacă nu există o creștere paralelă a bilirubinei, este posibil să se presupună dezvoltarea amiloidozei, abcesului hepatic, leucemiei sau granulomului.
GGTP crește simultan cu o creștere a fosfatazei alcaline și indică dezvoltarea colestazei. O creștere izolată a GGTP poate fi cauzată de abuzul de alcool, atunci când încă nu există modificări grave în țesutul hepatic. Dacă se dezvoltă fibroză, ciroză sau hepatită alcoolică, nivelul altor enzime hepatice crește în același timp.
Transaminazele sunt reprezentate de fracții ALT și AST. Aspartatul aminotransferază se găsește în mitocondriile ficatului, inimii, rinichilor și mușchilor scheletici. Deteriorarea celulelor lor este însoțită de eliberarea unei cantități mari de enzimă în sânge. Alanina aminotransferaza este o enzimă din citoplasmă. Cantitatea sa absolută este mică, dar conținutul în hepatocite este cel mai mare în comparație cu miocardul și mușchii. Prin urmare, o creștere a ALT este mai specifică pentru afectarea celulelor hepatice.
Ceea ce contează este schimbarea raportului AST / ALT. Dacă este 2 sau mai mult, atunci aceasta indică hepatită sau ciroză. În hepatita cu inflamație activă se observă mai ales enzime ridicate.
Lactatul dehidrogenază este o enzimă de citoliză, dar nu este specific ficatului. Poate crește la femeile însărcinate, la nou-născuți, după efort fizic greu. LDH crește semnificativ după infarct miocardic, embolie pulmonară, leziuni extinse cu relaxare musculară, cu anemie hemolitică și megaloblastică. Nivelul LDH este utilizat în diagnosticul diferențial al bolii Gilbert - sindromul de colestază este însoțit de un indicator normal de LDH. În alte icteruri, LDH rămâne neschimbată la început și apoi crește.
Testul enzimelor hepatice
Pregătirea pentru analiză începe cu o zi înainte. Este necesar să excludeți complet alcoolul, seara nu mâncați alimente grase și prăjite. Nu fumați cu o oră înainte de test.
Sângele venos de post se ia dimineața.
Profilul hepatic include determinarea următorilor indicatori:
ALT; AST; fosfatază alcalină; GGTP; bilirubină și fracțiunile sale.
De asemenea, acordați atenție proteinei totale, separat nivelul de albumină, fibrinogen, indicatori de glucoză, 5-nucleotidază, ceruloplasmină, alfa-1-antitripsină.
Diagnostic și norme
Parametrii biochimici normali care caracterizează funcția hepatică sunt prezentați în tabel
/ prelegeri de farmacologie / Prelegerea №1. Introducere în farmacologie. Farmacologie generală (început)
Mecanismele de absorbție (absorbție) enumerate „funcționează”, de regulă, în paralel, dar contribuția predominantă este de obicei făcută de unul dintre ele (difuzie pasivă, filtrare, transport activ, pinocitoză). Deci, în cavitatea bucală și în stomac, difuzia pasivă se realizează în principal, într-o măsură mai mică - filtrare. Alte mecanisme nu sunt practic utilizate.
În intestinul subțire nu există obstacole în calea implementării tuturor mecanismelor de absorbție; pe care o domină depinde de drog.
Procesele de difuzie pasivă și filtrare predomină în intestinul gros și rect. Ele sunt, de asemenea, principalele mecanisme de absorbție a medicamentelor prin piele.
Utilizarea oricărui medicament în scopuri terapeutice sau profilactice începe cu introducerea acestuia în corp sau cu aplicarea pe suprafața corpului. Rata de dezvoltare a efectului, severitatea și durata acestuia depind de căile de administrare. Căile de administrare existente sunt de obicei împărțite în ENTERAL (adică prin tractul digestiv: administrare prin gură, sub limbă, în duoden, în rect sau rectal) și PARENTERAL (adică ocolind tractul digestiv: intravenos administrare, intravenoasă arterială, intramusculară, subcutanată, inhalări - aerosoli, gaze, pulberi); administrare intratecală sau subarahnoidiană; în cele din urmă, utilizarea locală a medicamentelor: intrauterină, vaginală, vezicală, intraperitoneală etc.).
Calea de administrare a medicamentului depinde în mare măsură dacă acesta poate ajunge la locul de acțiune (în biofază) (de exemplu, în centrul inflamației) și poate avea un efect terapeutic.
II. DISTRIBUȚIA MEDICAMENTELOR ÎN CORP. BARIERE BIOLOGICE. DEPOZIT
După absorbție, substanțele medicinale pătrund de obicei în fluxul sanguin și apoi sunt transportate către diferite organe și țesuturi. Distribuția unui medicament este determinată de mulți factori, în funcție de care medicamentul va fi distribuit în organism în mod egal sau inegal. Ar trebui spus că majoritatea medicamentelor sunt distribuite inegal și doar o mică parte este distribuită relativ uniform (medicamente pentru inhalare pentru anestezie). Cei mai importanți factori care afectează distribuția medicamentului sunt: \u200b\u200b1) solubilitatea lipidelor,
2) gradul de legare la proteinele plasmatice din sânge, 3) intensitatea fluxului sanguin regional.
Solubilitatea lipidică a unui medicament determină capacitatea acestuia de a pătrunde în barierele biologice. Acestea sunt, în primul rând, peretele capilar și membranele celulare, care sunt principalele structuri ale diferitelor bariere histohematogene, în special, cum ar fi barierele hematoencefalice și placentare. Medicamentele liposolubile neionizate pătrund cu ușurință în membranele celulare și sunt distribuite în toate fluidele corpului. Distribuția medicamentelor care pătrund slab membranele celulare (medicamente ionizate) nu este distribuită atât de uniform.
Permeabilitatea BBB crește odată cu creșterea presiunii osmotice a plasmei sanguine. Diferite boli pot modifica distribuția medicamentelor în organism. Deci, dezvoltarea acidozei poate facilita pătrunderea medicamentelor în țesuturi - acizi slabi, care sunt mai puțin disociați în astfel de condiții.
Uneori distribuția unei substanțe medicamentoase depinde de afinitatea medicamentului pentru anumite țesuturi, ceea ce duce la acumularea lor în anumite organe și țesuturi. Un exemplu este formarea unui depozit de țesuturi în cazul utilizării preparatelor care conțin iod (J) în țesuturile glandei tiroide. Când se utilizează tetracicline, acestea din urmă se pot acumula selectiv în țesutul osos, în special în dinți. În acest caz, dinții, în special la copii, pot căpăta o culoare galbenă.
Această selectivitate de acțiune se datorează afinității tetraciclinelor față de substraturile biologice ale țesutului osos, și anume formarea complexelor de calciu de tetraciclină de tip chelat (hela - gheara cancerului). Aceste fapte sunt importante de reținut, în special pentru medicii pediatri și obstetricieni-ginecologi.
Unele medicamente se pot acumula în cantități mari în interiorul celulelor, formând depozite de celule (acriquine). Acest lucru se întâmplă datorită legării medicamentului la proteinele intracelulare, nucleoproteinele, fosfolipidele.
Unele medicamente pentru anestezie, datorită lipofilicității lor, pot forma depozite de grăsimi, care ar trebui, de asemenea, luate în considerare.
Medicamentele sunt depozitate, de regulă, datorită legăturilor reversibile, care, în principiu, determină durata șederii lor în depozitele de țesuturi. Cu toate acestea, dacă se formează complexe stabile cu proteine \u200b\u200bdin sânge (sulfadimetoxină) sau țesuturi (săruri ale metalelor grele), atunci prezența acestor fonduri în depozit se prelungește semnificativ.
De asemenea, trebuie avut în vedere faptul că, după absorbția în circulația sistemică, cea mai mare parte a substanței medicamentoase din primele minute intră în acele organe și țesuturi care sunt perfuzate cel mai activ de sânge (inimă, ficat, rinichi). Saturația mai lentă a medicamentului în mușchi, mucoase, piele și țesut adipos. Este nevoie de timp de la câteva minute până la câteva ore pentru a obține concentrații terapeutice de medicamente în aceste țesuturi.
Cea mai evidentă influență a stării hemodinamicii asupra distribuției medicamentelor este urmărită în condițiile patologiei. Faptul este că tulburările hemodinamice pot modifica semnificativ cinetica distribuției. Deci, cu șoc hemoragic sau cu insuficiență cardiacă congestivă, perfuzia majorității organelor este redusă. Încălcarea ratei de filtrare glomerulară și a fluxului sanguin hepatic duce la o scădere a clearance-ului renal și, respectiv, hepatic, care va afecta imediat creșterea concentrației medicamentului în plasma sanguină. În consecință, intensitatea și durata medicamentului vor fi crescute. Un exemplu este creșterea duratei acțiunii tiopentalului în șoc.
Multe substanțe medicinale au o puternică afinitate fizică și chimică pentru diferite proteine \u200b\u200bdin plasma sanguină. Cele mai importante în acest sens sunt albumina și, într-o măsură mai mică, alfa-glicoproteina acidă. Un astfel de medicament duce în cele din urmă la faptul că, după absorbție, poate circula în sânge nu numai sub formă liberă, ci și într-o formă asociată cu proteinele. Acesta este așa-numitul depozit EXTRACELULAR (extracelular) al unei substanțe medicinale, tipul său de rezervor din sânge. Fracțiunea medicamentului legat de proteinele plasmatice este un depozit temporar și previne fluctuații accentuate ale concentrației de substanțe nelegate în sânge și fluide corporale. Legarea medicamentelor de proteinele plasmatice limitează concentrația acestora în țesuturi și la locul de acțiune, deoarece numai medicamentul liber (nelegat) poate trece prin membrane. O substanță dintr-un complex cu o proteină este lipsită de activitate specifică. Legarea de proteine \u200b\u200breduce difuzia medicamentului în celulă și, prin urmare, încetinește procesul de metabolism. Legarea de proteine \u200b\u200breduce cantitatea de medicament care poate fi filtrată în glomerulii renali, în urma căreia procesul de excreție (excreție) încetinește, de asemenea.
Este practic sesizabil dacă medicamentul se leagă de proteine \u200b\u200bfoarte activ, adică cu mai mult de 90%. Puterea interacțiunii proteinelor din sânge și a medicamentelor se exprimă prin afinitate sau afinitate. Din această definiție (prevedere) rezultă o concluzie importantă:
Dacă A este un medicament,
iar O este proteină, apoi A + B \u003d AO
După cum se poate observa din această ecuație, părțile libere și legate ale medicamentului se află într-o stare de echilibru dinamic. Deoarece medicamentul este activ numai în stare liberă, este inactiv din cauza proteinelor. O comparație oarecum simplificată poate fi presupusă că, într-o stare liberă, medicamentul acționează asupra receptorilor farmacologici ai țesuturilor ca o cheie a unui blocaj și, în legătură cu o proteină, această cheie nu funcționează.
Gradul de afinitate, adică puterea de legare a medicamentului de proteină depinde de:
1) rata de intrare a substanței medicamentoase în țesuturi. Deoarece activitatea unui medicament este determinată de partea capabilă de difuzie, medicamentele cu un grad ridicat de afinitate, afinitate mare pentru proteine, cum ar fi sulfonamidele cu acțiune îndelungată (afinitate\u003e 90%), acționează lent și sunt conținute în interstițial ( intercelulare) lichid și celule tisulare în concentrații scăzute.
Un alt exemplu este glicozida cardiacă (digitoxina), care se leagă 97% de proteine. După ce a luat acest medicament în interior, acesta începe să acționeze numai după ore.
2) Durata acțiunii lor depinde de gradul de afinitate al medicamentului cu proteinele plasmatice. Digitoxina, după o singură doză, are un efect farmacologic în 2-3 zile, iar efectul său rezidual se realizează chiar și după câteva săptămâni (14-21 zile). Dacă în insuficiența cardiacă cronică, legarea medicamentelor de proteinele plasmatice scade, atunci în insuficiența pulmonară cronică sau în perioada postoperatorie crește (cu aproximativ 10%). La pacienții cu funcție renală redusă, procentul de legare de proteine \u200b\u200ba medicamentelor acide cu proprietăți acide scade.
3) Gradul de afinitate al unui medicament cu proteinele din sânge afectează diferența efectelor medicamentelor la persoanele cu patologii diferite. De exemplu, atunci când un pacient cu o boală de arsură dezvoltă hipoproteinemie profundă, fracția substanței medicamentoase libere crește, ceea ce într-o astfel de situație necesită o reducere a dozelor terapeutice ale medicamentului. O situație similară se poate dezvolta în timpul postului, când, dacă doza de medicament nu este redusă, se va produce un efect toxic asupra dozei sale obișnuite (în mod similar cu boala de radiații).
4) Utilizarea simultană a medicamentelor care se leagă de aceiași radicali ai moleculelor de proteine \u200b\u200bpoate provoca efectul competiției lor pentru conexiunea lor cu proteinele. Dacă, în acest caz, aceste medicamente au capacitate de legare diferită, adică afinitate diferită, poate apărea o creștere bruscă a concentrației unuia dintre ele, uneori la un nivel periculos. Deci, dacă pacientul primește un anticoagulant indirect (un medicament precum fenilina, neodocumarina), al cărui potențial de coagulare este corectat, atunci cu administrare suplimentară (inflamația articulațiilor) salicilați sau butadionă în plasma sanguină, nivelul liberului medicamentul (anticoagulant) poate crește semnificativ datorită deplasării sale de către salicilat (butadionă) dintr-un complex cu proteine. În consecință, există riscul de sângerare. Acest lucru poate fi prezentat schematic după cum urmează:
A + O \u003d AO + B \u003d BO + A, unde B este butadion.
Aceste date farmacocinetice au devenit cunoscute abia în ultimii ani.
Care este soarta ulterioară a drogurilor în organism? După hrănire și distribuție, medicamentele pot:
1) metabolizat sub influența enzimelor adecvate;
2) se schimbă spontan, transformându-se în alte substanțe fără influența enzimelor;
3) fie poate fi excretat din corp (fie excretat) nemodificat.
Unele substanțe medicamentoase se schimbă spontan (embihin), transformându-se în alte substanțe cu modificări corespunzătoare ale acidității mediului în organism. Astfel, într-un organism viu, substanțele medicinale suferă anumite modificări sau BIOTRANSFORMARE. Biotransformarea (sau transformarea sau metabolismul) este înțeleasă ca un complex de transformări fizico-chimice și biochimice ale substanțelor medicinale care contribuie la conversia lor în componente (metaboliți) mai simple, ionizate, mai polare și, prin urmare, solubile în apă, care sunt mai ușor de îndepărtat din corpul. Cu alte cuvinte, indiferent de structura pe care o posedă xenobioticul, enzima adecvată întâlnită cu ea o transformă într-o stare convenabilă pentru excreția din corp (de regulă, xenobioticul devine mai puțin lipofil) sau într-o stare pentru utilizare ca energie și material plastic (cocarboxilază, nucleinat de sodiu) ... Deși unele substanțe medicamentoase sunt biotransformate, ele formează metaboliți care sunt mai activi decât cei introduși în organism, marea majoritate a medicamentelor sunt inactivate, descompuse, transformate în metaboliți mai simpli, farmacologic mai puțin activi și mai puțin toxici. Biotransformarea medicamentelor administrate are loc în principal în ficat, dar se poate produce în rinichi, peretele intestinal, plămâni, mușchi și alte organe. Procesele de biotransformare sunt complexe și implică de obicei o serie de etape secvențiale, fiecare dintre ele fiind mediată de o anumită enzimă din sânge.
Există două (2) tipuri de reacții de metabolizare a medicamentelor în organism: NESINTETIC și SINTETIC.
1. Reacțiile nesintetice includ OXIDAREA, REDUCEREA și HIDROLIZA. Toate reacțiile metabolice nesintetice, numite și transformarea metabolică a medicamentelor, pot fi, de asemenea, împărțite în 2 grupe, în funcție de localizarea celor două sisteme principale de biotransformare:
a) principalul grup de reacții prin care cele mai multe medicamente sunt biotransformate sunt reacții catalizate de enzime ale reticulului endoplasmatic al hepatocitelor sau reacții MICROSOMALE;
b) reacții catalizate de enzime de altă localizare, reacții NON-MICROSOMALE.
Adică, dacă sistemul de biotransformare microsomală este reprezentat de enzime ale reticulului endoplasmatic al hepatocitelor hepatice, atunci sistemul non-microsomal este reprezentat de enzime de localizare diferită.
Reacțiile microsomale de oxidare sau reducere a medicamentelor sau, mai degrabă, grupurile lor active individuale în structura unei molecule de medicament, apar cu participarea sistemelor monooxigenază, ale căror componente principale sunt citocromul P-450 și nicotina amidadenina dinucleotidă fosforilată redusă (NADPH H ).
Acești citocromi sunt componentele principale ale sistemului enzimei oxidative monooxigenază. În majoritatea cazurilor, activitatea farmacologică a acestor metaboliți devine mai mică decât cea a substanței mamă.
O oxidare suplimentară a substanțelor medicamentoase are loc sub influența altor enzime oxidative, cum ar fi OXIDASE și REDUCTASE, cu participarea obligatorie a NADP și a oxigenului molecular.
Enzimele microsomale catalizează în principal procesele de oxidare a multor medicamente, apoi reacțiile de RESTAURARE și HIDROLIZĂ ale acestor medicamente sunt asociate nu numai cu enzimele microsomale, ci și non-microsomale. Deși enzimele non-microsomale sunt implicate în biotransformarea unui număr mic de medicamente, ele joacă în continuare un rol important în metabolismul lor. Biotransformarea non-microsomală a medicamentelor are loc și în ficat, dar poate apărea în plasma sanguină și în alte țesuturi (stomac, intestine, plămâni). De exemplu, putem cita biotransformarea acetilcolinei în plasma sanguină, efectuată de enzima ESTERASE, în cazul nostru - ACETILCOLINESTERAZA. Conform acestor reacții, un număr de medicamente utilizate în mod obișnuit sunt biotransformate, de exemplu, aspirina și sulfonamidele.
Reacțiile sintetice se bazează pe formarea de esteri asociați de medicamente cu acizi glucuronic, sulfuric, acetic, precum și cu glicină și glutation, care vă ajută să vă creați
compuși copolari, ușor solubili în apă, ușor solubili în lipide, care pătrund slab în țesuturi și, în majoritatea cazurilor, inactivi din punct de vedere farmacologic. În mod natural, acești metaboliți sunt bine excretați din corp. Astfel, reacțiile sintetice duc la formarea, sinteza unui nou metabolit și se efectuează folosind reacții de conjugare, acetilare, metilare etc.
De exemplu, biotransformarea medicamentelor prin reacții sintetice poate avea următoarea ilustrație. În ficatul adulților, antibioticul cloramfenicol este conjugat 90% cu acid glucuronic și doar 10% este excretat în urină nemodificat. Glucuronidele rezultate sunt ușor biotransformate și excretate. În același mod, medicamentele estrogenice și glucocorticoide, alcaloizii din opiu, salicilații, barbituricele și alte medicamente sunt eliminate din organism.
Din punct de vedere al evoluției, calea mai veche a biotransformării este adăugarea de grupări extrem de polare la xenobiotice (conjugare): acid glucuronic, sulfat, glicină, fosfat, acetil și grupări epoxidice, care fac xenobiotice mai solubile în apă. Calea evolutiv mai tânără - calea redox (reacții de oxidare, reducere, hidroliză) este considerată ca faza inițială a biotransformării. Produsele de oxidare sau reducere (faza I) sunt apoi de obicei supuse conjugării (faza II). Astfel, putem spune că reacțiile primei faze a biotransformării medicamentelor sunt de obicei nesintetice, în timp ce reacțiile celei de-a doua faze sunt sintetice.
De regulă, numai după faza II a biotransformării se formează compuși inactivi sau inactivi, prin urmare, reacțiile sintetice pot fi considerate reacții pure de detoxifiere a xenobioticelor, inclusiv medicamente.
Din punct de vedere practic, este important ca, cu ajutorul mai multor mijloace, să fie posibilă influențarea activă a proceselor de transformare microsomală a medicamentelor. Se observă că sub influența medicamentelor se pot dezvolta atât INDUCȚIA (creșterea activității), cât și DEPRESIA enzimelor microgomale. Există mult mai multe substanțe care stimulează biotransformarea prin inducerea sintezei proteinelor hepatice enzimatice decât există substanțe care suprimă această sinteză. Astfel de substanțe inductoare, dintre care peste 200 sunt descrise în prezent, includ fenobarbital, barbiturice, hexobarbital, cofeină, etanol, nicotină, butadionă, antipsihotice, difenhidramină, chinină, cordiamină, multe pesticide care conțin clor și insecticide.
Faza de glucuroniltransonă microsomală este implicată în activarea enzimelor hepatice de către aceste substanțe. În același timp, crește sinteza ARN și a proteinelor microsomale. Este important să ne amintim că inductorii sporesc nu numai metabolismul medicamentelor din ficat, ci și excreția lor în bilă.
Toate aceste substanțe accelerează procesele de metabolism hepatic de 2-4 ori numai prin inducerea sintezei enzimelor microsomale. În același timp, metabolismul nu numai al medicamentelor administrate împreună cu acestea sau pe fondul lor este accelerat, ci și al acestora. Cu toate acestea, există și un grup mare de substanțe (inhibitori) care suprimă și chiar distrug citocromul P-450, adică principala enzimă microsomală. Aceste medicamente includ un grup de anestezice locale, antiaritmice (anaprilin sau inderal, visken, eraldin), precum și cimeticină, cloramfenicol, butadionă, agenți anticolinesterazici, inhibitori MAO. Aceste substanțe prelungesc efectele medicamentelor administrate împreună cu ele. În plus, mulți dintre inhibitori provoacă fenomenul autoinhibiției metabolismului (verapamil, propranolol). Din cele spuse, este necesar să se ia în considerare această posibilitate atunci când se combină medicamente la un pacient. De exemplu, inducerea enzimelor microsomale ale celulelor hepatice de către fenobarbital stă la baza utilizării acestui medicament pentru eliminarea hiperbilirubinemiei la nou-născuții cu boală hemolitică.
Scăderea eficacității medicamentelor atunci când sunt utilizate în mod repetat se numește toleranță. Utilizarea aceluiași fenobarbatal ca o pastilă de dormit duce la dezvoltarea treptată a dependenței, adică la toleranță, care dictează necesitatea creșterii dozei de medicament. Tahifilaxia este un tip special de dependență.
TACHIFILAXIA este o dependență foarte rapidă de dependență, uneori după prima injecție a substanței. Deci, introducerea efedrinei intravenoase în mod repetat, cu un interval de minute, determină o creștere mai mică a tensiunii arteriale decât cu prima injecție. O situație similară se observă la instilarea soluțiilor de efedrină în nas.
Substanțele de inducție, activând enzimele microsomale, favorizează excreția crescută a vitaminei D din organism, ca urmare a căreia se poate dezvolta o înmuiere a oaselor și poate apărea o fractură patologică. Acestea sunt toate exemple de interacțiuni medicamentoase.
De asemenea, trebuie amintit faptul că agenții farmacologici pot fi împărțiți în 2 grupe în funcție de rata de inactivare a ficatului: primii sunt oxidați la o rată scăzută, de exemplu, difenină, carbamazenină; acesta din urmă - la viteză medie sau mare, de exemplu, imizină, izadrină, lidocaină, anaprilină.
În plus, metabolismul substanțelor medicinale depinde atât de speciile și genul animalelor, de rasa pacientului, cât și de vârstă, sex, nutriție (vegetarienii au o rată mai mică de biotransformare a medicamentelor, dacă alimentele conțin o mulțime de proteine , metabolismul este îmbunătățit), starea sistemului nervos, calea de administrare, de la utilizarea simultană a altor medicamente.
Mai mult, este important să ne amintim că fiecare persoană are propria sa rată de biotransformare determinată genetic. În acest sens, ne putem referi la exemplul alcoolului, atunci când există o particularitate individuală a activității alcoolului dehidrogenază la un individ. Aceste caracteristici ale activității individuale a enzimelor, în funcție de genotip, sunt studiate de farmacogenetică.
Un exemplu excelent de dependență genetică este inactivarea medicamentului anti-tuberculoză isoniazid (ftivazid) prin acetilare. S-a constatat că rata acestui proces este determinată genetic. Există indivizi care inactivează încet izoniazida. În același timp, concentrația sa în organism scade mai treptat decât la persoanele cu inactivare rapidă a medicamentului. Dintre populația europeană a acetilatorilor lenti, potrivit unor autori, se remarcă 50-58,6%, iar cele rapide - până la 30-41,4%. În același timp, dacă popoarele din Caucaz și suedezi sunt în principal acetilatori rapizi, atunci eschimoșii, dimpotrivă, se referă la acetilatori lent.
Dependența biotransformării individuale este, de asemenea, studiată de știința FARMACOGENETICĂ.
La acetilatorii lent, o anumită doză de medicament produce o concentrație mai mare în sânge și, prin urmare, pot avea mai multe efecte secundare. Într-adevăr, izoniazida dă 20% dintre pacienții cu tuberculoză, acetilatori lenti, complicații sub formă de neuropatie periferică și în acetilatori rapizi - doar în 3% din cazuri.
Bolile hepatice modifică biotransformarea substanțelor medicamentoase din acest organ. Pentru substanțele care se transformă lent în ficat, funcția celulelor hepatice joacă un rol important, al cărui nivel de activitate scade în hepatită, ciroză, reducând inactivarea acestor substanțe. Astfel de caracteristici multifactoriale ale biotransformării medicamentelor fac necesară studierea acestei probleme în fiecare caz specific.
Ultima etapă a interacțiunii medicamentelor cu un organism viu este excreția sau EXCRECȚIA lor.
Medicamentele, cu excepția medicamentelor pentru anestezia inhalatorie, sunt de obicei excretate nu prin structurile în care a avut loc absorbția (absorbția). Principalele căi de excreție sunt rinichii, ficatul, tractul gastro-intestinal, plămânii, pielea, glandele salivare, glandele sudoripare, laptele matern. Din punct de vedere clinic, ne interesează în special rinichii.
Excreția medicamentelor prin rinichi este determinată de trei procese efectuate în nefron:
1) FILTRARE glomerulară pasivă;
2) difuzie pasivă prin tubuli sau REABSORPȚIE;
3) SECRETIA tubulară activă.
După cum puteți vedea, toate procesele fiziologice din nefron sunt caracteristice medicamentelor. Medicamentele neionizate care sunt bine absorbite pot fi filtrate în glomerulii renali, dar din lumenul tubulilor renali, se pot difuza din nou în celulele care acoperă tubulii. Astfel, în urină apare doar o cantitate foarte mică de medicament.
Medicamentele ionizate care sunt slab absorbite sunt excretate aproape complet prin filtrare glomerulară și nu sunt reabsorbite.
Difuzia pasivă este un proces bidirecțional, iar substanțele medicinale se pot difuza prin peretele tubulului în orice direcție, în funcție de concentrația lor și de pH-ul mediului (de exemplu, acriquina, salicilați).
Valoarea pH-ului urinei influențează excreția anumitor acizi și baze slabe. Deci, acizii slabi sunt excretați rapid într-o reacție alcalină a urinei, de exemplu barbiturice și salicilați, iar bazele slabe sunt excretate rapid într-un mediu acid (fenamina). Prin urmare, în otrăvirea acută cu barbiturice, este necesară alcalinizarea urinei, ceea ce se realizează prin administrarea intravenoasă de soluții de bicarbonat de sodiu (sodă), acesta din urmă îmbunătățind excreția de somnifere.
Dacă pH-ul urinei nu corespunde valorii optime pentru excreția medicamentului, efectul acestor medicamente poate fi prelungit.
Cu o reacție alcalină a urinei, reabsorbția tubulară a acizilor slabi este minimă, deoarece cea mai mare parte a acestor substanțe se află într-o stare ionizată într-un mediu alcalin. Situația este similară în ceea ce privește bazele slabe cu reacție urinară acidă. Eliminarea bazelor slabe și a acizilor poate fi accelerată dacă se menține o cantitate mare de urină prin administrarea de manitol și diuretice (diuretice) și, de asemenea, corectată de valoarea pH-ului urinei la valoarea optimă pentru medicamentul dat.
Cu patologia rinichilor, capacitatea lor de a excreta substanțe medicinale scade. Ca urmare, chiar și atunci când se utilizează doze normale de medicamente, nivelul lor în sânge crește și efectul medicamentelor este prelungit. În acest sens, atunci când se prescriu medicamente precum antibiotice aminoglicozidice (streptomicină, gentamicină), anticoagulante cumarinice, pacienții cu funcție renală redusă (insuficiență renală) necesită un regim special de observare.
În concluzia acestei secțiuni, câteva cuvinte despre termenul „ELIMINARE”. În literatură, termenii „eliminare” și „excreție” sunt adesea folosiți interschimbabil. Dar trebuie amintit că ELIMINAREA este un termen mai larg care corespunde sumei tuturor proceselor metabolice (biotransformare) și excretoare, ca urmare a căreia substanța activă dispare din corp.
Consecința excreției sau eliminării insuficiente poate fi acumularea sau cumularea medicamentului în organism, în țesuturile acestuia. Cumularea - (acumulator - depozitare) este o consecință a excreției și eliminării insuficiente și, de regulă, este asociată cu patologia organului de excreție (ficat, tract gastrointestinal etc.) sau cu legarea crescută la proteinele plasmatice, ceea ce reduce cantitate dintr-o substanță care poate fi filtrată în glomeruli.
Există trei (3) modalități principale de combatere a cumulului:
1) reducerea dozei de substanță medicinală;
2) o pauză în prescrierea medicamentelor (2-3-4 zile-2 săptămâni);
3) în prima etapă, introducerea unei doze mari (doză de saturație), iar apoi transferul pacientului la o doză mică, de întreținere. Astfel, de exemplu, sunt utilizate glicozide cardiace (digitoxina).
Medicamentele sunt transformate în ficat prin mai multe procese catalizate de enzime. Toate aceste enzime sunt denumite în mod colectiv sistemul enzimatic microsomal și sunt prezente în reticulul endoplasmatic al hepatocitelor.
Enzime microsomale
Enzimele microsomale se găsesc în principal în reticulul endoplasmatic al celulelor hepatice. Microsomii fac parte din reticulul endoplasmatic, iar ribozomii atașați de aceștia sunt eliberați împreună atunci când celulele omogenizate sunt centrifugate.
Există mai multe enzime microsomale, care sunt reprezentate de monooxigenaze, citocromul P450, citocromul NADP c reductaza, glucoronil transferazele, glutation-c-transferazele, hidrolazele epoxidice etc. Citocromul P450 și citocromul reductazei NADPH sunt cele două enzime microsomale principale din acest sistem. Citocromul P450 se leagă de oxigen, în timp ce reductaza leagă electronii între NADPH și citocromul P450. Fosfolipidele sunt implicate în acest proces.
Citocromul P450
Enzima Citocrom P450 aparține familiei enzimelor care conțin un complex hemic care este atașat non-covalent la un lanț polipeptidic sau hemoproteine. Enzima a fost denumită ca atare, deoarece hemoproteina poate forma un complex care absoarbe maxim lumina la o lungime de undă de 450 nm. Această enzimă este implicată în metabolismul substanțelor endogene, cum ar fi sinteza steroizilor, metabolismul acizilor retinoici și grași etc.
Inducerea enzimelor hepatice microsomale
Enzimele hepatice microsomale pot fi activate de un medicament care se leagă de un receptor din citoplasmă sau nucleul celular. Acest receptor legat se poate deplasa în nucleul celular, poate forma un heterodimer, se poate lega de regiunile promotor ale genelor P450 și poate crește expresia genei. Acești inductori includ omeprozol, fenobarbital, rifampicină etc.
Inducerea sistemului enzimatic poate crește nivelul său metabolic de 2-4 ori. Această creștere a ratei de sinteză a enzimelor va continua atâta timp cât inductorul este prezent. Sistemul enzimatic poate reveni la valorile sale inițiale în decurs de una până la trei săptămâni.
Ficatul este cea mai mare glandă din tractul digestiv. Acesta îndeplinește funcția de laborator biochimic în organism și joacă un rol important în metabolismul proteinelor, glucidelor și lipidelor (vezi mai jos). Cele mai importante proteine \u200b\u200bale plasmei sanguine sunt sintetizate în ficat: albumină, fibrinogen, protrombină, ceruloplasmină, transferină, angiotensinogen etc. Prin intermediul acestor proteine, ficatul participă la procese atât de importante precum menținerea presiunii oncotice, reglarea tensiunii arteriale și sângele volum, coagulare a sângelui, metabolismul fierului etc.
Cea mai importantă funcție a ficatului este detoxifierea (sau bariera). Este esențial pentru păstrarea vieții organismului. În ficat, substanțe precum bilirubina și produse ale catabolismului aminoacizilor din intestin sunt neutralizate, precum și medicamentele și substanțele toxice de origine exogenă sunt inactivate, NH 3 este un produs al metabolismului azotului, care, ca urmare a reacțiilor enzimatice , se transformă în uree, hormoni și amine biogene ...
Substanțele care intră în organism din mediul înconjurător și nu sunt utilizate de acesta pentru a construi țesuturi ale corpului sau ca surse de energie se numesc substanțe străine sau xenobiotice. Aceste substanțe pot pătrunde în organism prin alimente, prin piele sau prin aerul inhalat.
Substanțele străine sau xenobiotice sunt împărțite în 2 grupe:
Produse ale activității economice umane (industrie, agricultură, transporturi);
Produse chimice de uz casnic - detergenți, agenți de combatere a insectelor, parfumuri.
Xenobioticele hidrofile sunt excretate din organism neschimbate prin urină, cele hidrofobe pot rămâne în țesuturi, se pot lega de proteine \u200b\u200bsau pot forma complexe
cu lipide ale membranelor celulare. În timp, acumularea unei substanțe străine în celulele tisulare va duce la întreruperea funcțiilor lor. Pentru a elimina astfel de substanțe inutile pentru organism în procesul de evoluție, au fost dezvoltate mecanisme pentru detoxifierea (neutralizarea) și îndepărtarea lor din corp.
I. MECANISME DE DISARACȚIE XENOBIOTICĂ
Neutralizarea majorității xenobioticelor are loc prin modificare chimică și se desfășoară în 2 faze (Fig. 12-1). Ca urmare a acestei serii de reacții, xenobioticele devin mai hidrofile și sunt excretate în urină. Substanțele care sunt mai hidrofobe sau au o greutate moleculară mare (\u003e 300 kDa) sunt mai des excretate cu bilă în intestin și apoi excretate în fecale.
Sistemul de neutralizare include multe enzime diferite, sub acțiunea cărora aproape orice xenobiotic poate fi modificat.
Enzimele microsomale catalizează reacțiile de C-hidroxilare, N-hidroxilare, O-, N-, S-dezalchilare, dezaminare oxidativă, sulfooxidare și epoxidare (Tabelul 12-1).
În membranele ER ale aproape tuturor țesuturilor, sistemul de oxidare microsomală (oxidare monooxigenază) este localizat. În experiment, când ER este eliberat din celule, membrana se rupe în părți, fiecare formând o veziculă închisă - un microsom, de unde și denumirea - oxidare microsomală. Acest sistem asigură prima fază de neutralizare a majorității substanțelor hidrofobe. Enzimele rinichilor, plămânilor, pielii și ale tractului gastro-intestinal pot participa la metabolismul xenobioticelor, dar sunt cele mai active în ficat. Grupul enzimelor microsomale include oxidaze specifice, diverse hidrolaze și enzime de conjugare.
Smochin. 12-1. Metabolismul și excreția xenobioticelor din organism.RH - xenobiotic; K - un grup utilizat pentru conjugare (glutation, glucuronil etc.); M este greutatea moleculară. Dintre numeroasele reacții dependente de citocromul P 450, figura prezintă doar una - schema hidroxilării xenobiotice. În timpul primei faze, un grup polar OH - este introdus în structura substanței RH. Apoi, apare o reacție de conjugare; conjugatul, în funcție de solubilitate și greutatea moleculară, este îndepărtat fie prin rinichi, fie cu fecale.
Funcțiile principale ale ficatului
Metabolismul glucidelor
Gluconeogeneză
Sinteza și descompunerea glicogenului
Schimbul de lipide și derivații acestora
Sinteza acizilor grași și a grăsimilor din carbohidrați Sinteza și excreția colesterolului Formarea lipoproteinelor Ketogeneza
Sinteza acizilor biliari 25-hidroxilarea vitaminei D 3
Metabolismul proteinelor
Sinteza proteinelor plasmatice din sânge (inclusiv unii factori de coagulare a sângelui) Sinteza ureei (neutralizarea amoniacului)
Schimb hormonalMetabolismul și eliberarea hormonilor steroizi Metabolismul hormonilor polipeptidici
Metabolizarea și excreția bilirubinei Depunerea
glicogen vitamina A vitamina B 12 fier
Medicamente și substanțe străine
Metabolism și excreție
Tabelul 12-1. Posibile modificări ale xenobioticelor în prima fază a neutralizării

A doua fază este reacțiile de conjugare, în urma cărora o substanță străină modificată de sistemele enzimatice ER se leagă de substraturi endogene - acid glucuronic, acid sulfuric, glicină, glutation. Conjugatul rezultat este îndepărtat din corp.
A. OXIDAREA MICROSOMALĂ
Oxidazele microsomale sunt enzime localizate în membranele ER netede, funcționând în combinație cu două CPE extramitocondriale. Enzimele care catalizează reducerea unui atom al moleculei de O 2 cu formarea apei și includerea unui alt atom de oxigen în substanța oxidată se numesc oxidoze microsomale cu funcție mixtă sau monooxigenaze microsomale. Oxidarea cu participarea monooxigenazelor este de obicei studiată folosind preparate microsomice.
1. Principalele enzime ale lanțurilor de transport de electroni microsomali
Sistemul microsomal nu conține componente proteice solubile în citosol, toate enzimele sunt proteine \u200b\u200bde membrană, ale căror centre active sunt localizate pe suprafața citoplasmatică a ER. Sistemul include mai multe proteine \u200b\u200bcare alcătuiesc lanțuri de transport de electroni (CPE). Există două astfel de lanțuri în ER, primul constă din două enzime - NADPH-P 450 reductază și citocrom P 450, al doilea include enzima NADH-citocrom-b 5 reductază, citocrom b 5 și o altă enzimă, stearoil-CoA desaturază .
Lanț de transport al electronilor - NADPH-P 450 reductază - citocrom P 450. În majoritatea cazurilor, donatorul de electroni (e) pentru acest lanț este NADPH, oxidat de NADPH-P 450 reductaza. Enzima ca grup protetic conține 2 coenzime - flavină adenină dinucleotidă (FAD) și flavină mononucleotidă (FMN). Protonii și electronii de la NADPH trec secvențial la coenzimele NADPH-P 450 reductază. FMN redus (FMNH 2) este oxidat de citocromul P 450 (vezi diagrama de mai jos).
Citocromul P 450 este o hemoproteină, conține o hemă de grup protetic și are situsuri de legare pentru oxigen și substrat (xenobiotice). Denumirea de citocrom P 450 indică faptul că absorbția maximă a complexului citocromului P 450 se află în regiunea de 450 nm.
Substratul oxidabil (donator de electroni) pentru NADH-citocromul L-5-reductază - NADH (vezi diagrama de mai jos). Protonii și electronii de la NADH sunt transferați în coenzima reductazei FAD, următorul acceptor de electroni este Fe 3+ al citocromului b 5. Citocromul b 5 în unele cazuri poate fi un donator de electroni (ē) pentru citocromul P 450 sau pentru stearoil-CoA desaturaza, care catalizează formarea de legături duble în acizii grași prin transferarea electronilor în oxigen pentru a forma apă (Fig. 12-2) ...
NADH-citocrom b 5 reductaza este o proteină cu două domenii. Domeniul citosolic globular leagă grupul protetic, coenzima FAD și o singură „coadă” hidrofobă ancorează proteina în membrană.
Citocromul b 5 este o proteină care conține hem, care are un domeniu localizat pe suprafața membranei ER și un scurt


Smochin. 12-2. Lanțuri de transport de electroni ER.RH - substrat al citocromului P 450; săgețile arată reacții de transfer de electroni. Într-un sistem, NADPH este oxidat de NADPH de citocromul P 450 reductază, care apoi transferă electroni într-o întreagă familie de citocrom P 450. Al doilea sistem implică oxidarea NADH de către citocromul b 5-reductază, electronii sunt transferați la citocromul b 5; forma redusă a citocromului b 5 este oxidată de stearoil-CoA desaturază, care transferă electroni la O 2.
domeniu înfășurat în bistratul lipidic.
NADH-citocrom b 5-reductază și citocrom b 5, fiind proteine \u200b\u200b„ancorate”, nu sunt fixate strict pe anumite părți ale membranei ER și, prin urmare, pot schimba localizarea acestora.
2. Funcționarea citocromului P 450
Se știe că oxigenul molecular în starea triplet este inert și nu poate interacționa cu compușii organici. Pentru a face oxigenul reactiv, este necesar să-l transformați în oxigen singulet folosind sisteme enzimatice pentru reducerea acestuia. Acestea includ sistemul monoxigenazei care conține citocromul P 450. Legarea substanței lipofile RH și a moleculei de oxigen în centrul activ al citocromului P 450 crește activitatea oxidativă a enzimei. Un atom de oxigen ia 2 ē și se transformă în forma O 2-. Donatorul de electroni este NADPH, care este oxidat de NADPH-citocromul P 450 reductaza. О 2- interacționează cu protoni: О 2- + 2Н + → Н 2 О și se formează apă. Al doilea atom al moleculei de oxigen este inclus în substratul RH, formând grupa hidroxil a substanței R-OH (Fig. 12-3).
Ecuația generală a reacției de hidroxilare a substanței RH de către enzimele de oxidare microsomală:
RH + O 2 + NADPH + H + → ROH + H 2 O + NADP +.
Substraturile P 450 pot fi multe substanțe hidrofobe atât de origine exogenă (medicamente, xenobiotice), cât și endogene (steroizi, acizi grași etc.).
Astfel, ca urmare a primei faze de neutralizare cu participarea citocromului P 450, substanțele sunt modificate odată cu formarea unor grupe funcționale care cresc solubilitatea compusului hidrofob. Ca urmare a modificării, molecula își poate pierde activitatea biologică sau chiar poate forma un compus mai activ decât substanța din care a fost formată.
3. Proprietățile sistemului de oxidare microsomală
Cele mai importante proprietăți ale enzimelor de oxidare microsomală sunt: \u200b\u200bspecificitatea largă a substratului, care face posibilă neutralizarea substanțelor dintr-o mare varietate de structuri și reglarea activității prin mecanismul de inducție.
Specificitate largă a substratului. Izoforme P 450
Până în prezent, au fost descrise aproximativ 150 de gene citocrom P 450 care codifică diferite izoforme ale enzimei. Fiecare dintre izoformele P 450

Smochin. 12-3. Transportul electronilor în timpul oxidării monooxigenazei cu participarea lui Р 450.Legarea (1) în centrul activ al citocromului P 450 al substanței RH activează reducerea fierului în hem - este atașat primul electron (2). O modificare a valenței fierului mărește afinitatea complexului Р 450 -Fе 2+ -RH pentru molecula de oxigen (3). Apariția unei molecule de O2 în situsul de legare al citocromului P 450 accelerează adăugarea celui de-al doilea electron și formarea complexului P 450 -Fe 2 + O 2 - -RH (4). În etapa următoare (5) Fe 2+ este oxidat, al doilea electron este adăugat la molecula de oxigen P 450 -Fe 3+ O 2 2-. Atomul de oxigen redus (O 2-) leagă 2 protoni și se formează 1 moleculă de apă. Al doilea atom de oxigen este utilizat pentru a construi gruparea OH (6). Substanța R-OH modificată este separată de enzimă (7).
are multe substraturi. Aceste substraturi pot fi atât substanțe lipofile endogene, a căror modificare este inclusă în calea metabolismului normal al acestor compuși, cât și xenobiotice hidrofobe, inclusiv medicamente. Anumite izoforme ale citocromului P 450 sunt implicate în metabolismul compușilor cu greutate moleculară mică, cum ar fi etanolul și acetona.
Reglarea activității sistemului de oxidare microsomală
Reglarea activității sistemului microsomal se efectuează la nivelul transcripției sau modificărilor post-transcripționale. Inducerea sintezei permite o creștere a cantității de enzime ca răspuns la aportul sau formarea de substanțe în organism, a cărui excreție este imposibilă fără participarea sistemului de oxidare microsomală.
În prezent, au fost descriși peste 250 de compuși chimici care induc inducerea enzimelor microsomale. Acești inductori includ barbiturice, policiclice
hidrocarburi chimice aromatice, alcooli, cetone și unii steroizi. În ciuda varietății structurilor chimice, toți inductorii au o serie de caracteristici comune; sunt clasificați ca compuși lipofili și servesc ca substraturi pentru citocromul P 450.
B. CONJUGAREA - A doua fază a substanțelor dezinfectante
A doua fază de neutralizare a substanțelor este reacțiile de conjugare, în timpul cărora se adaugă grupările funcționale formate în prima etapă a altor molecule sau grupuri de origine endogenă care cresc hidrofilicitatea și reduc toxicitatea xenobioticelor (Tabelul 12-2) .
1. Participarea transferazelor la reacțiile de conjugare
Toate enzimele care funcționează în a doua fază a detoxifierii xenobiotice sunt clasificate ca transferaze. Acestea se caracterizează printr-o specificitate largă a substratului.
Tabelul 12-2. Principalele enzime și metaboliți implicați în conjugare

UDP-glucuronil transferază
Localizate în principal în ER, uridinedifosfatul (UDP) -glucuroniltransferazele atașează reziduul de acid glucuronic la molecula substanței formate în timpul oxidării microsomale (Fig. 12-4).
În general, reacția cu participarea UDP-glucuroniltransferazei este scrisă după cum urmează:
ROH + UDP-C 6 H 9 O 6 \u003d RO-C 6 H 9 O 6 + UDP. Sulfotransferaza
Sulfotransferazele citoplasmatice catalizează reacția de conjugare, în timpul căreia reziduul de acid sulfuric (-SO 3 H) din 3 "-fosfoadenozină-5" -fosfosulfat (FAPS) este adăugat la fenoli, alcooli sau aminoacizi (Fig. 12-5).
Reacția cu participarea sulfotransferazei este în general scrisă după cum urmează:
ROH + FAF-SO 3 H \u003d RO-SO 3 H + FAF.

Smochin. 12-4. Acid uridin difosfoglucuronic (UDP-C 6 H 9 O 6).
Enzimele sulfotransferazei și UDP-glucuroniltransferazei sunt implicate în detoxifierea xenobioticelor, inactivarea medicamentelor și a compușilor endogeni biologic activi.
Glutation transferaza
Glutationul transferazele (GT) ocupă un loc special printre enzimele implicate în detoxifierea xenobioticelor, inactivarea metaboliților normali și a medicamentelor. Glutationul transferazele funcționează în toate țesuturile și joacă un rol important în inactivarea propriilor metaboliți: unii hormoni steroizi, prostaglandine, bilirubină, acizi biliari, produse LPO.
Există multe izoforme HT cu specificități diferite ale substratului. În celulă, HT-urile sunt localizate în principal în citosol, dar există variante de enzime în nucleu și mitocondrii. Glutationul (GSH) este necesar pentru ca HT să funcționeze (Figura 12-6).
Glutationul este o tripeptidă Glu-Cis-Gly (reziduul de acid glutamic este atașat la cisteină de grupul carboxil al radicalului).

Smochin. 12-5. 3 "-Fosfoadenozin-5" -fosfosulfat (FAF-SO 3 H).

Smochin. 12-6. Glutation (GSH).
HT au o specificitate largă pentru substraturi, al căror număr total depășește 3000. HT leagă foarte multe substanțe hidrofobe și le inactivează, dar numai cele cu un grup polar suferă modificări chimice cu participarea glutationului. Adică, substraturile sunt substanțe care, pe de o parte, au un centru electrofil (de exemplu, un grup OH) și, pe de altă parte, zone hidrofobe. Neutralizare, adică modificarea chimică a xenobioticelor cu participarea HT poate fi efectuată în trei moduri diferite:
Prin conjugarea substratului R cu glutation (GSH):
R + GSH→ GSRH
Ca urmare a substituției nucleofile:
RX + GSH→ GSR + HX,
Reducerea peroxizilor organici în alcooli:
R-HC-O-OH + 2 GSH→ R-HC-O-OH + GSSG + H 2 O.
În reacție: UN - grup hidroperoxid, GSSG - glutation oxidat.
Sistemul de neutralizare cu participarea HT și glutation joacă un rol unic în formarea rezistenței corpului la o varietate de influențe și este cel mai important mecanism de apărare al celulei. În timpul biotransformării unor xenobiotice sub acțiunea HT, se formează tioesterii (conjugați RSG), care sunt apoi convertiți în mercaptani, printre care s-au găsit produse toxice. Cu toate acestea, conjugatele GSH cu cele mai multe xenobiotice sunt mai puțin reactive și mai hidrofile decât substanțele inițiale și, prin urmare, mai puțin toxice și mai ușor de îndepărtat din corp (Fig. 12-7).

Smochin. 12-7. Neutralizarea 1-clorului, 2,4-dinitrobenzenului cu participarea glutationului.
Cu centrele lor hidrofobe, HT poate lega non-covalent un număr imens de compuși lipofili (detoxifiere fizică), prevenind pătrunderea lor în stratul lipidic al membranelor și perturbarea funcțiilor celulare. Prin urmare, HT este uneori numită albumină intracelulară.
HT poate lega covalent xenobioticele, care sunt electroliți puternici. Atașarea unor astfel de substanțe este „sinucidere” pentru HT, dar un mecanism suplimentar de apărare pentru celulă.
Acetiltransferaza, metiltransferaza
Acetiltransferazele catalizează reacțiile de conjugare - transferul reziduului de acetil din acetil-CoA în azotul grupării -SO2 NH2, de exemplu, în compoziția sulfonamidelor. Metiltransferazele cu membrană și citoplasmă cu participarea SAM metilează grupările -P \u003d O, -NH 2 și SH ale xenobioticelor.
2. Rolul hidrolazelor epoxidice în formarea diolilor
În a doua fază a neutralizării (reacția de conjugare), sunt implicate și alte enzime. Epoxi hidrolaza (epoxi hidrataza) atașează apă la epoxizii de benzen, benzpiren și alte hidrocarburi policiclice formate în timpul primei faze de neutralizare și le transformă în dioli (Fig. 12-8). Epoxizii formați în timpul oxidării microsomale sunt cancerigeni. Sunt foarte reactivi și pot participa la reacții de alchilare non-enzimatică ale ADN-ului, ARN-ului și proteinelor (vezi secțiunea 16). Modificările chimice ale acestor molecule pot duce la degenerarea unei celule normale într-o tumoare.

Smochin. 12-8. Neutralizarea benzantracenului.E 1 - enzima sistemului microsomal; E 2 - epoxid hidratază.
B. ROTAȚIA AMINOACIZILOR ÎN INTESTINAL. MANIPULAREA ȘI ÎNLĂTURAREA PRODUSELOR PUTRITE DIN CORP
Aminoacizii care nu sunt absorbiți în celulele intestinale sunt folosiți de microflora colonului ca nutrienți. Enzimele bacteriene descompun aminoacizii și îi transformă în amine, fenoli, indol, skatol, hidrogen sulfurat și alți compuși otrăvitori pentru organism. Acest proces este numit uneori degradarea proteinelor intestinale. În centrul degradării se află reacțiile de decarboxilare și dezaminare a aminoacizilor.
Formarea și neutralizarea n-crezolului și fenolului
Sub acțiunea enzimelor bacteriene, fenolul și crezolul se pot forma din aminoacidul tirozină prin distrugerea lanțurilor laterale ale aminoacizilor de către microbi (Fig. 12-9).
Produsele absorbite prin vena portă intră în ficat, unde fenolul și crezolul pot fi detoxificate prin conjugare cu un reziduu de acid sulfuric (FAFS) sau cu acid glucuronic în compoziția UDP-glucuronatului. Reacțiile conjugării fenolului și crezolului cu FAFS
catalizează enzima sulfotransferază (Fig. 12-10).
Conjugarea acizilor glucuronic cu fenol și crezol are loc cu participarea enzimei UDP-glucuronil transferază (Fig. 12-11). Produsele de conjugare sunt foarte solubile în apă și sunt excretate în urină prin rinichi. O creștere a cantității de conjugate de acid glucuronic cu fenol și crezol se găsește în urină cu o creștere a produselor de putrefacție a proteinelor din intestin.
Formarea și neutralizarea indolului și a skatolului
În intestin, din aminoacidul triptofan, microorganismele formează indol și skatol. Bacteriile distrug lanțul lateral al triptofanului, lăsând structura inelului intactă.
Indolul se formează ca rezultat al scindării lanțului lateral de bacterii, posibil sub formă de serină sau alanină (Fig. 12-12).
Skatolul și indolul sunt inofensive în ficat în 2 etape. În primul rând, ca urmare a oxidării microsomale, aceștia dobândesc o grupare hidroxil. Deci, indolul intră în indoxil și apoi intră într-o reacție de conjugare cu FAFS, formând acid indoxilsulfuric, sare de potasiu

Smochin. 12-9. Catabolismul bacterian al tirozinei.E - enzime bacteriene.

Smochin. 12-10. Conjugarea fenolului și crezolului cu FAFS.E - sulfotransferaza.


Smochin. 12-11. Participarea UDP-glucuroniltransferazei la detoxifierea crezolului și fenolului.E - UDP-glucuroniltransferaza.

Smochin. 12-12. Catabolism bacterian al triptofanului.E - enzime bacteriene.
care a primit numele animalului indican
(Fig. 12-13).
Neutralizarea acidului benzoic
Sinteza acidului hipuric din acid benzoic și glicină are loc la om și la majoritatea animalelor în principal în ficat (Fig. 12-14). Rata acestei reacții reflectă starea funcțională a ficatului.
În practica clinică, determinarea ratei de formare și excreție a acidului hipuric este utilizată după introducerea acidului xenobiotic benzoic (acid benzoic sodic) în organism - testul rapid.
D. CONEXIUNE, TRANSPORT ȘI MANIPULARE
XENOBIOTICA
În plasma sanguină, multe substanțe lipofile endogene și exogene sunt transportate de albumină și alte proteine.
Albumină- proteina principală a plasmei sanguine, care leagă diverse substanțe hidrofobe. Poate funcționa ca o proteină purtătoare pentru bilirubină, xenobiotice și medicamente.
În plus față de albumină, xenobioticele pot fi transportate prin sânge ca parte a lipoproteinelor, precum și într-un complex cu α 1 -glico-proteină acidă. Caracteristica acestei glicoproteine

Smochin. 12-13. Participarea sulfotransferazei la detoxifierea indolului.E - sulfotransferaza.

Smochin. 12-14. Formarea acidului hipuric din acid benzoic și glicină.E - glicină transferază.
constă în faptul că este o proteină inductibilă implicată în răspunsul organismului la modificările care apar într-o stare de stres, de exemplu, în timpul infarctului miocardic, proceselor inflamatorii; cantitatea sa în plasmă crește împreună cu alte proteine. Prin legarea xenobioticelor, α 1 -glicoproteina acidă le inactivează și le transferă în ficat, unde complexul cu proteina se descompune, iar substanțele străine sunt inofensive și excretate din organism.
Participarea glicoproteinei P la eliminarea xenobioticelor
Un mecanism foarte important pentru eliminarea xenobioticelor hidrofobe din celulă este funcționarea glicoproteinei P (transportul ATP-ase). P-glicoproteina este o fosfoglicoproteină de 170 kDa prezentă în membrana plasmatică a celulelor din multe țesuturi, în special în rinichi și intestine. Lanțul polipeptidic al acestei proteine \u200b\u200bconține 1280 resturi de aminoacizi, formând 12 domenii transmembranare și doi centri de legare ATP (Fig. 12-15).
În mod normal, funcția sa este de a excreta ioni de clor și compuși toxici hidrofobi din celule.
Când o substanță hidrofobă (de exemplu, un medicament anticancer) intră în celulă, aceasta este îndepărtată de aceasta prin glicoproteina P cu cheltuirea energiei (Fig. 12-16). O scădere a cantității de medicament dintr-o celulă reduce eficacitatea utilizării sale în chimioterapie pentru cancer.
E. INDUCEREA SISTEMELOR DE PROTECȚIE
Multe enzime implicate în prima și a doua fază de detoxifiere sunt proteine \u200b\u200binductibile. Chiar și în cele mai vechi timpuri, regele Mithridates știa că, dacă luați sistematic doze mici de otravă, puteți evita otrăvirea acută. „Efectul Mithridates” se bazează pe inducerea anumitor sisteme de apărare (Tabelul 12-3).
În membranele ER ale ficatului, citocromul P 450 conține mai mult (20%) decât alte enzime legate de membrană. Medicamentul fenobarbital activează sinteza citocromului

Smochin. 12-15. Structura glicoproteinei P.P-glicoproteina este o proteină integrală cu 12 domenii transmembranare care pătrund în bistratul membranei citoplasmatice. Capetele N și C ale proteinei sunt transformate în citosol. Zonele de glicoproteină P de pe suprafața exterioară a membranei sunt glicozilate. Regiunea dintre al șaselea și al șaptelea domeniu are site-uri pentru atașarea ATP și autofosforilare.

Smochin. 12-16. Funcționarea glicoproteinei P.
Ovalul umbrit este un medicament anticancer (substanță hidrofobă).
P 450, UDP-glucuronil transferază și epoxid hidrolază. De exemplu, la animalele cărora li s-a injectat fenobarbitalul inductor, crește aria membranei ER, care ajunge la 90% din toate structurile membranei celulare și, în consecință, o creștere a cantității de enzime implicate în neutralizarea xenobiotice sau toxice substanțe de origine endogenă.
Cu chimioterapia proceselor maligne, eficacitatea inițială a medicamentului scade adesea treptat. Mai mult, se dezvoltă rezistență la mai multe medicamente, adică rezistență nu numai la acest medicament, ci și la o serie de alte medicamente. Acest lucru se datorează faptului că medicamentele împotriva cancerului induc sinteza glicoproteinei P, glutation transferază și glutation. Utilizarea substanțelor care inhibă sau activează sinteza glicoproteinei P, precum și
enzime pentru sinteza glutationului, crește eficiența chimioterapiei.
Metalele sunt inductori ai sintezei glutationului și proteinei metalotioneinei cu greutate moleculară mică, care au grupări SH capabile să le lege. Ca urmare, crește rezistența celulelor corpului la otrăvuri și medicamente.
O creștere a cantității de glutation transferaze mărește capacitatea organismului de a se adapta la creșterea poluării mediului. Inducerea enzimei explică absența unui efect anticarcinogen atunci când se utilizează o serie de substanțe medicamentoase. În plus, inductorii sintezei glutation transferazei sunt metaboliți normali - hormoni sexuali, iodotironine și cortizol. Catecolaminele fosforilează glutationul transferază prin sistemul adenilat ciclazic și îi cresc activitatea.
O serie de substanțe, inclusiv medicamente (de exemplu, metale grele, polifenoli, S-alchili ai glutationului, unele erbicide) inhibă glutationul transferază.
ii. biotransformarea substanțelor medicamentoase
Medicamentele care intră în organism suferă următoarele transformări:
Aspiraţie;
Legarea proteinelor și transportul sângelui;
Interacțiunea cu receptorii;
Distribuția în țesuturi;
Metabolism și excreție din corp.
Mecanismul primei etape (absorbția) este determinat de proprietățile fizico-chimice ale medicamentului. Compușii hidrofobi pătrund ușor în membrane prin difuzie simplă, în timp ce
Tabelul 12-3. Inducerea sistemelor care asigură protecție împotriva xenobioticelor

ca medicamente insolubile în lipide, ele pătrund în membrane prin transfer transmembranar cu participarea diferitelor tipuri de translocaze. Unele particule mari insolubile pot pătrunde în sistemul limfatic prin pinocitoză.
Următorii pași în metabolismul unui medicament din organism sunt, de asemenea, determinați de structura sa chimică - moleculele hidrofobe se deplasează prin sânge într-un complex cu albumină, α 1 -glicoproteină acidă sau ca parte a lipoproteinelor. În funcție de structură, medicamentul poate curge din sânge în celulă sau, fiind analogi de substanțe endogene, se poate lega de receptorii membranei celulare.
Efectul asupra corpului celor mai multe medicamente se oprește după un anumit timp după administrarea lor. Încetarea acțiunii poate avea loc deoarece medicamentul este excretat din corp fie neschimbat - acest lucru este caracteristic compușilor hidrofili, fie sub formă de produse de modificare chimică a acestuia (biotransformare).
A. CARACTERUL CARACTERISTICILOR ÎN TIMPUL BIOTransformării substanțelor medicamentoase
Transformările biochimice ale substanțelor medicinale din corpul uman, asigurând inactivarea și detoxifierea acestora, sunt o manifestare specială a biotransformării compușilor străini.
Ca urmare a biotransformării substanțelor medicamentoase, pot apărea următoarele:
Inactivarea substanțelor medicamentoase, adică scăderea activității lor farmacologice;
Creșterea activității substanțelor medicamentoase;
Formarea metaboliților toxici.
Inactivarea substanțelor medicamentoase
Inactivarea substanțelor medicamentoase, ca toate xenobioticele, are loc în 2 faze. Prima fază este modificarea chimică sub acțiunea enzimelor sistemului ER monooxigenază. De exemplu, substanța medicamentoasă barbiturică în timpul biotransformării este transformată în hidroxibarbiturat, care apoi participă la reacția de conjugare cu reziduul de acid glucuronic. Enzima glucuroniltransferază catalizează formarea glucuronidei barbiturice; UDP-glucuronil este utilizat ca sursă de acid glucuronic (Fig. 12-17).
În prima fază de neutralizare sub acțiunea monooxigenazelor, se formează grupări reactive —OH, —COOH, —NH 2, —SH etc. Compuși chimici care au deja aceste grupuri intră imediat în a doua fază a reacțiilor de neutralizare - conjugare.
Creșterea activității de droguri
Un exemplu de creștere a activității unei substanțe în procesul de transformare a acesteia în organism este formarea desmetilimi-praminului din imipramină. Desmetilimipramina are o capacitate pronunțată de a atenua starea depresivă în tulburările mentale (Fig. 12-18).
Transformările chimice ale unor medicamente din organism duc la o schimbare a naturii activității lor. De exemplu, iprazida este un antidepresiv, care, ca urmare a dezalchilării, se transformă în izoniazidă, care are un efect antituberculoză (Fig. 12-19).
Formarea produselor toxice ca urmare a unei reacții de biotransformare.În unele cazuri, transformările chimice ale medicamentelor din organism pot duce la apariția proprietăților lor toxice. Asa de,

Smochin. 12-17. Metabolizarea ficatului barbituricelor.E 1 - enzime de oxidare microsomală; E 2 - glucuroniltransferaza.

Smochin. 12-18. Activarea imipraminei prin reacție de demetilare.

Smochin. 12-19. Formarea izoniazidelor în timpul dezalchilării ipraniazidei.

Smochin. 12-20. Conversia fenacetinei într-un produs toxic - parafenetidina.
antipiretic, analgezic, agent antiinflamator fenacetina se transformă în parafenetidină, care provoacă hipoxie datorită formării methemoglobinei, o formă inactivă a Hb (Fig. 12-20).
Reacții de conjugare a medicamentelor
A doua fază a inactivării este conjugarea (legarea) substanțelor medicamentoase, atât cele care au suferit unele transformări în prima etapă, cât și medicamentele native. Glicina la gruparea carboxil, acidul glucuronic sau reziduul de acid sulfuric la gruparea OH și reziduul de acetil la gruparea NH2 pot fi adăugați la produsele formate de enzimele de oxidare microsomală.
Compușii endogeni formați în organism cu cheltuirea energiei SAM participă la transformările celei de-a doua faze de inactivare a substanțelor medicinale: (ATP), UDP-
glucuronat (UTP), acetil-CoA (ATP) etc. Prin urmare, putem spune că reacțiile de conjugare implică utilizarea energiei acestor compuși cu energie ridicată.
Un exemplu de reacție de conjugare este glucuronoconjugarea hidroxibarbituratului de către glucuronil transferază, așa cum s-a descris anterior (vezi Fig. 12-17). Ca exemplu de O-metilare a medicamentului, poate fi citată una dintre etapele de biotransformare a medicamentului metildopa, care perturbă formarea unui mediator adrenergic și este utilizată ca agent antihipertensiv (Fig. 12-21).
În principal compușii foarte hidrofili sunt eliberați nemodificați. Din substanțele lipofile, excepția este medicamentele pentru anestezie prin inhalare, a căror parte principală nu intră în reacții chimice în organism. Acestea sunt afișate de plămâni în aceeași formă în care au fost introduse.

Smochin. 12-21. Biotransformarea unei substanțe medicamentoase (metildopa).
B. Factorii care afectează activitatea
ENZIME DE BIOTRANSFORMARE A MEDICAMENTELOR
Medicamentele, ca urmare a modificării chimice, își pierd de obicei activitatea biologică. Astfel, aceste reacții limitează în timp efectul medicamentelor. Cu patologia ficatului, însoțită de o scădere a activității enzimelor microsomale, durata acțiunii unui număr de substanțe medicamentoase crește.
Unele medicamente scad activitatea sistemului monooxigenazei. De exemplu, levomicetina și butadiona inhibă enzimele de oxidare microsomală. Medicamentele anticolinesterazice, inhibitorii monoaminooxidazei, perturbă funcționarea fazei de conjugare, deci prelungesc efectele medicamentelor care sunt inactivate de aceste enzime. În plus, rata fiecărei reacții de biotransformare a unei substanțe medicinale depinde de factorii genetici, fiziologici și de starea ecologică a mediului.
Caracteristici de vârstă
Sensibilitatea la medicamente variază în funcție de vârstă. De exemplu, la nou-născuți, activitatea metabolismului medicamentului în prima lună de viață diferă semnificativ de cea la adulți. Acest lucru se datorează insuficienței multor enzime implicate în biotransformarea substanțelor medicamentoase, funcției renale, permeabilității crescute a barierei hematoencefalice și subdezvoltării sistemului nervos central. Astfel, nou-născuții sunt mai sensibili la anumite substanțe care afectează sistemul nervos central (în special, la morfină). Cloramfenicolul este foarte toxic pentru ei; acest lucru se datorează faptului că în ficat
la nou-născuți, enzimele necesare biotransformării sale sunt inactive.
La bătrânețe, metabolismul medicamentelor este mai puțin eficient: activitatea funcțională a ficatului scade, rata de excreție a medicamentelor de către rinichi este afectată. În general, sensibilitatea la majoritatea medicamentelor la bătrânețe este crescută și, prin urmare, doza lor trebuie redusă.
Factori genetici
Diferențele individuale în metabolismul unui număr de medicamente și în reacțiile la medicamente sunt explicate prin polimorfism genetic, adică existența în populație a izoformelor unor enzime de biotransformare.
În unele cazuri, hipersensibilitatea la medicamente se poate datora deficitului ereditar al unor enzime implicate în modificarea chimică. De exemplu, în cazul deficienței genetice a colinesterazei plasmatice din sânge, durata acțiunii ditilinei relaxante musculare crește brusc și poate ajunge la 6-8 ore sau mai mult (în condiții normale, ditilina acționează timp de 5-7 minute). Se știe că rata de acetilare a medicamentului anti-tuberculoză isoniazid variază destul de mult. Se disting persoanele cu activitate metabolizantă rapidă și lentă. Se crede că la persoanele cu inactivare lentă a izoniazidei, structura proteinelor care reglează sinteza enzimei acetiltransferază, care asigură conjugarea izoniazidei cu un reziduu de acetil, este întreruptă.
Factori de mediu
Un efect semnificativ asupra metabolismului medicamentelor din organism este exercitat de
de asemenea, factori de mediu, cum ar fi radiațiile ionizante, temperatura, compoziția alimentelor și în special diferite substanțe chimice (xenobiotice), inclusiv substanțele medicinale în sine.
III. METABOLISMUL ETANOLULUI FICAT
Catabolismul alcoolului etilic apare în principal în ficat. Aici, de la 75% la 98% din etanolul introdus în organism este oxidat.
Oxidarea alcoolului este un proces biochimic complex care implică principalele procese metabolice ale celulei. Transformarea etanolului în ficat se realizează în trei moduri cu formarea unui metabolit toxic - acetaldehidă (Fig. 12-22).
A. OXIDAREA ETANOLULUI DE DEHIDROGENAZA DE ALCOL NAD-DEPENDENT
Rolul principal în metabolismul etanolului îl are enzima dependentă de zinc NAD + - alcool dehidrogenază, care este localizată în principal în citosol și mitocondriile ficatului (95%). În cursul reacției, are loc dehidrogenarea etanolului și se formează acetaldehidă și coenzima redusă NADH. Alcoolul dehidrogenază catalizează o reacție reversibilă, a cărei direcție depinde de concentrația de acetaldehidă și de raportul NADH / NAD + din celulă.
C 9 H 5 OH + NAD + ↔ CH 3 CHO + NADH + H +.
Enzima alcool dehidrogenază este un dimer format din lanțuri polipeptidice, identice sau similare în structura lor primară, codificate de alele ale unei gene. Există 3 izoforme de alcool dehidrogenază (ADH): ADH 1, ADH 2, ADH 3, diferind în structura protomerilor, localizare și activitate. Europenii se caracterizează prin prezența izoformelor ADH 1 și ADH 3. La unele popoare din est, predomină izoforma ADH 2, care se caracterizează prin activitate ridicată; acesta poate fi motivul pentru sensibilitatea crescută a acestora la alcool. În alcoolismul cronic, cantitatea de enzimă din ficat nu crește, adică nu este o enzimă inductibilă.
B. OXIDAREA ETANOLULUI CU PARTICIPAREA SISTEMULUI DE ETANOLOXIDARE MICROSOMAL CYTOCHROME P 450
Sistemul de oxidare etanol microsomal (MEOS) al citocromului P 450 este localizat în membrana ER netedă a hepatocitelor. MEOS joacă un rol nesemnificativ în metabolismul unor cantități mici de alcool, dar este indus de etanol, alți alcooli, medicamente precum barbiturice și devine esențial în abuzul acestor substanțe. Această cale de oxidare a etanolului are loc cu participarea uneia dintre izoformele P 450, izozima P 450 II E 1. În alcoolismul cronic, oxidarea etanolului este accelerată cu 50-70% datorită hipertrofiei ER și inducerii citocromului P 450 II E 1.
C 9 H 5 OH + NADPH + H + + O 2 → CH 3 CHO + NADP + + 2 H 2 O.

Smochin. 12-22. Metabolizarea etanolului.1 - oxidarea etanolului prin alcool dehidrogenază (ADH) dependentă de NAD +; 9 - MEOS - sistem microsomal de oxidare a etanolului; 3 - oxidarea etanolului prin catalază.
Pe lângă reacția principală, citocromul P 450 catalizează formarea speciilor reactive de oxigen (O 2 -, H 2 O 2), care stimulează LPO în ficat și alte organe (vezi secțiunea 8).
în. oxidarea etanolului prin catalază
Catalaza, care se găsește în peroxizomii citoplasmei și mitocondriile celulelor hepatice, joacă un rol secundar în oxidarea etanolului. Această enzimă descompune aproximativ 2% din etanol, dar folosește și peroxid de hidrogen.
CH 3 CH 2 OH + H 2 O 2 → CH 3 CHO +2 H 2 O.
d. metabolismul și toxicitatea acetaldehidei
Acetaldehida formată din etanol este oxidată în acid acetic de două enzime: aldehidă oxidază dependentă de FAD și acetaldehidă dehidrogenază (ADH) dependentă de NAD +.
CH 3 CHO + O 2 + H 2 O → CH 3 COOH + H 2 O 2.
O creștere a concentrației de acetaldehidă în celulă induce inducerea enzimei aldehid oxidază. În timpul reacției, se formează acid acetic, peroxid de hidrogen și alte specii reactive de oxigen, ceea ce duce la activare
O altă enzimă, acetaldehida dehidrogenază (ALDH), oxidează substratul cu participarea coenzimei NAD +.
CH 3 CHO + H 2 O + NAD + → CH 3 COOH + + NADH + H +.
Acidul acetic obținut în timpul reacției este activat prin acțiunea enzimei acetil-CoA sintetază. Această reacție are loc cu utilizarea coenzimei A și a unei molecule de ATP. Acetil-CoA format, în funcție de raportul ATP / ADP și de concentrația de oxaloacetat în mitocondriile hepatocitelor, poate „arde” în CTX, merge la sinteza acizilor grași sau a corpilor cetonici.
În diferite țesuturi ale corpului uman, se găsesc variante polimorfe ale AldH. Acestea se caracterizează printr-o specificitate largă a substratului, o distribuție diferită asupra celulelor tisulare (rinichi, epiteliu, membrană mucoasă
stomac și intestine) și în compartimentele celulare. De exemplu, izoforma AldH localizată în mitocondriile hepatocitelor are o afinitate mai mare pentru acetaldehidă decât forma citosolică a enzimei.
Enzimele implicate în oxidarea etanol-alcool dehidrogenazei și ALDH sunt distribuite diferit: în citosol - 80% / 20% și mitocondrii - 20% / 80%. Odată cu aportul de doze mari de alcool (mai mult de 2 g / kg), datorită diferitelor rate de oxidare a etanolului și acetaldehidei în citosol, concentrația acestuia din urmă crește brusc. Acetaldehida este un compus foarte reactiv; poate acetiliza non-enzimatic grupe de proteine \u200b\u200bși alți compuși din celule SH-, NH2 și le poate perturba funcțiile. În proteinele modificate (acetilate), pot apărea „legături încrucișate” care nu sunt tipice pentru structura nativă (de exemplu, în proteinele matricei extracelulare - elastină și colagen, unele proteine \u200b\u200bde cromatină și lipoproteine \u200b\u200bformate în ficat). Acetilarea enzimelor nucleare, citoplasmatice și a proteinelor structurale duce la o scădere a sintezei proteinelor exportate de ficat în sânge, de exemplu, albumina, care, menținând presiunea osmotică coloidală, este implicată și în transportul multor substanțe hidrofobe în sângele (vezi pct. 14). Disfuncția albuminei în combinație cu efectul dăunător al acetaldehidei asupra membranelor este însoțită de intrarea în celule de-a lungul gradientului de concentrație al ionilor de sodiu și apă, apare umflarea osmotică a acestor celule și funcțiile lor sunt perturbate.
Oxidarea activă a etanolului și acetaldehidei duce la o creștere a raportului NADH / NAD +, care reduce activitatea enzimelor dependente de NAD + în citosol și, într-o măsură mai mică, în mitocondrii.
Bilanțul următoarei reacții se deplasează spre dreapta:
Dihidroxiacetonă fosfat + NADH + H + ↔ Glicerol-3-fosfat + NAD +,
Piruvat + NADH + H + ↔ Lactat + NAD +.
Recuperarea fosfatului de dihidroxiacetonă, un metabolit intermediar al glicolizei și gluconeogenezei, duce la o scădere a ratei
gluconeogeneză. Formarea glicerol-3-fosfatului crește probabilitatea sintezei grăsimilor în ficat. O creștere a concentrației de NADH comparativ cu NAD + (NADH\u003e NAD +) încetinește reacția de oxidare a lactatului, crește raportul lactat / piruvat și scade în continuare rata de gluconeogeneză (vezi secțiunea 7). Concentrația de lactat în sânge crește, ceea ce duce la hiperlactacidemie și acidoză lactică
(Fig. 12-23).
NADH este oxidat de enzima lanțului respirator NADH dehidrogenază. Apariția unui potențial electric transmembranar pe membrana mitocondrială interioară nu duce la sinteza ATP în întregime. Acest lucru este prevenit de încălcarea structurii membranei interioare a mitocondriilor, cauzată de acțiunea membranotropă a alcoolului etilic.
și efectul dăunător al acetaldehidei asupra membranelor.
Putem spune că acetaldehida activează indirect peroxidarea lipidelor, deoarece prin legarea grupelor SH ale glutationului, reduce cantitatea de glutation activ (redus) din celulă, care este necesară pentru funcționarea enzimei glutation peroxidază (vezi secțiunea 8) , care este implicat în catabolismul H2O2. Acumularea de radicali liberi duce la activarea peroxidării lipidice a membranelor și perturbarea structurii bistratului lipidic.
În etapele inițiale ale alcoolismului, oxidarea acetil-CoA în TCA este principala sursă de energie pentru celulă. Excesul de acetil-CoA din citrat părăsește mitocondriile, iar sinteza acizilor grași începe în citoplasmă. Acest proces, pe lângă ATP, necesită participarea NADPH,

Figura 12-23. Efectele etanolului în ficat.1 → 2 → 3 - oxidarea etanolului în acetat și conversia acestuia în acetil-CoA
(1 - reacția este catalizată de alcool dehidrogenază, 2 - reacția este catalizată de AldH). Rata de formare a acetaldehidei (1) este adesea mai mare atunci când beți o cantitate mare de alcool decât rata de oxidare a acestuia (9), prin urmare acetaldehida se acumulează și afectează sinteza proteinelor (4), inhibând-o și, de asemenea, scade concentrația de glutation (5), ca rezultat ce este ACTIVUL ACTIV. Rata de gluconeogeneză (6) scade, deoarece o concentrație mare de NADH formată în reacțiile de oxidare a etanolului (1, 9) inhibă gluconeogeneza (6). Lactatul este eliberat în sânge (7) și se dezvoltă acidoză lactică. Creșterea concentrației de NADH încetinește rata CTX; se acumulează acetil-CoA, se activează sinteza corpurilor cetonice (cetoză) (8). Oxidarea acizilor grași este, de asemenea, încetinită (9), sinteza grăsimilor este crescută (10), ceea ce duce la ficat gras și hipertriacilglicerolemie.
care se formează în timpul oxidării glucozei în ciclul de pentoză fosfat. TAG-urile sunt formate din acizi grași și glicerol-3-fosfat, care sunt secretate în sânge ca parte a VLDLP. Creșterea producției de VLDLP de către ficat duce la glicerolemie hipertriacilară. În alcoolismul cronic, o scădere a sintezei fosfolipidelor și proteinelor în ficat, inclusiv a apoproteinelor implicate în formarea VLDLP, determină acumularea intracelulară de TAG și ficat gras.
Cu toate acestea, în perioada de intoxicație acută cu alcool, în ciuda prezenței unei cantități mari de acetil-CoA, lipsa acetatului de oxalo reduce rata de formare a citratului. În aceste condiții, excesul de acetil-CoA merge la sinteza corpurilor cetonice, care sunt eliberate în sânge. O creștere a concentrației de lactat, acid acetoacetic și β-hidroxibutirat în sânge este cauza acidozei metabolice în intoxicația cu alcool.
După cum sa menționat mai devreme, reacția de formare a acetaldehidei din etanol are loc sub acțiunea alcoolului dehidrogenază. Prin urmare, odată cu creșterea concentrației de acetaldehidă și NADH în celulele hepatice, direcția reacției se schimbă - se formează etanol. Etanolul este un compus membranotrop; se dizolvă în bistratul lipidic al membranelor și le perturbă funcțiile. Acest lucru afectează negativ transferul transmembranar de substanțe, contactele intercelulare, interacțiunile receptorilor celulari cu moleculele de semnalizare. Etanolul poate trece prin membrane în spațiul intercelular și sânge și mai departe în orice celulă a corpului.
e. efectul etanolului și al acetaldehidei asupra metabolismului xenobioticelor și medicamentelor din ficat
Natura efectului etanolului asupra metabolismului xenobioticelor și drogurilor depinde de stadiul bolii alcoolice: stadiul inițial al alcoolismului, alcoolismului cronic sau o formă acută de intoxicație alcoolică.
Sistemul microsomal de oxidare a etanolului (MEOS), împreună cu metabolismul etanolului, este implicat în detoxifierea xenobioticelor și a medicamentelor. În stadiul inițial al bolii alcoolice, biotransformarea substanțelor medicamentoase are loc mai activ datorită inducției enzimelor sistemului. Acest lucru explică fenomenul rezistenței la medicamente. Cu toate acestea, în cazul intoxicației acute cu alcool etilic, biotransformarea substanțelor medicamentoase este inhibată. Etanolul concurează cu xenobiotice pentru legarea de citocromul P 450 II E 1, provocând hipersensibilitate („instabilitate” a medicamentului) la unele medicamente luate simultan cu acesta.
În plus, la persoanele care suferă de alcoolism cronic, se observă inducerea selectivă a izoformei P 450 II E 1 și inhibarea competitivă a sintezei altor izoforme implicate în metabolismul xenobioticelor și medicamentelor. Odată cu abuzul de alcool, este indusă și sinteza glucuronil transferazelor, dar formarea UDP-glucuronatului este redusă.
Alcoolul dehidrogenază are o specificitate largă a substratului și poate oxida diferiți alcooli, inclusiv metaboliții glicozidelor cardiace - digitoxină, digoxină și gitoxină. Concurența etanolului cu glicozide cardiace pentru centrul activ al alcoolului dehidrogenază duce la o scădere a ratei de biotransformare a acestui grup de medicamente și crește riscul de efect secundar al acestora la persoanele care iau doze mari de alcool.
O creștere a concentrației de acetaldehidă determină o serie de tulburări în structura proteinelor (acetilare), a membranelor (LPO), modificarea glutationului, care este necesară pentru una dintre cele mai importante enzime pentru neutralizarea xenobioticelor - glutationul transferază și apărarea antioxidazei enzima glutation peroxidază. Astfel, datele prezentate indică faptul că leziunile alcoolice ale ficatului sunt însoțite de o încălcare a celei mai importante funcții a acestui organ - detoxifierea.
Hepatolog → Despre ficat → Modificări ale enzimelor hepatice în diferite patologii, valoarea lor de diagnostic
Un grup de substanțe proteice care măresc activitatea diferitelor procese metabolice se numesc enzime.
Evoluția cu succes a reacțiilor biologice necesită condiții speciale - o temperatură ridicată, o anumită presiune sau prezența anumitor metale.
Enzimele ajută la accelerarea reacțiilor chimice fără aceste condiții.
Ce sunt enzimele hepatice
Pe baza funcției lor, enzimele sunt situate în interiorul celulei, pe membrana celulară, fac parte din diferite structuri celulare și participă la reacțiile din interiorul acesteia. În funcție de funcția îndeplinită, se disting următoarele grupuri:
hidrolaze - descompun moleculele substanțelor; sintetaze - participă la sinteza moleculară; transferaze - transportă părți ale moleculelor; oxidoreductaze - afectează reacțiile redox din celulă; izomerasele - schimbă configurația moleculelor; liasele - formează legături moleculare suplimentare.
Multe enzime necesită co-factori suplimentari pentru a funcționa. Toate vitaminele și microelementele își joacă rolul.
Ce sunt enzimele hepatice
Fiecare organet celular are propriul său set de substanțe care îi determină funcția în viața celulei. Enzimele metabolismului energetic sunt localizate pe mitocondrii, reticulul endoplasmatic granular este legat de sinteza proteinelor, reticulul neted este implicat în metabolismul lipidelor, glucidelor, lizozomii conțin enzime de hidroliză.
Enzimele care pot fi detectate în plasma sanguină sunt împărțite în mod convențional în trei grupe:
Secretor. Sunt sintetizate în ficat și eliberate în sânge. Un exemplu este enzimele de coagulare a sângelui, colinesteraza. Indicator sau celular (LDH, glutamat dehidrogenază, fosfatază acidă, ALT, AST). În mod normal, numai urme ale acestora se găsesc în ser. localizarea lor este intracelulară. Deteriorarea țesuturilor determină eliberarea acestor enzime în sânge, prin numărul lor unul poate judeca adâncimea leziunii. Enzimele excretoare sunt sintetizate și excretate împreună cu bilă (fosfatază alcalină). Încălcarea acestor procese duce la creșterea parametrilor lor în sânge.
Ce enzime sunt utilizate în diagnosticare
Procesele patologice sunt însoțite de apariția sindroamelor de colestază și citoliză. Fiecare dintre ele se caracterizează prin propriile modificări ale parametrilor biochimici ai enzimelor serice.
Sindromul colestatic este o tulburare a secreției biliare. Acesta este determinat de schimbarea activității următorilor indicatori:
o creștere a enzimelor excretoare (fosfatază alcalină, GGTP, 5-nucleotidază, glucuronidază); o creștere a bilirubinei, fosfolipidelor, acizilor biliari, colesterolului.
Sindromul citolitic vorbește despre distrugerea hepatocitelor, o creștere a permeabilității membranelor celulare. Condiția se dezvoltă cu daune virale, toxice. Modificările enzimelor indicatoare sunt caracteristice - ALT, AST, aldolază, LDH.
Fosfataza alcalină poate fi de origine hepatică sau osoasă. Colestaza este indicată de o creștere paralelă a GGTP. Activitatea crește odată cu tumorile hepatice (s-ar putea să nu apară galbenitatea). Dacă nu există o creștere paralelă a bilirubinei, este posibil să se presupună dezvoltarea amiloidozei, abcesului hepatic, leucemiei sau granulomului.
GGTP crește simultan cu o creștere a fosfatazei alcaline și indică dezvoltarea colestazei. O creștere izolată a GGTP poate fi cauzată de abuzul de alcool, atunci când încă nu există modificări grave în țesutul hepatic. Dacă se dezvoltă fibroză, ciroză sau hepatită alcoolică, nivelul altor enzime hepatice crește în același timp.
Transaminazele sunt reprezentate de fracții ALT și AST. Aspartatul aminotransferază se găsește în mitocondriile ficatului, inimii, rinichilor și mușchilor scheletici. Deteriorarea celulelor lor este însoțită de eliberarea unei cantități mari de enzimă în sânge. Alanina aminotransferaza este o enzimă din citoplasmă. Cantitatea sa absolută este mică, dar conținutul în hepatocite este cel mai mare în comparație cu miocardul și mușchii. Prin urmare, o creștere a ALT este mai specifică pentru afectarea celulelor hepatice.
Ceea ce contează este schimbarea raportului AST / ALT. Dacă este 2 sau mai mult, atunci aceasta indică hepatită sau ciroză. În hepatita cu inflamație activă se observă mai ales enzime ridicate.
Lactatul dehidrogenază este o enzimă de citoliză, dar nu este specific ficatului. Poate crește la femeile însărcinate, la nou-născuți, după efort fizic greu. LDH crește semnificativ după infarct miocardic, embolie pulmonară, leziuni extinse cu relaxare musculară, cu anemie hemolitică și megaloblastică. Nivelul LDH este utilizat în diagnosticul diferențial al bolii Gilbert - sindromul de colestază este însoțit de un indicator normal de LDH. În alte icteruri, LDH rămâne neschimbată la început și apoi crește.
Testul enzimelor hepatice
Pregătirea pentru analiză începe cu o zi înainte. Este necesar să excludeți complet alcoolul, seara nu mâncați alimente grase și prăjite. Nu fumați cu o oră înainte de test.
Sângele venos de post se ia dimineața.
Profilul hepatic include determinarea următorilor indicatori:
ALT; AST; fosfatază alcalină; GGTP; bilirubină și fracțiunile sale.
De asemenea, acordați atenție proteinei totale, separat nivelul de albumină, fibrinogen, indicatori de glucoză, 5-nucleotidază, ceruloplasmină, alfa-1-antitripsină.
Diagnostic și norme
Parametrii biochimici normali care caracterizează funcția hepatică sunt prezentați în tabel
| Indicator | Normă |
| Proteine \u200b\u200btotale | 65-85 g / l |
| Colesterol | 3,5-5,5 mmol / l |
| Bilirubina totală | 8,4-20,5 μmol / L |
| Bilirubina directă | 2,2-5,1 μmmol / l |
| Bilirubină indirectă | Până la 17,1 μmol / L |
| ALT | La bărbați, până la 45 U / L, la femei, până la 34 U / L |
| AST | La bărbați, până la 37 U / L, la femei, până la 30 U / L |
| Coeficientul Ritis (raport AST / ALT) | 0,9-1,7 |
| Fosfataza alcalină | Până la 260 U / l |
| GGTP | Pentru bărbați 10-71 U / L Pentru femei 6-42 U / L |
Enzime hepatice în timpul sarcinii
Majoritatea parametrilor de laborator în timpul sarcinii rămân în limita normală. Dacă există fluctuații minore ale enzimelor, acestea dispar la scurt timp după naștere. În al treilea trimestru, este posibilă o creștere semnificativă a fosfatazei alcaline, dar nu mai mult de 4 norme. Acest lucru se datorează eliberării unei enzime de către placentă.
O creștere a altor enzime hepatice, în special în prima jumătate a gestației, ar trebui să fie asociată cu dezvoltarea patologiei hepatice. Poate fi afectarea ficatului cauzată de sarcină - colestază intrahepatică, hepatoză grasă. De asemenea, va apărea o modificare a analizelor cu gestoză severă.
Ciroza și modificările biochimiei
Patologia ficatului asociată cu remodelarea țesuturilor determină modificări în toate funcțiile organului. Se observă o creștere a enzimelor nespecifice și specifice. Un nivel ridicat al acestuia din urmă este caracteristic cirozei. Acestea sunt astfel de enzime:
arginază; fructoză-1-fosfataldolază; nucleotidază.
În analiza biochimică, puteți observa modificări ale altor indicatori. Albumina scade la mai puțin de 40 g / l, globulinele pot crește. Colesterolul devine mai mic de 2 mmol / L, ureea este mai mică de 2,5 mmol / L. Este posibilă o creștere a haptoglobinei.
Bilirubina crește semnificativ datorită creșterii unei forme drepte și legate.
Enzime microsomale
Reticulul endoplasmatic al hepatocitelor produce formațiuni cavitare - microzomi care conțin un grup de enzime microsomale pe membranele lor. Scopul lor este de a neutraliza xenobioticele și compușii endogeni prin oxidare. Sistemul include mai multe enzime, printre care citocromul P450, citocromul b5 și altele. Aceste enzime detoxifică drogurile, alcoolul, toxinele.
Prin oxidarea substanțelor medicinale, sistemul microsomal accelerează excreția lor și reduce timpul de acțiune asupra corpului. Unele substanțe sunt capabile să crească activitatea citocromului, apoi vorbesc despre inducerea enzimelor microsomale. Acest lucru se manifestă prin accelerarea dezintegrării medicamentului. Alcoolul, rifampicina, fenitoina, carbamazepina pot acționa ca inductori.
Alte medicamente inhibă enzimele mirozomale, care se manifestă prin prelungirea duratei de viață a medicamentului și creșterea concentrației acestuia. Fluconazolul, ciclosporina, diltiazemul, verapamilul, eritromicina pot acționa ca inhibitori.
Atenţie! Având în vedere posibilitatea inhibării sau inducerii reacțiilor microsomale, numai un medic poate prescrie corect mai multe medicamente în același timp, fără a afecta pacientul.
Rolul oxidării microsomale în viața corpului poate fi greu supraestimat sau trecut cu vederea. Inactivarea xenobioticelor (substanțe otrăvitoare), descompunerea și formarea hormonilor suprarenali, participarea la metabolismul proteinelor și conservarea informațiilor genetice - acestea sunt doar o mică parte din fracțiunea cunoscută a problemelor care sunt rezolvate din cauza oxidării microsomale. Acesta este un proces autonom în organism, care începe după pătrunderea substanței declanșatoare și se termină cu eliminarea acesteia.
Definiție
Oxidarea microsomală este o cascadă de reacții care intră în prima fază a transformării xenobiotice. Esența procesului este hidroxilarea substanțelor folosind atomi de oxigen și formarea apei. Datorită acestui fapt, structura substanței originale se schimbă, iar proprietățile sale pot fi suprimate și îmbunătățite.
Oxidarea microsomală permite trecerea la reacția de conjugare. Aceasta este a doua fază a transformării xenobioticelor, la sfârșitul căreia moleculele produse în interiorul corpului se vor alătura grupului funcțional deja existent. Uneori se formează substanțe intermediare care provoacă leziuni ale celulelor hepatice, necroză și degenerare oncologică a țesuturilor.
Oxidarea de tip oxidază

Reacțiile de oxidare microsomală apar în afara mitocondriilor, deci consumă aproximativ zece la sută din tot oxigenul care intră în organism. Principalele enzime din acest proces sunt oxidazele. Structura lor conține atomi de metale cu valență variabilă, cum ar fi fierul, molibdenul, cuprul și altele, ceea ce înseamnă că sunt capabili să primească electroni. În celulă, oxidazele sunt localizate în vezicule speciale (peroxizomi), care sunt situate pe membranele exterioare ale mitocondriilor și în ER (reticul endoplasmatic granular). Substratul, care intră pe peroxizomi, pierde molecule de hidrogen, care se atașează la molecula de apă și formează peroxid.
Există doar cinci oxidaze:
Monoamin oxigenază (MAO) - ajută la oxidarea adrenalinei și a altor amine biogene produse în glandele suprarenale;
Diaminooxigenaza (DAO) - participă la oxidarea histaminei (un mediator al inflamației și alergiilor), poliaminelor și diaminelor;
L-aminoacid oxidază (adică molecule levorotatoare);
D-aminoacid oxidază (molecule dextrorotatoare);
Xantina oxidaza - va oxida adenina și guanina (baze azotate incluse în molecula ADN).
Importanța oxidării microsomale de tip oxidază este eliminarea xenobioticelor și inactivarea substanțelor biologic active. Formarea peroxidului, care are efect bactericid și curățare mecanică la locul leziunii, este un efect secundar care ocupă un loc important printre alte efecte.
Oxidarea de tip oxigenază

Reacțiile de tip oxigenază din celulă apar și pe reticulul endoplasmatic granular și pe membranele exterioare ale mitocondriilor. Acest lucru necesită enzime specifice - oxigenaze, care mobilizează molecula de oxigen din substrat și o introduc în substanța oxidată. Dacă se introduce un atom de oxigen, atunci enzima se numește monooxigenază sau hidroxilază. În cazul introducerii a doi atomi (adică o moleculă întreagă de oxigen), enzima se numește deaxigenază.
Reacțiile de oxidare de tip oxigenază sunt incluse într-un complex multienzimic cu trei componente, care este implicat în transferul de electroni și protoni de pe substrat cu activarea ulterioară a oxigenului. Întregul proces are loc cu participarea citocromului P450, care va fi discutat în detaliu.
Exemple de reacții de tip oxigenază
După cum sa menționat mai sus, monooxigenazele folosesc doar un singur atom de oxigen din cei doi disponibili pentru oxidare. A doua se atașează la două molecule de hidrogen și formează apă. Formarea colagenului este un exemplu de astfel de reacție. În acest caz, vitamina C acționează ca un donator de oxigen. Proline hidroxilaza ia molecula de oxigen din ea și o dă prolinei, care, la rândul ei, intră în molecula procolagenului. Acest proces conferă rezistență și elasticitate țesutului conjunctiv. Când organismul este deficitar în vitamina C, atunci se dezvoltă gută. Se manifestă prin slăbiciune a țesutului conjunctiv, sângerări, vânătăi, pierderea dinților, adică calitatea colagenului din organism devine mai mică.
Un alt exemplu sunt hidroxilazele, care convertesc moleculele de colesterol. Aceasta este una dintre etapele formării hormonilor steroizi, inclusiv a hormonilor sexuali.
Hidroxilaze scăzute specifice

Acestea sunt hidrolaze necesare pentru oxidarea substanțelor străine, cum ar fi xenobiotice. Sensul reacțiilor este de a face astfel de substanțe mai maleabile pentru excreție, mai solubile. Acest proces se numește detoxifiere și cea mai mare parte are loc în ficat.
Datorită includerii unei molecule întregi de oxigen în xenobiotice, ciclul reacțiilor este rupt și o substanță complexă se descompune în mai multe mai simple și mai accesibile pentru procesele metabolice.
Specii reactive de oxigen
Oxigenul este o substanță potențial periculoasă, deoarece oxidarea este în esență un proces de ardere. Ca moleculă de O2 sau apă, este stabilă și inertă chimic, deoarece nivelurile sale electrice sunt pline și electroni noi nu se pot atașa. Dar compușii în care oxigenul nu are toți o pereche de electroni sunt foarte reactivi. Prin urmare, ele sunt numite active.
Astfel de compuși de oxigen:
În reacțiile de monoxid se formează superoxid, care este separat de citocromul P450.În reacțiile de oxidază se formează un anion peroxid (peroxid de hidrogen) .În timpul reoxigenării țesuturilor care au suferit ischemie.
Cel mai puternic agent oxidant este radicalul hidroxil; acesta există în formă liberă doar o milionime de secundă, dar în acest timp reușește să sufere multe reacții oxidative. Particularitatea sa este că radicalul hidroxil acționează asupra substanțelor numai în locul în care a fost format, deoarece nu poate pătrunde prin țesuturi.
Anion superoxid și peroxid de hidrogen
Aceste substanțe sunt active nu numai în locul de formare, ci și la o anumită distanță de ele, deoarece pot pătrunde prin membranele celulare.
Grupul hidroxil determină oxidarea reziduurilor de aminoacizi: histidină, cisteină și triptofan. Acest lucru duce la inactivarea sistemelor enzimatice, precum și la întreruperea proteinelor de transport. În plus, oxidarea microsomală a aminoacizilor duce la distrugerea structurii bazelor azotate nucleice și, ca urmare, suferă aparatul genetic al celulei. Acizii grași, care fac parte din stratul bilipid al membranelor celulare, sunt de asemenea oxidați. Acest lucru afectează permeabilitatea lor, funcționarea pompelor electrolitice cu membrană și localizarea receptorilor.
Inhibitorii de oxidare microsomală sunt antioxidanți. Se găsesc în alimente și sunt produse în interiorul corpului. Cel mai renumit antioxidant este vitamina E. Aceste substanțe pot inhiba oxidarea microsomală. Biochimia descrie interacțiunea dintre ele în conformitate cu principiul feedback-ului. Adică, cu cât sunt mai multe oxidaze, cu atât sunt mai mult suprimate și invers. Acest lucru ajută la menținerea unui echilibru între sisteme și a unei constanțe a mediului intern.
Lanț de transport electric

Sistemul de oxidare microsomală nu are componente solubile în citoplasmă; prin urmare, toate enzimele sale sunt colectate pe suprafața reticulului endoplasmatic. Acest sistem include mai multe proteine \u200b\u200bcare formează lanțul de electrotransport:
NADP-P450 reductază și citocrom P450;
NAD-citocrom B5 reductază și citocrom B5;
Steatoril-CoA desaturază.
Donatorul de electroni în majoritatea covârșitoare a cazurilor este NADP (fosfat de nicotinamidă adenină dinucleotidă). Este oxidat de NADP-P450 reductaza, care conține două coenzime (FAD și FMN) pentru a accepta electroni. La sfârșitul lanțului, FMN este oxidat cu P450.
Citocromul P450

Este o enzimă de oxidare microsomală, o proteină care conține hem. Legează oxigenul și substratul (de obicei xenobiotic). Numele său este asociat cu absorbția luminii cu o lungime de undă de 450 nm. Biologii l-au găsit în toate organismele vii. În acest moment, au fost descrise peste unsprezece mii de proteine \u200b\u200bcare alcătuiesc sistemul citocromului P450. În bacterii, această substanță este dizolvată în citoplasmă și se crede că această formă este cea mai veche din punct de vedere evolutiv decât la om. Citocromul nostru P450 este o proteină parietală fixată pe membrana endoplasmatică.
Enzimele acestui grup sunt implicate în schimbul de steroizi, acizi biliari și grași, fenoli, neutralizarea medicamentelor, otrăvurilor sau medicamentelor.
Proprietăți de oxidare microsomală

Procesele de oxidare microsomală au o specificitate largă a substratului și acest lucru, la rândul său, face posibilă neutralizarea unei varietăți de substanțe. Unsprezece mii de proteine \u200b\u200bale citocromului P450 se pot plia în mai mult de o sută cincizeci de izoforme ale acestei enzime. Fiecare dintre ele are un număr mare de substraturi. Acest lucru permite organismului să scape de aproape toate substanțele nocive care se formează în interiorul său sau provin din exterior. Produse în ficat, enzimele de oxidare microsomală pot acționa atât local, cât și la o distanță considerabilă de acest organ.
Reglarea activității de oxidare microsomală

Oxidarea microsomală în ficat este reglementată la nivelul ARN-ului mesager, sau mai bine zis al funcției sale - transcripție. Toate variantele citocromului P450, de exemplu, sunt înregistrate pe molecula de ADN și, pentru ca aceasta să apară pe EPR, este necesar să „rescrieți” unele informații din ADN în ARN mesager. ARNm este apoi direcționat către ribozomi, unde se formează molecule de proteine. Cantitatea acestor molecule este reglată extern și depinde de volumul substanțelor care trebuie dezactivate, precum și de disponibilitatea aminoacizilor necesari.
În acest moment, au fost descriși peste două sute cincizeci de compuși chimici care activează oxidarea microsomală în organism. Acestea includ barbiturice, carbohidrați aromatici, alcooli, cetone și hormoni. În ciuda acestei diversități aparente, toate aceste substanțe sunt lipofile (solubile în grăsimi), ceea ce înseamnă că sunt susceptibile la citocromul P450.