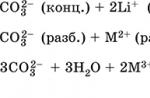Soda
(natron, natrijev bikarbonat, natrijev bikarbonat) - natrijeva sol koja neutralizira kiselinu. Soda bikarbona je natrijev bikarbonat NaHCO 3 , natrijev bikarbonat Općenito, "soda" je tehnički naziv za natrijeve soli ugljične kiseline H 2 CO 3 . Ovisno o kemijskom sastavu spoja, soda bikarbona (soda bikarbona, natrijev bikarbonat, natrijev bikarbonat, natrijev bikarbonat) - NaHCO 3, soda pepela (natrijev karbonat, bezvodni natrijev karbonat) - Na 2 CO 3 i kristalna soda - Na 2 CO 3. 10H 2 O, Na 2 CO 3 .7H 2 O, Na 2 CO 3 .H 2 O. Umjetna soda bikarbona (NaHCO3) je bijeli kristalni prah.
Moderna soda jezera poznata su u Transbaikaliji i Zapadnom Sibiru; Jezero Natron u Tanzaniji i jezero Searles u Kaliforniji vrlo su poznata. Trona, koja je od industrijske važnosti, otkrivena je 1938. godine kao dio eocenskih slojeva rijeke Green River (Wyoming, SAD).
U SAD-u, prirodna soda opskrbljuje više od 40% potreba zemlje za ovim mineralom. U Rusiji se, zbog nedostatka velikih naslaga, soda ne kopa iz minerala.
Soda je bila poznata čovjeku otprilike jednu i pol do dvije tisuće godina prije naše ere, a možda i ranije. Vađen je iz soda jezera i vađen iz nekoliko naslaga u obliku minerala. Prvi podaci o dobivanju sode isparavanjem vode iz soda jezera datiraju iz 64. godine. Sve do 18. stoljeća činilo se da su alkemičari svih zemalja svojevrsna tvar koja je šištala oslobađanjem neke vrste plina pod djelovanjem kiselina poznatih u to vrijeme - octene i sumporne. U vrijeme rimskog liječnika Dioskorida Pedanija nitko nije imao pojma o sastavu sode. Godine 1736. francuski kemičar, liječnik i botaničar Henri Louis Duhamel de Monceau uspio je po prvi put dobiti vrlo čistu sodu iz vode soda jezera. Uspio je ustanoviti da soda sadrži kemijski element "Natr". U Rusiji, još u vrijeme Petra Velikog, soda se zvala "zoda" ili "svrbež" i do 1860. uvozila se iz inozemstva. Godine 1864. u Rusiji se pojavila prva tvornica sode po tehnologiji Francuza Leblanca. Zahvaljujući pojavi svojih tvornica, soda je postala dostupnija i započela svoj pobjednički put kao kemijska, kulinarska, pa čak i medicina.
Kemijska svojstva
Natrijev bikarbonat je kisela natrijeva sol ugljične kiseline.Molekulska težina (prema međunarodnim atomskim masama 1971) - 84,00.
Reakcija s kiselinama
Natrijev bikarbonat reagira s kiselinama da nastane sol i ugljična kiselina, koja se odmah razgrađuje na ugljični dioksid i vodu:
NaHCO 3 + HCl → NaCl + H 2 CO 3
H 2 CO 3 → H 2 O + CO 2
u kuhanju je češća takva reakcija s octenom kiselinom s stvaranjem natrijevog acetata:
NaHCO 3 + CH 3 COOH → CH 3 COONa + H 2 O + CO 2
Soda bikarbona se dobro otapa u vodi. Vodena otopina sode bikarbone ima blago alkalnu reakciju. Šišanje sode rezultat je oslobađanja ugljičnog dioksida CO 2 kao posljedica kemijskih reakcija.
Termalno raspadanje
Na temperaturi od 60°C, natrijev bikarbonat se raspada na natrijev karbonat, ugljični dioksid i vodu (proces razgradnje je najučinkovitiji na 200°C):
2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
Nakon daljnjeg zagrijavanja na 1000 ° C (na primjer, kod gašenja požara sustavima praha), nastali natrijev karbonat se razgrađuje na ugljični dioksid i natrijev oksid:
Na 2 CO 3 → Na 2 O + CO 2.
fizikalno-kemijski pokazatelji
Natrijev bikarbonat je bijeli kristalni prah prosječne veličine kristala 0,05 - 0,20 mm. Molekulska težina spoja je 84,01, gustoća je 2200 kg/m³, nasipna gustoća je 0,9 g/cm³. Toplina otapanja natrijevog bikarbonata izračunava se kao 205 kJ (48,8 kcal) po 1 kg NaHCO 3, toplinski kapacitet doseže 1,05 kJ / kg.K (0,249 kcal / kg. ° C).
Natrijev bikarbonat je toplinski nestabilan i pri zagrijavanju se razgrađuje stvaranjem čvrstog natrijevog karbonata i oslobađanjem ugljičnog dioksida, kao i vode u plinovitu fazu:
2NaHCO 3 (tv.) ↔ Na 2 CO 3 (tv.) + CO 2 (g.) + H 2 O (para) - 126 kJ (- 30 kcal) Slično se razlažu vodene otopine natrijevog bikarbonata:
2NaHCO 3 (r.) ↔ Na 2 CO 3 (r.) + CO 2 (g.) + H 2 O (para) - 20,6 kJ (- 4,9 kcal) Vodena otopina natrijevog bikarbonata ima blago alkalni karakter, u vezu s kojom ne djeluje na životinjska i biljna tkiva. Topivost natrijevog bikarbonata u vodi je niska i s porastom temperature lagano raste: sa 6,87 g na 100 g vode pri 0 °C na 19,17 g na 100 g vode pri 80 °C.
Zbog niske topljivosti, gustoća zasićenih vodenih otopina natrijevog bikarbonata relativno se malo razlikuje od gustoće čiste vode.
Vrelište (raspada): 851° C;
Talište: 270°C;
Gustoća: 2,159 g/cm³;
Topljivost u vodi, g/100 ml na 20°C: 9.
Primjena
Natrijev bikarbonat (bikarbonat) koristi se u kemijskoj, prehrambenoj, laganoj, medicinskoj, farmaceutskoj industriji, obojenoj metalurgiji, a isporučuje se za trgovinu na malo.
Registriran kao aditiv za hranu E500.
Široko se primjenjuje u:
- kemijska industrija - za proizvodnju bojila, pjenaste plastike i drugih organskih proizvoda, fluornih reagensa, kemikalija za kućanstvo, punila u aparatima za gašenje požara, za odvajanje ugljičnog dioksida, sumporovodika iz plinskih smjesa (plin se apsorbira u otopini bikarbonata pri visokom i niskom tlaku temperature, otopina se obnavlja kada se zagrije i snizi tlak).
- laka industrija - u proizvodnji gumene potplate i umjetne kože, proizvodnji kože (štavljenje i neutralizacija kože).
- tekstilna industrija (dorada svilenih i pamučnih tkanina). Korištenje natrijevog bikarbonata u proizvodnji gumenih proizvoda također je posljedica oslobađanja CO 2 pri zagrijavanju, što doprinosi da guma dobije potrebnu poroznu strukturu.
- prehrambena industrija - pečenje, slastičarstvo, pića.
- medicinska industrija - za pripremu otopina za injekcije, lijekova protiv tuberkuloze i antibiotika.
- metalurgija – u taloženju rijetkih zemnih metala i flotaciji ruda.
kuhanje
Glavna primjena sode bikarbone je kuhanje, gdje se koristi uglavnom kao glavni ili dodatni prašak za pecivo u pečenju (budući da zagrijavanjem oslobađa ugljični dioksid), u proizvodnji slastica, u proizvodnji gaziranih pića i umjetnih mineralnih voda, samostalno ili kao dio složenog praška za pecivo (na primjer, prašak za pecivo, pomiješan s amonijevim karbonatom), na primjer, u biskvitu i prhkom tijestu. To je zbog lakoće njegovog raspadanja na 50-100 ° C.
Soda bikarbona, uglavnom se koristi u proizvodnji malih kolačića, slastičarskih mrvica, listova za kolače i lisnatog tijesta. U posljednjoj četvrtini XIX stoljeća. počela se koristiti u slastičarstvu, isprva samo u Francuskoj i Njemačkoj, a tek na samom kraju 19. i početkom 20. stoljeća - i u Rusiji.
Upotreba sode otvorila je put tvorničkoj proizvodnji modernih keksa - štancanju. Istovremeno, mnoge stare vrste kolačića - keksi, lisnati, lomljeni, medenjaci, napuhani, beze - povukli su se u prošlost, nestali ne samo iz javnosti, već i iz kućne upotrebe.
Soda je neophodan svakodnevni pomoćnik u kuhinji za pranje posuđa, posuda za konzerviranje, nekog voća i bobičastog voća prije sušenja. Ima sposobnost neutraliziranja i ubijanja mirisa.
Pogrešno je misliti da je soda začin samo za slastičarstvo. Osim u proizvodnji slastica, soda se koristi i za izradu engleskih marmelada, u mljevenom mesu za jela moldavske, rumunjske i uzbekistanske kuhinje (potash soda) te u pripremi pića. Količine sode dodane u sve navedene proizvode iznimno su male - od "na vrhu noža" do prstohvata i četvrtine žličice. U pićima sa sodom njegov je udio puno veći - pola i puna žličica po litri tekućine. Za slastičarske i druge namjene soda se stavlja prema receptu receptura, obično su to vrlo male doze. Čuvajte ga u hermetički zatvorenoj posudi, uzimajte suhim predmetom.
Industrijsko dobivanje sode dalo je velike mogućnosti u pripremi mnogih vrsta modernih konditorskih proizvoda u europskim zemljama. Rusija je dugo slijedila tradicionalni put, preferirajući kvasac i druge vrste tijesta.
U Rusiji se do druge polovice 19. stoljeća soda uopće nije koristila u pekarstvu i slastičarstvu. A na samom kraju 19. stoljeća proizvodi ove vrste najviše su se proizvodili u Ukrajini i Poljskoj, kao i u baltičkim državama. Rusko stanovništvo, koje je od pamtivijeka naviklo na prirodne vrste tijesta - bilo kvasac, kiselo tijesto ili jaja od meda, gdje se umjetne kemikalije nisu koristile kao sredstvo za podizanje, već su se koristili plinovi koji se prirodno pojavljuju tijekom pečenja, kao rezultat interakcije proizvoda kao što su med (šećer), jaja, kiselo vrhnje, alkohol (votka) ili vinski ocat - soda keksi imali su izuzetno nisku popularnost i nisku potražnju.
Konditorski proizvodi na bazi sode smatrani su “njemačkim” i ignorirani su iz čisto kulinarskih i okusnih razloga i iz “domoljubnih” razloga.
Osim toga, ruski nacionalni slastičarski proizvodi - medenjaci i medenjaci, glazirani biseri i orašasti plodovi kuhani u medu - imali su tako jedinstveno izvrstan okus da su uspješno konkurirali zapadnoeuropskim, profinjenijeg oblika, ali "slabih" u smislu sitosti, faktor kvalitete i okus francuskih keksa, gdje atraktivnost nije postignuta nimalo posebnim karakterom tijesta, već upotrebom egzotičnih začina, uglavnom vanilije.
Osim u slastičarstvu, soda se nikada nije koristila u ruskoj kuhinji i do sada se zapravo nije koristila. U međuvremenu, u baltičkim državama, Moldaviji, Rumunjskoj i na Balkanu, soda se koristi kao dizač u brojnim jelima koja se pripremaju prženjem. Dakle, soda se dodaje raznim prženim jelima od polu-tijesta: palačinke od krumpira, koje također uključuju pšenično brašno; razne palačinke, vrhnje i krafne, kolači od sira od kombinacije svježeg sira i brašna, kao i mljeveno meso, ako se sastoje samo od mesa i luka, bez dodataka brašna (brašno, bijeli kruh, krušne mrvice) . Takvo sirovo mljeveno meso (govedina, svinjetina) ostavi se s dodatkom sode da odstoji u hladnjaku nekoliko sati, a zatim se od tog mljevenog mesa lako formiraju "kobasice" koje se brzo (za 10-15 minuta) peku na roštilju. pećnica bilo koje kućne peći (plinska, drva ili električna).
Slična upotreba sode u mljevenom mesu poznata je i u armenskoj kuhinji, s jedinom razlikom što se u takvim slučajevima mljeveno meso ne smije stajati, već se odmah podvrgne intenzivnom mućenju uz dodatak nekoliko kapi (5- 8) od konjaka, a zapravo se pretvara u mesni soufflé koji se koristi za kuhanje raznih nacionalnih jela (uglavnom kalolak).
U zemljama engleskog govornog područja Europe i Amerike (Engleska, Škotska, na istočnoj obali SAD-a i Kanade) soda se koristi kao nezamjenjiv dodatak pekmezu od citrusa (naranče, pumpelmoses, limun, grejp), kao i za priprema kandiranog voća. Time se postiže posebna probavljivost citrusa, njihove tvrde kore, pretvaranje takvog džema u neku vrstu guste marmelade, a ujedno se smanjuje stupanj neugodne gorčine koja je uvijek prisutna u kori citrusa. (ali ne nestaje u potpunosti!) Kore naranči, koje nam čine svojevrsni balast, otpad od upotrebe ovih plodova, uz pomoć sode, postaju vrijedna sirovina za dobivanje mirisne, vrlo hranjive marmelade.
U srednjoazijskim kuhinjama soda se koristi u pripremi neslatkišnih vrsta jednostavnog tijesta kako bi mu dala posebnu elastičnost i pretvorila ga u rastezljivo tijesto bez upotrebe biljnog ulja, kao što je uobičajeno u južnoj Europi, Mediteranu i Balkanu. kuhinje. U srednjoj Aziji komadi jednostavnog beskvasnog tijesta, nakon uobičajenog polusatnog odležavanja, navlaže se malom količinom vode u kojoj se otopi 0,5 žličice soli i 0,5 žličice sode, a zatim se rukom razvlače u najtanji rezanci (tzv. Dungan rezanci), koji su nježnog, ugodnog okusa i koriste se za pripremu nacionalnih jela (lagman, monpara, shimy itd.).
Soda kao oskudan dodatak svakoj hrani tijekom kuhanja, a to je i tijekom toplinske obrade, dodaje se u mnoge nacionalne kuhinje, s obzirom na to da u nekim slučajevima to daje ne samo neočekivani učinak okusa, već i obično čisti sirovine hrane i cijelo jelo od raznih nasumičnih sporednih mirisa i okusa.
Općenito, uloga sode u kuhinji, čak i uz kulinarski proces, vrlo je značajna. Doista, bez sode, gotovo je nemoguće savršeno očistiti blagovaonicu i kuhinju od emajliranih, porculanskih, staklenih i fajansa posuđa, kao i kuhinjskih alata i opreme od stranih mirisa i raznih naslaga i patine. Soda je posebno neophodna i neophodna pri čišćenju pribora za čaj – čajnika i šalica od naslaga čaja i filmova koji se stvaraju na njihovim stijenkama.
Jednako tako je potrebno koristiti sodu i pri pranju posuđa u kojem se kuhala riba kako bi se otklonio riblji miris. Obično rade ovako: uporni riblji miris otklanjaju brisanjem posuđa lukom, a zatim uništavaju (isperu) miris luka čišćenjem ovog posuđa sodom.
Jednom riječju, soda je nezaobilazna komponenta kuhinjske proizvodnje i bez nje se u dobroj kuhinji ne može. Štoviše, njegova odsutnost iz arsenala kuhara ili domaćice postaje odmah uočljiva, jer veže onoga koji radi za štednjakom ili za stolom za rezanje u mnogim svojim postupcima.
Suvremene ekološke prilike uzrokovale su još jednu novu upotrebu sode u kuhinji kao sredstva za poboljšanje kvalitete biljnih sirovina. Možete, na primjer, preporučiti pranje svega prerađenog, ali još nesjeckanog povrća - prije nego što ga stavite u kotao ili u tavu - u otopini sode u vodi. Ili u već oguljene krumpire, prelivene hladnom vodom i namijenjene kuhanju ili gnječenju, dodajte jednu ili dvije žličice sode. Time će se krumpir ne samo očistiti od kemikalija koje su korištene u njegovom uzgoju, nego će i sam proizvod učiniti lakšim, čišćim, ljepšim, ukloniti sve bočne mirise nastale tijekom transporta ili nepravilnog skladištenja, kao i kvarenje. Sam krumpir će nakon kuhanja postati mrv i ukusan. Dakle, upotreba sode prije kuhanja, tijekom hladne obrade (tada se proizvod temeljito ispere hladnom vodom), može poboljšati kvalitetu biljnih prehrambenih sirovina, posebno škrobnog povrća, u korjenastim i lisnatim usjevima (kupus, zelena salata). , špinat, peršin itd.). .).
Soda je tako čvrsto zauzela mjesto alkalnog sredstva da je do sada ništa nije moglo pomaknuti iz ove pozicije. Soda bikarbona kao prašak za pecivo može djelovati na dva načina. Prvo, razgrađuje se kada se zagrijava prema reakciji:
2NaHCO 3 (soda) → Na 2 CO 3 (sol) + H 2 O (voda) + CO 2 (ugljikov dioksid).
I u ovom slučaju, ako u tijesto za pecivo dodate preveliku količinu sode, ono možda neće imati vremena da se termički razgradi bez ostatka u kratkom vremenu pečenja, a kolačići ili torta će dobiti neugodan "soda" okus.
Na isti način kao i potaša, soda reagira s kiselinama sadržanim u tijestu ili tamo umjetno dodanim:
NaHCO 3 (soda) + R-COOH (kiselina) → R-COONa (sol) + H 2 O (voda) + CO 2 (ugljični dioksid)
Mnogo različitih markiranih vrećica i njihova dostupnost ne ukidaju zabavu za mlade kemičare – da sami naprave prašak za pecivo.
proporcionalni sastav takvog tradicionalnog praha:
2 dijela kisele vinske soli
1 dio sode bikarbone
1 dio škroba ili brašna.
Lijek
Svi znaju kako izgleda soda – to je bijeli prah koji upija vodu i savršeno se otapa u njoj. Ali malo ljudi zna za nevjerojatna ljekovita svojstva ove "jednostavne" tvari. U međuvremenu, soda - natrijev bikarbonat - jedan je od glavnih sastojaka naše krvi. Rezultati istraživanja učinka sode na ljudsko tijelo premašili su sva očekivanja. Pokazalo se da soda može izjednačiti kiselinsko-baznu ravnotežu u tijelu, obnoviti metabolizam u stanicama, poboljšati apsorpciju kisika u tkivima, a također spriječiti gubitak vitalnog kalija. Soda pomaže kod žgaravice, morske bolesti, prehlade, srčanih i glavobolja, kožnih bolesti. Kao što vidite, soda je lijek za prvu pomoć.
Otopina sode bikarbone koristi se kao slab antiseptik za ispiranje, kao i tradicionalno sredstvo za neutralizaciju kiseline za žgaravicu i bolove u želucu (moderna medicina ne preporuča korištenje zbog nuspojava, uključujući i zbog "povratka kiseline") ili za eliminirati acidozu itd.
Soda bikarbona se koristi za liječenje bolesti povezanih s visokom kiselošću; otopina sode bikarbone koristi se za grgljanje, za pranje kože u slučaju dodira s kiselinama.
Natrijev bikarbonat (soda bikarbona) može usporiti napredovanje kronične bubrežne bolesti. Ovaj zaključak donijeli su znanstvenici iz Royal London Hospital (Royal London Hospital), UK. Proučavali su 134 osobe s uznapredovalom kroničnom bubrežnom bolešću i metaboličkom acidozom.
Jedna skupina ispitanika primala je konvencionalno liječenje, a druga je, osim tradicionalnog, dnevno dobivala malu količinu tableta sode bikarbone. U onih pacijenata koji su pili natrijev bikarbonat, funkcija bubrega pogoršavala se 2/3 sporije nego u drugih.
Brzo napredovanje bubrežne bolesti uočeno je u samo 9% skupine koja je uzimala gazirana pića u odnosu na 45% tradicionalno liječenih ispitanika. Osim toga, oni koji su uzimali sodu imali su manju vjerojatnost da će razviti završnu bubrežnu bolest, koja zahtijeva dijalizu. Važno je napomenuti da povećanje sadržaja natrijevog bikarbonata u tijelu nije uzrokovalo povećanje krvnog tlaka kod pacijenata.
Soda je jeftin i učinkovit lijek za kroničnu bubrežnu bolest. Međutim, znanstvenici upozoravaju: uzimanje sode treba biti pod nadzorom liječnika, koji mora ispravno izračunati dozu za pacijenta.
Ljekovita svojstva sode bikarbone
Ranije je natrijev bikarbonat bio vrlo široko korišten (kao i druge lužine) kao antacid za povećanu kiselost želučanog soka, želučani ulkus i čir na dvanaesniku. Kada se uzima oralno, soda bikarbona brzo neutralizira klorovodičnu kiselinu želučanog soka i ima izražen antacidni učinak. Međutim, korištenje sode nije samo sjajno oprano posuđe i uklanjanje žgaravice. Soda bikarbona zauzima dostojno mjesto u kućnoj kutiji prve pomoći.
Poput starih Egipćana, koji su isparavanjem dobivali prirodnu sodu iz jezerske vode, ljudi su koristili i druga svojstva sode. Ima neutralizirajuće kvalitete, koristi se u medicinskoj praksi za liječenje gastritisa s visokom kiselošću. Može ubiti klice, koristi se kao dezinficijens: soda se koristi za inhalaciju, ispiranje, čišćenje kože.
Soda se također široko koristi u zdravstvu.
Prevencija karijesa.
Kiseline nastale u ustima kao rezultat vitalne aktivnosti bakterija uništavaju caklinu zuba. Ove kiseline možete neutralizirati ispiranjem usta otopinom sode bikarbone nekoliko puta dnevno. Možete i drugačije: navlažite četkicu za zube vodom, umočite je u sodu bikarbonu i operite zube. Soda, osim toga, ima blagi abrazivni učinak: polirat će zube bez oštećenja cakline.
Za loš miris stopala.
Soda bikarbona dodana u vodu za kupanje stopala neutralizira kiseline koje proizvode bakterije, a koje stopalima daju neugodan miris. Soda bikarbona također će pomoći u uklanjanju jakog mirisa znoja ispod pazuha.
Za ugrize insekata.
Nemojte češljati ubode komaraca i drugih krvopija dok ne iskrvare. Bolje je pripremiti mješavinu vode i sode poput kaše i nanijeti na mjesto ugriza. Soda kaša također će ublažiti svrbež uzrokovanu vodenim kozicama ili dodirom kože s kravljim pastrnjakom, koprivom.
S pelenskim osipom.
Losioni sode značajno poboljšavaju stanje beba s pelenskim osipom. Umanjuju svrbež i ubrzavaju zacjeljivanje kože.
S cistitisom.
Patogene bakterije žive u mjehuru u blago kiselom okruženju. Ako je vaš mjehur postao žrtva infekcije, savršeno popodnevno piće za vas je gazirani koktel od sode bikarbone i vode.
Za opekline od sunca.
Dodajte malo sode bikarbone u toplu kupku kako biste omekšali vodu, pretvarajući je u umirujući losion za nadraženu kožu.
Od upale grla.
Promiješajte 0,5 žličice. žlice sode u čaši vode i svaka 4 sata ispirati grlo pripremljenom otopinom: neutralizira kiseline koje uzrokuju bol. Ispiranje ovom otopinom usta pomoći će ublažiti upalu usne sluznice.
Od lošeg zadaha.
U kombinaciji s vodikovim peroksidom, soda bikarbona ima snažan oksidacijski učinak i uništava bakterije koje uzrokuju loš zadah. Dodajte 1 tablicu. žlicu sode u čaši otopine vodikovog peroksida (2-3%) i isperite usta.
S prehladom.
Korisno je napraviti inhalaciju. Da biste to učinili, možete uzeti mali čajnik, kuhati u njemu 1 čašu vode s 1 žličicom. žlica sode. Od tvrdog papira napravite cijev, stavite je na izljev kotla i udišite paru 10-15 minuta. Ova inhalacija je vrlo korisna za odvajanje sputuma.
Za iskašljavanje viskoznog sputuma 2 puta dnevno piti natašte 1/2 šalice tople vode u kojoj je otopljeno 0,5 žličice. žlice sode i prstohvat soli.
Uz česte migrene.
Svaki dan uzimajte otopinu prokuhane vode sa sodom bikarbonom. 1. dan, 30 minuta prije ručka, popijte 1 čašu otopine (0,5 žličice sode + voda), 2. dan - 2 čaše itd., dovodeći do 7 čaša. Zatim smanjite dozu obrnutim redoslijedom.
Ostalo.
Za rinitis, stomatitis, laringitis, konjunktivitis koristi se 0,5-2% otopina sode.
Za dezinfekciju usne sluznice, korisno je isprati usta slabom otopinom (soda - 85 g, sol - 85 g, urea - 2,5 g) nakon jela.
Lijek za pušenje: isperite usta otopinom sode bikarbone (1 žlica na 200 ml vode).
Kod suhe kože, suhog dermatitisa, ihtioze i psorijaze korisne su terapeutske kupke (soda - 35 g, magnezijev karbonat - 20 g, magnezijev perborat - 15 g). Temperatura vode ne smije biti viša od 38-39 ° C, prvo samo trebate sjediti u toploj kupki, a zatim postupno povećavati temperaturu. Trajanje kupke je 15 minuta.
Gašenje požara
Natrijev bikarbonat je dio praha koji se koristi u sustavima za gašenje požara prahom, koristeći toplinu i istiskujući kisik iz izvora izgaranja s emitiranim ugljičnim dioksidom.
Čišćenje opreme. Tehnologija abrazivnog pjeskarenja (ACO)
Oprema i površine čiste se od raznih premaza i onečišćenja tehnologijom abrazivnog pjeskarenja (ACO) opreme. Natrijev bikarbonat se koristi kao abraziv (soda bikarbona, natrijev bikarbonat, natrijev bikarbonat, NaHCO 3 , natrijev hidrogen karbonat).
ACO tehnologija koja koristi natrijev bikarbonat novi je učinkovit način čišćenja opreme pomoću "mekog" abraziva. Abraziv se pokreće komprimiranim zrakom koji proizvodi kompresor. Ova metoda je dobila komercijalno priznanje i naširoko se koristi u Europi i SAD-u već 25 godina zbog svoje svestranosti i ekonomske isplativosti.
Površinska obrada opreme slična je konvencionalnom pjeskarenju. Razlika je u tome što su čestice sode "meki" abrazivni materijal, odnosno ne oštećuju samu površinu.
Načelo:
Krhka čestica kiselog natrijevog karbonata eksplodira u dodiru s površinom koju treba očistiti.
Energija koju oslobađa ovaj bljesak uklanja prljavštinu s površine koja se čisti. Čestice abrazivne sode potpuno su razbijene u finu prašinu, koja se lako raspršuje u različitim smjerovima okomito na pad, povećavajući učinak čišćenja. U svrhu suzbijanja prašine, čišćenje opreme sodom pjeskarenjem obično se provodi ovlaživanjem, odnosno hidroabrazivnim pjeskarenjem (HASO) opreme. Natrijev karbonat se otapa u vodi. Stoga će se korišteni abraziv otopiti ili se može isprati nakon završetka čišćenja.
To se razlikuje od kvarcnog pijeska, koji odsiječe premaz. Kvarcni pijesak također istroši dio površine koja se čisti, koju soda ostavlja gotovo neozlijeđenom. Još uvijek postoje mnoge razlike između ovih vrsta opreme za čišćenje, ali one su već posljedica svojstava abraziva.
Topljivi abrazivi natrijevog bikarbonata posebno su formulirani za čišćenje opreme abrazivnim pjeskarenjem. Svojstva slobodnog protoka abraziva smanjuju gustoću protoka povezanu s slabom propusnošću konvencionalnog natrijevog karbonata.
Prepoznajemo važnost povjerljivosti informacija. Ovaj dokument opisuje koje osobne podatke primamo i prikupljamo kada koristite web stranicu edu.ogulov.com. Nadamo se da će vam ove informacije pomoći u donošenju informiranih odluka u vezi s osobnim podacima koje nam dajete.
Adresa e-pošte koju unesete prilikom ispunjavanja obrazaca na stranici ne prikazuje se drugim posjetiteljima stranice. Možemo zadržati e-poštu i drugu komunikaciju koju šalju korisnici kako bismo obradili korisnička pitanja, odgovorili na upite i poboljšali naše usluge.
Broj telefona
Telefonski broj koji unesete prilikom ispunjavanja obrazaca na stranici ne prikazuje se drugim posjetiteljima stranice. Telefonski broj naši menadžeri koriste samo za kontakt s vama.
Svrhe prikupljanja i obrade osobnih podataka korisnika
.Na našoj stranici posvećenoj Internet marketingu postoji mogućnost ispunjavanja obrazaca. Vaš dobrovoljni pristanak za primanje povratnih informacija od nas nakon podnošenja bilo kojeg obrasca na stranici potvrđuje se unosom vašeg imena, e-pošte i broja telefona u obrazac. Ime se koristi za osobni kontakt s vama, E-mail - za slanje pisama, telefonski broj naši menadžeri koriste samo za kontakt s vama. Korisnik svoje podatke daje dobrovoljno, nakon čega dobiva povratno pismo ili prima poziv od upravitelja tvrtke.
Uvjeti obrade i prijenos na treće strane
Vaše ime, e-mail i telefonski broj nikada, ni pod kojim okolnostima, neće biti preneseni trećim osobama, osim u slučajevima koji su povezani s provedbom zakona.
sječa drva
Svaki put kada posjetite stranicu, naši poslužitelji automatski bilježe informacije koje vaš preglednik prenosi kada posjetite web stranice. Obično te informacije uključuju traženu web-stranicu, IP adresu računala, vrstu preglednika, postavke jezika preglednika, datum i vrijeme zahtjeva te jedan ili više kolačića koji vam omogućuju da točno identificirate svoj preglednik.
Kolačići
Stranica edu.ogulov.com koristi kolačiće (Cookies), prikupljaju se podaci o posjetiteljima koji koriste usluge Yandex.Metrica. Ovi podaci se koriste za prikupljanje informacija o radnjama posjetitelja na stranici, za poboljšanje kvalitete njezinog sadržaja i značajki. U bilo kojem trenutku možete promijeniti postavke u postavkama svog preglednika tako da preglednik prestane pohranjivati sve kolačiće i obavijesti ih kada se pošalju. Imajte na umu da u tom slučaju neke usluge i funkcije mogu prestati raditi.
Promjena politike privatnosti
Na ovoj stranici moći ćete saznati o svim promjenama ove politike privatnosti. U posebnim slučajevima, informacije će biti poslane na Vašu e-mail. Sva pitanja možete postaviti na naš e-mail:
Natrijev karbonat Na 2 CO 3. soda pepela. Bijeli, zagrijavanjem se topi i raspada. Osjetljiv na vlagu i ugljični dioksid u zraku. Formira dekahidrat ( kristalna soda). Dobro se otopi u vodi, hidrolizira se na anionu, stvara jako alkalnu sredinu u otopini. Razgrađuju jake kiseline. Restaurirano koksom. Ulazi u reakcije ionske izmjene.
Kvalitativna reakcija na CO 3 2- ion - stvaranje bijelog taloga barijevog karbonata, razloženog jakim kiselinama (HCl, HNO 3) uz oslobađanje ugljičnog dioksida.
Koristi se za sintezu natrijevih spojeva, uklanjanje "trajne" tvrdoće slatke vode, u proizvodnji stakla, sapuna i drugih deterdženata, celuloze, mineralnih boja i emajla. U prirodi se nalazi u mljevenim salamuri, salamuri slanih jezera.
Jednadžbe najvažnijih reakcija:

Priznanica u industrija (solva način, 1861–1863):
a) smjesa NH 3 i CO 2 propušta se kroz zasićenu otopinu NaCl:
NaCl + NH 3 + H 2 O + CO 2 = NH 4 Cl + NaHCO 3 ↓
(pod ovim uvjetima, soda bikarbona je slabo topiva);
b) Talog NaHCO 3 se dehidrira ( kalcinacija):
2NaHCO3 = Na2CO3+ H 2 O + CO 2
Kalijev karbonat K 2 CO 3. Oksosol. tehnički naziv potaša. Bijela, higroskopna. Topi se bez raspadanja, razgrađuje se daljnjim zagrijavanjem. Osjetljiv na vlagu i ugljični dioksid u zraku. Vrlo dobro se otopi u vodi, hidrolizira se na anionu, stvara jako alkalnu sredinu u otopini. Razgrađuju jake kiseline. Ulazi u reakcije ionske izmjene.
Koristi se u proizvodnji optičkog stakla, tekućeg sapuna, mineralnih boja, mnogih spojeva kalija, kao sredstvo za dehidrataciju.
Jednadžbe najvažnijih reakcija:

Priznanica u industrija :
a) zagrijavanje kalijevog sulfata [prirodne sirovine - minerali kainit KMg(SO4)Cl3H2O i shönite K 2 Mg (SO 4) 2 6H 2 O] s gašenim vapnom Ca (OH) 2 u atmosferi CO (tlak = 15 atm):
K 2 SO 4 + Ca (OH) 2 + 2CO \u003d 2K (HCOO) + CaSO 4
b) kalcinacija kalijevog formata K(HCOO) na zraku:
2K(HCOO) + O 2 \u003d K 2 CO 3 + H 2 O + CO 2
Natrijev bikarbonat NaHCO3. Kisela oksosol. tehnički naziv soda za piće. Bijeli puder u prahu. Pri laganom zagrijavanju se raspada bez topljenja; kada je vlažan, počinje se raspadati na sobnoj temperaturi. Umjereno otopimo u vodi, hidrolizira se na anionu u maloj mjeri. Razgrađuju kiseline, neutraliziraju lužine. Ulazi u reakcije ionske izmjene.
Kvalitativna reakcija na HCod ion - stvaranje bijelog taloga barijevog karbonata pod djelovanjem baritne vode i razgradnja taloga jakim kiselinama (HCl, HNO 3) uz oslobađanje ugljičnog dioksida. Koristi se u prehrambenoj industriji kao lijek.
Jednadžbe najvažnijih reakcija:

Priznanica: zasićenje otopine Na 2 CO 3 (vidi) ugljičnim dioksidom.
Kalcijev karbonat CaCO3. Oksosol. Uobičajena prirodna tvar, glavna komponenta sedimentne stijene je vapnenac (njegove sorte su kreda, mramor, vapnenački tuf, lapor), čisti CaCO 3 u prirodi je mineral kalcit. Bijela, pri paljenju se raspada, topi se pod suvišnim tlakom CO 2 . Netopljiv u vodi (= 0,0007 g/100 g H2O).
Reagira s kiselinama, amonijevim solima u vrućoj otopini, koksom. U otopinu se prenosi djelovanjem viška ugljičnog dioksida uz stvaranje bikarbonata Ca (HCO 3) 2 (postoji samo u otopini), koji određuje "privremenu" tvrdoću slatke vode (zajedno s magnezijevim i željeznim solima). Uklanjanje tvrdoće (omekšavanje vode) provodi se kuhanjem ili neutralizacijom gašenim vapnom.
Koristi se za proizvodnju CaO, CO 2, cementa, stakla i mineralnih gnojiva [uključujući vapnenog nitrata Ca (NO 3) 2 4H 2 O], kao punilo papira i gume, građevinski kamen (drobljeni kamen) i sastavni dio betona i škriljevca, u obliku istaloženog praha - za izradu školskih bojica, praha za zube i paste, smjese za izbjeljivanje prostorija.
Jednadžbe najvažnijih reakcija:

Zrak, filtrirana tekućina i voda za pranje iz unutrašnjosti bubnja 7 idu u separator 11, gdje se zrak odvaja od tekuće faze i odlazi u PVFL.
Filtrat iz separatora 11 ide kroz barometarsku cijev 12 u sakupljanje filtarske tekućine 13, odakle se pumpom 14 ispumpava radi destilacije.
Kada se bubanj okreće, sloj natrijevog bikarbonata koji prianja na površinu filtera pada ispod valjka za cijeđenje 6 kako bi se uklonile pukotine nastale na površini sedimenta, kroz koje zrak i voda za pranje mogu ući u bubanj. Nakon valjaka za cijeđenje, talog se ispire slabom tekućinom ili vodom koja dolazi iz tlačnog spremnika 4 za vodu za pranje u korito 3, čime se voda ravnomjerno raspoređuje po širini bubnja. Količina vode koja se dovodi za pranje regulira se slavinom koja je postavljena između tlačnog spremnika 4 i korita 3. Voda za pranje se miješa s tekućinom filtera unutar bubnja i s njom ide u separator 11.
Isprani natrijev bikarbonat ponovno se sabija drugim valjkom za stiskanje 6 u smjeru rotacije bubnja, suši se zrakom usisanim kroz sloj sedimenta, dovodi kroz cjevovod 5 i nožem 8 odsiječe od filtarske tkanine do transporter 10, koji opskrbljuje sirovi natrijev bikarbonat u pećnicu s sodom.
Kalcinacija natrijevog bikarbonata
Kalcinacija - termička razgradnja natrijevog bikarbonata - završna je faza u proizvodnji sode pepela. Glavna svrha odjela za kalcinaciju je dobivanje određene količine sode pepela u obliku kontinuiranog protoka materijala.
Tehnički natrijev bikarbonat trebao bi biti bijeli. Pojava boje ukazuje na koroziju čeličnih posuda u dijelovima apsorpcije i karbonizacije. Talog je obojen željeznim oksidom koji u njega ulazi kao posljedica korozije.
Proces kalcinacije može se prikazati jednadžbom:
2 NaHCO3 (kruta) \u003d Na2CO3 (kruta) + CO2 (plin) + H2O (para).
Osim ove glavne reakcije, kada se tehnički bikarbonat zagrijava, mogu se javiti dodatne reakcije:
(NH4)2CO3↔2NH3(plin)+CO2(plin)+H2O(para),
NH4 HCO3↔2NH3(plin)+CO2(plin)+H2O(para).
Amonijev klorid reagira kada se zagrijava s natrijevim bikarbonatom u skladu s reakcijom
NH4Cl (sol.) + NaHCO3 (krutina) ↔NaCl (kruta) + NH3 (plin) + CO2 (plin) + H2O.
Natrijev karbamat u prisutnosti vode, kada se zagrije, prema reakciji prelazi u sodu
2NaCO2NH2 + H2O ↔ Na2CO3 (kruta) + CO2 (plin) + 2NH3 (plin).
Tako, kao rezultat kalcinacije, Na2CO3 i NaCl ostaju u čvrstoj fazi, dok NH3, CO2 i H2O prelaze u plinovitu fazu.
Prisutnost vlage u bikarbonatu otežava instrumentaciju, budući da mokri natrijev bikarbonat slabo teče, zgruda se i lijepi za stijenke aparata. Potonje se objašnjava činjenicom da vlaga, koja je zasićena otopina NaHCO3, brzo isparava nakon dodira s vrućom površinom. Taložena čvrsta faza, kristalizirajući, tvori koru koja čvrsto prianja uz površinu.
Čvrsti sloj sode, koji ima nisku toplinsku vodljivost, otežava prijenos topline, a u soda pećima koje se zagrijavaju izvana dimnim plinovima dovodi do pregrijavanja i izgaranja stijenke peći. Za suzbijanje ove pojave, mokri natrijev bikarbonat se miješa s vrućom sodom (retur). U tom slučaju nastaje nova čvrsta faza – trona (NaHCO3 Na2CO3 2 H2O). Slobodna vlaga se veže na kristalizaciju, a proizvod postaje slobodno tekući.
Tijekom kalcinacije natrijevog bikarbonata i trona, CO2, NH3 i vodena para se oslobađaju u plinovitu fazu. Amonijak i ugljični dioksid treba vratiti u proizvodnju. Ugljični dioksid se koristi u procesu karbonizacije amonizirane slane vode, za koju je korisno imati plin s visokim udjelom CO2.
Proces kristalizacije može se podijeliti u tri vremenska razdoblja. Prvo razdoblje karakterizira brz porast temperature. Razgradnja bikarbonata se ne opaža, a sva toplina se troši na zagrijavanje materijala, odstranjivanje kristalizacijske vode iz trona i razgradnju ugljikovih amonijevih soli. Drugi period karakterizira konstantnost temperature materijala (t~125°C). Dovedena toplina troši se na toplinsku razgradnju NaHCO3. treće razdoblje, temperatura reakcijske mase počinje naglo rasti. To ukazuje da je proces razgradnje bikarbonata završio i dovedena toplina se troši na zagrijavanje nastale sode. U praksi, kako bi se ubrzao proces razgradnje NaHCO3, temperatura sode na izlazu iz peći održava se unutar 140-160°C.
Tehnološka shema procesa kalcinacije
Riža. 11. Shema odvajanja kalcinacije:
1- kondenzator pare; 2- mješalica za hranu; 3.15 - hranilice stanica; 4.10 - trakasti transporteri; 5 - vibrirajuća hranilica; 6-padobran-bunker; 7-ejektor pluga; 8,9,14,16 transportera; 11-ciklon; 12-kolektor plina za kalcinaciju; 13-separator;17-kolektor kondenzata; 18 centrifugalnih pumpi; 19-sakupljač slabe tekućine; 20-kalcinacijski plinski hladnjak;21-redukciona rashladna jedinica (ROU); 22-kalcinacijski plin za pranje; 23-sakupljač tekućine za pranje.
Vlažni natrijev bikarbonat ispran na filterima iz zajedničkog trakastog transportera 10 s plužnim izbacivačem 7 dovodi se u lijevak 6 vibrirajućeg dodavača 5, odakle se vibrirajućim dozatorom 2 dovodi u mješalicu i trakastim transporterom 4 kroz hranilica ćelija 3. u ciklonu 11.
Prijestolje pripremljeno u mješalici šalje se u prstenasti prostor bubnja kalcinatora 1. Kao rezultat toplinske obrade, prijestolja primaju soda pepela i plinove kalcinacije. Kalcinirana soda se kroz dozator ćelija 15 uklanja iz kalcinatora i ulazi u sustav transportera 8, 9, 16. Soda se iz kosog transportera 8 uzima kroz dovod u mješalicu. Ostatak transportera sode 9, 14 se dovodi u skladište.
Kalcinacijski plinovi se uklanjaju iz kalcinatora kroz miješalicu 2, u kojoj se pomoću kompresora stvara vakuum. Na putu do kompresora plinovi se podvrgavaju kemijskom čišćenju u ciklonima 11 i mokrom čišćenju u radničkom kolektoru kalcinacijskog plina 12 i peraču 22. Prije pranja plinovi kalcinacije se hlade u hladnjaku 20.
Za navodnjavanje se takozvana slaba tekućina dovodi u kolektor kalcinacijskog plina, koji nastaje tijekom kondenzacije vodene pare u hladnjaku kalcinacijskog plina. Ova tekućina, u dodiru s plinom, djelomično upija amonijak i prašinu sode, a zatim se odvodi u zbirku 19.
U hladnjaku 20 plin prolazi odozgo prema dolje kroz prstenasti prostor, a rashladna voda se kreće u protustruji u cijevima. Kako bi se spriječila kristalizacija cijevi hladnjaka i kako bi se plin bolje isprao od prašine sode, prstenasti prostor se navodnjava slabom tekućinom. U perilici se plin navodnjava vodom, dok se dodatno hladi i potpuno ispere od sode i amonijaka.
Para visokog tlaka dovodi se za zagrijavanje kalcinatora. Prije nego što se unese u kalciner, prolazi kroz redukcijsku rashladnu jedinicu (ROU), gdje se njegova temperatura snižava na 270°C, a tlak na 3 MPa. U cijevima kalcinatora para se kondenzira, odajući toplinu kalciniranom materijalu. Kondenzat iz kalcinatora se ispušta u kolektor kondenzata 17 i dalje u ekspandere, gdje se pretvara u paru niskog tlaka.
Soda bikarbona ili soda za piće je spoj nadaleko poznat u medicini, kuhanju i potrošnji u kućanstvu. Ovo je kisela sol, čiju molekulu tvore pozitivno nabijeni ioni natrija i vodika, anion kiselinskog ostatka ugljične kiseline. Kemijski naziv za sodu je natrijev bikarbonat ili natrijev bikarbonat. Formula spoja prema Hill sustavu: CHNaO 3 (opća formula).
Razlika između kisele soli i srednje
Ugljična kiselina tvori dvije skupine soli – karbonate (srednje) i bikarbonate (kiseline). Trivijalni naziv karbonata - soda - pojavio se u antici. Potrebno je razlikovati prosječne i kisele soli po nazivima, formulama i svojstvima.
Na 2 CO 3 - natrijev karbonat, dinatrijeva sol ugljične kiseline, soda za pranje. Služi kao sirovina za proizvodnju stakla, papira, sapuna, a koristi se i kao deterdžent.
NaHCO 3 - natrijev bikarbonat. Sastav sugerira da je tvar mononatrijeva sol ugljične kiseline. Ovaj spoj se razlikuje po prisutnosti dva različita pozitivna iona - Na + i H +. Izvana su kristalne bijele tvari slične, teško ih je razlikovati jedna od druge.
Supstanca NaHCO 3 se smatra sodom za piće, a ne zato što se unosi za utaživanje žeđi. Iako uz pomoć ove tvari možete napraviti gazirano piće. Otopina ovog bikarbonata uzima se oralno s povećanom kiselošću želučanog soka. U tom slučaju neutralizira se višak H + protona koji nadražuju zidove želuca, uzrokuju bol i peckanje.
Fizička svojstva sode bikarbone
Bikarbonat je bijeli monoklinski kristal. Ovaj spoj sadrži atome natrija (Na), vodika (H), ugljika (C) i kisika. Gustoća tvari je 2,16 g/cm3. Temperatura topljenja - 50-60 ° C. Natrijev bikarbonat je mliječnobijeli prah, čvrsti finokristalinični spoj, topiv u vodi. Soda bikarbona ne gori, a zagrijavanjem iznad 70°C razlaže se na natrijev karbonat, ugljični dioksid i vodu. U proizvodnim uvjetima češće se koristi granulirani bikarbonat.

Sigurnost sode bikarbone za ljude
Smjesa nema miris, okus mu je gorko-slan. Međutim, ne preporuča se njuškati i kušati tvar. Udisanje natrijevog bikarbonata može uzrokovati kihanje i kašalj. Jedna upotreba se oslanja na sposobnost sode bikarbone da neutralizira neugodne tvari. Puder se može nanijeti na sportsku obuću kako biste se riješili neugodnog mirisa.
Soda bikarbona (natrijev bikarbonat) je bezopasna u dodiru s kožom, ali u čvrstom obliku može nadražiti sluznicu očiju i jednjaka. U niskim koncentracijama, otopina je netoksična, može se uzimati oralno.
Natrijev bikarbonat: formula spoja
Empirijska formula CHNaO 3 rijetko se nalazi u jednadžbama kemijskih reakcija. Činjenica je da ne odražava odnos između čestica koje tvore natrijev bikarbonat. Formula koja se obično koristi za karakterizaciju fizikalnih i kemijskih svojstava tvari je NaHCO 3 . Međusobni raspored atoma reflektuje se modelom molekule sa sfernim štapićem:

Ako iz periodnog sustava saznate vrijednosti atomskih masa natrija, kisika, ugljika i vodika. tada možete izračunati molarnu masu tvari natrijevog bikarbonata (formula NaHCO 3):
Ar(Na) - 23;
Ar(O) - 16;
Ar(C) - 12;
Ar(H)-1;
M (CHNaO 3) \u003d 84 g / mol.
Struktura materije
Natrijev bikarbonat je ionski spoj. Sastav kristalne rešetke uključuje natrijev kation Na +, koji zamjenjuje jedan atom vodika u ugljičnoj kiselini. Sastav i naboj aniona - HCO 3 -. Otapanjem dolazi do djelomične disocijacije na ione koji tvore natrijev bikarbonat. Strukturna formula izgleda ovako:

Topljivost sode bikarbone u vodi
7,8 g natrijevog bikarbonata otapa se u 100 g vode. Tvar se podvrgava hidrolizi:
NaHCO 3 \u003d Na + + HCO 3 -;
H 2 O ↔ H + + OH -;
Prilikom zbrajanja jednadžbi ispada da se hidroksidni ioni nakupljaju u otopini (slabo alkalna reakcija). Tekućina postaje fenolftalein ružičasta. Boja univerzalnih indikatora u obliku papirnatih traka u otopini sode mijenja se od žuto-narančaste do sive ili plave.
Reakcija izmjene s drugim solima
Vodena otopina natrijevog bikarbonata ulazi u reakcije ionske izmjene s drugim solima, pod uvjetom da je jedna od novodobivenih tvari netopiva; ili nastaje plin, koji se uklanja iz reakcijske sfere. Prilikom interakcije s kalcijevim kloridom, kao što je prikazano na donjem dijagramu, dobivaju se i bijeli talog kalcijevog sarbonata i ugljični dioksid. Ioni natrija i klorida ostaju u otopini. Jednadžba molekularne reakcije:

Interakcija sode za piće s kiselinama
Natrijev bikarbonat stupa u interakciju s kiselinama. Reakcija ionske izmjene je popraćena stvaranjem soli i slabe ugljične kiseline. U trenutku primitka se razgrađuje na vodu i ugljični dioksid (ispariva).
Stijenke ljudskog želuca proizvode klorovodičnu kiselinu, koja postoji u obliku iona.
H + i Cl - . Ako se natrijev bikarbonat uzima oralno, javljaju se reakcije u otopini želučanog soka uz sudjelovanje iona:
NaHCO 3 \u003d Na + + HCO 3 -;
HCl \u003d H + + Cl -;
H 2 O ↔ H + + OH -;
HCO 3 - + H + \u003d H 2 O + CO 2.
Liječnici ne preporučuju stalnu upotrebu natrijevog bikarbonata za povećanu kiselost želuca. Upute za pripravke navode različite nuspojave svakodnevne i dugotrajne upotrebe sode za piće:
- povišen krvni tlak;
- podrigivanje, mučnina i povraćanje;
- anksioznost, loš san;
- gubitak apetita;
- bol u trbuhu.

Dobivanje sode bikarbone
U laboratoriju se natrijev bikarbonat može dobiti iz sode pepela. Ista metoda korištena je ranije u kemijskoj proizvodnji. Suvremena industrijska metoda temelji se na interakciji amonijaka s ugljičnim dioksidom i niskoj topljivosti sode bikarbone u hladnoj vodi. Amonijak i ugljični dioksid (ugljični dioksid) prolaze kroz otopinu natrijevog klorida. Nastaju amonijev klorid i otopina natrijevog bikarbonata. Prilikom hlađenja, topljivost sode bikarbone se smanjuje, tada se tvar lako odvaja filtriranjem.
Gdje se koristi natrijev bikarbonat? Upotreba sode bikarbone u medicini
Mnogi ljudi znaju da atomi metalnog natrija snažno djeluju s vodom, čak i s njezinom parom u zraku. Reakcija počinje aktivno i popraćena je oslobađanjem velike količine topline (izgaranje). Za razliku od atoma, natrijevi ioni su stabilne čestice koje ne štete živom organizmu. Naprotiv, oni aktivno sudjeluju u regulaciji njegovih funkcija.
Kako se koristi tvar koja je netoksična za ljude i korisna u mnogim aspektima – natrijev bikarbonat? Primjena se temelji na fizikalnim i kemijskim svojstvima sode bikarbone. Najvažnija područja su potrošnja kućanstava, prehrambena industrija, zdravstvo, tradicionalna medicina i pića.
Među glavnim svojstvima natrijevog bikarbonata su neutralizacija povećane kiselosti želučanog soka, kratkotrajno otklanjanje boli kod hiperacidnosti želučanog soka, čira na želucu i dvanaesniku. Antiseptički učinak otopine sode bikarbone koristi se u liječenju upale grla, kašlja, intoksikacije, bolesti kretanja. Operite ih ustima i nosom, sluznicom očiju.

Široko se koriste različiti oblici doziranja natrijevog bikarbonata, kao što su prašci, koji se otapaju i koriste za infuziju. Dodijelite otopine za oralnu primjenu od strane pacijenata, operite opekline kiselinama. Natrijev bikarbonat se također koristi za izradu tableta i rektalnih čepića. Upute za pripravke sadrže detaljan opis farmakološkog djelovanja, indikacije. Popis kontraindikacija je vrlo kratak - individualna netolerancija na tvar.
Korištenje sode bikarbone kod kuće
Natrijev bikarbonat je "hitna pomoć" za žgaravicu i trovanja. Uz pomoć sode za piće kod kuće, izbijelite zube, smanjite upalu kod akni, obrišite kožu kako biste uklonili višak masnih sekreta. Natrijev bikarbonat omekšava vodu, pomaže u čišćenju prljavštine s raznih površina.
Prilikom ručnog pranja vunene pletenine u vodu možete dodati sodu bikarbonu. Ova tvar osvježava boju tkanine i uklanja miris znoja. Često se prilikom glačanja svilenih proizvoda pojavljuju žuti tragovi opeklina od željeza. U ovom slučaju pomoći će vam kaša od sode bikarbone i vode. Tvari treba pomiješati što je prije moguće i nanijeti na mrlju. Kada se kaša osuši, treba je četkati i isprati proizvod hladnom vodom.
U reakciji s octenom kiselinom dobiva se natrijev acetat i brzo se oslobađa ugljični dioksid koji pjeni cijelu masu: NaHCO 3 + CH 3 COOH = Na + + CH 3 COO - + H 2 O + CO 2. Taj se proces događa kad god se u proizvodnji gaziranih pića i slastica soda bikarbona "gasi" octom.

Okus pečenja bit će nježniji ako koristite ne sintetički ocat iz trgovine, već limunov sok. U ekstremnim slučajevima možete ga zamijeniti mješavinom od 1/2 žličice. limunska kiselina u prahu i 1 žlica. l. voda. U tijesto se među zadnjim sastojcima dodaje soda bikarbona s kiselinom kako bi peciva odmah mogli staviti u pećnicu. Osim natrijevog bikarbonata, amonijev bikarbonat se ponekad koristi kao sredstvo za dizanje.