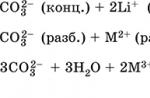Metoda se temelji na određivanju vinskocrvene boje karakteristične za komplekse formirane ionima željeza i rodanida. Ovi kompleksi su nestabilni, stoga je potreban veliki višak iona rodanida da bi se potisnula disocijacija kompleksa. Proces interakcije iona željeza s ionima rodanida odvija se prema jednadžbi (1):
|
Fe 3+ + 6 NH 4 CNS \u003d 6NH 4 + + 3- |
Mora se uzeti u obzir da, osim 3-, mogu nastati i drugi, manje intenzivno obojeni kompleksi, pa bi koncentracija amonijevog tiocijanata trebala biti ista u analiziranoj i standardnoj otopini. Jaka oksidacijska sredstva (kalijev permanganat, amonijev persulfat, vodikov peroksid itd.), koja oksidiraju rodanid anion, kao i tvari koje reduciraju željezo (III) u željezo (II), ometaju određivanje. Najbolji medij je dušična kiselina, dok je ionako niska kiselost otopine dovoljna da spriječi hidrolizu željezne soli (1-2 ml koncentrirane dušične kiseline na 50 ml otopine).
Reagensi
Amonijev tiocijanat (NH4CNS), 10% otopina;
Dušična kiselina, koncentrirana;
Osnovno standardno rješenje. Za pripremu osnovne standardne otopine, 0,8634 g željezo-amonijeve stipse otopi se u malom volumenu destilirane vode. Ako se otopina ispostavi da je neprozirna, dodajte nekoliko kapi koncentrirane dušične kiseline i dovedite volumen na 1 litru. Otopina sadrži 0,1 mg željeza po 1 ml;
Radno standardno rješenje. Radna standardna otopina priprema se razrjeđivanjem osnovne standardne otopine 10 puta. Otopina sadrži 0,01 mg željeza na 1 ml.
Radni proces
U odmjerne tikve od 100 ml dodajte 1 i 5 ml radne standardne otopine, kao i 1; 2,5 i 5 ml glavne standardne otopine željeza i dovedite volumen do oznake s destiliranom vodom, dobivajući otopine s koncentracijom od 0,1; 0,5; 1,0; 2,5; i 5,0 µg/l, respektivno. Pripremljene otopine i 100 ml ispitnog uzorka izlije se u konične tikve od 150 ml, u svaku se doda 5 ml koncentrirane HNO 3 i 10 ml 10 % otopine NH 4 CNS. Otopine se dobro promiješaju i nakon 3 minute fotometriraju na valnoj duljini λ=450 nm, pomoću kiveta s debljinom optičkog sloja od 5 mm, u odnosu na destiliranu vodu, kojoj se dodaju isti reagensi. Masena koncentracija željeza nalazi se prema kalibriranom grafikonu. Izrađuje se kalibracijski grafikon, koji prikazuje masenu koncentraciju željeza u μg / dm 3 duž osi apscise, a odgovarajuću vrijednost optičke gustoće duž ordinatne osi.
Određivanje sadržaja kroma primjenom difenilkarbazida
Načelo metode
Metoda se temelji na interakciji kromata i bikromata u kiselom mediju s difenilkarbazidom da nastane crvenoljubičasto obojeni spoj, u kojem se krom nalazi u reduciranom obliku Cr(III), a difenilkarbazid se oksidira u difenilkarbazon. Granica detekcije je 0,02 mg/l. Raspon izmjerenih količina kroma u uzorku je od 1 µg do 50 µg.
Prilikom analize vode u jednom uzorku utvrđuje se samo Cr(vi), a u drugom se utvrđuje ukupni sadržaj Cr(iii) i Cr(vi), u kojima se Cr(III) oksidira u Cr(VI). . Amonijev persulfat se koristi kao oksidacijsko sredstvo. Proces oksidacije se odvija prema jednadžbi (2):
|
2Cr 3+ + 3S 2 O 8 2- + 7H 2 O Cr 2 O 7 2- + 6SO 4 2- + 14H + |
Razlika u rezultatima određuje sadržaj Cr 3+.
Reagensi
Bi-destilirana voda (koristi se za pripremu svih reagensa);
Sumporna kiselina, 1:1;
Fosforna kiselina koncentrirana;
Difenilkarbazid (C 13 H 14 ON 4), 0,5% otopina u acetonu (koristi se svježe pripremljena);
otopina natrijevog hidroksida, 10% i 25%;
Kalijev bikromat bazična standardna otopina K 2 Cr 2 O 7 . Osnovna standardna otopina priprema se otapanjem 2,8285 g reagensa, osušenog na 150°C, u bidestiliranoj vodi i dopunom do 1 L (1 ml otopine sadrži 1 mg Cr(VI);
Radna standardna otopina 1. Pripremite tako da se 5 ml osnovne standardne otopine razrijedi bidestiliranom vodom do 100 ml (1 ml dobivene otopine sadrži 50 µg Cr(VI));
Radna standardna otopina 2. Pripremite razrjeđivanjem 4 ml radne standardne otopine 1 do 100 ml bidestiliranom vodom (1 ml dobivene otopine sadrži 2 µg Cr(VI)).
Izrada kalibracijskog grafikona
U odmjernim tikvicama kapaciteta 100 ml uzeti 0; 0,5; 1,0; 2,0; 3,0; 5,0; 8,0; 10,0 ml radne standardne otopine 2, dovedite volumen otopina na 50-60 ml, prilagodite pH na 8 alkalnom otopinom, kontrolirajući univerzalnim indikatorskim papirom. Ulijte 1 ml H 2 SO 4 (1:1) i 0,3 ml H 3 PO 4, dovedite volumen na 100 ml. Dobivene otopine imaju koncentraciju Cr(VI) 0; 10; dvadeset; 40; 60; jedna stotina; 160; 200 µg/l. U svaku tikvicu dodajte 2 ml 0,5% otopine difenilkarbazida i dobro promiješajte. Dobivene otopine nakon 10-15 minuta. fotometrija na valnoj duljini λ=540 nm, pomoću kiveta s debljinom optičkog sloja od 30 mm, u odnosu na destiliranu vodu, kojoj se dodaju isti reagensi.
Definicija sadržajaKr(VI)
U odmjernu tikvicu volumena 100 ml stavlja se takav volumen uzorka da sadrži od 0,005 do 0,1 mg kroma, pH se podešava na 8 otopinom kiseline ili lužine, kontrolira univerzalnim indikatorskim papirom. Ulijte 1 ml H 2 SO 4 (1:1) i 0,3 ml H 3 RO 4 , dovedite volumen na 100 ml i promiješajte. U svaku tikvicu dodati 2 ml 0,5% otopine difenilkarbazida i ponovno promiješati. Dobivene otopine nakon 10-15 minuta. fotometrija kao gore.
a) Reakcija s kalijevim heksacijanoferatom (II) - kalij ferocijanidom K 4 (farmakopeja). Fe 3+ kationi u kiselom mediju reagiraju s kalijevim ferocijanidom i formiraju tamnoplavi talog "pruskog plavog" - složenog spoja heksacijanoferata (II) željeza (III) Fe 4 3 x H 2 O s promjenjivim brojem molekula vode. Pokazano je da, ovisno o uvjetima taloženja, talog Prussian Blue, kao i Turnbull plavi precipitat (vidi gore), uvlači druge katione iz otopine, tako da se njegov sastav mijenja i može odgovarati formuli KFe 3+:
Fe 3+ + K + + 4- →FeK↓
Reakcija je specifična. Reakciju ometaju oksidirajuća sredstva koja oksidiraju reagens.
Izvođenje reakcije. U epruvetu se doda 2-3 kapi otopine soli željeza (III), doda se 1-2 kapi otopine HCI i 2 kapi otopine K 4. Otopina postaje plava i taloži se tamnoplavi talog "Prussian Blue".
b) Reakcija s tiocijanatnim ionima (farmakopeja). Soli Fe 3+ tvore crveni željezov (III) tiocijanat. Reakcija se provodi u kiselom mediju. Sastav nastalog kompleksa nije konstantan i može varirati od 2+ do 3- ovisno o koncentraciji Fe 3+ i SCN - iona. Ova se reakcija ponekad koristi za otkrivanje željeza u kombinaciji s reakcijom 1, s kalijevim heksacijanoferatom (II). Najprije se dodatkom NH 4 SCN dobije crveni kompleks željezovog tiocijanata, koji se zatim prenese dodavanjem kalijevog heksacijanoferata (II) u plavi talog željeza (III) heksacijanoferata (II) kalija:
Fe 3+ + 3SCN - →Fe(SCN) 3
Osjetljivost reakcije je 0,25 µg. Reakciju ometaju anioni kisikovih kiselina (fosforne, arsenske i dr.), fluoridi, koji tvore spojeve s Fe 3+ i NO 2, dajući SCN - crveni NOSCN spoj.
Izvođenje reakcije. U epruvetu se doda 3-4 kapi otopine soli željeza (III) i doda se 2-3 kapi otopine amonijevog tiocijanata NH4NCS ili kalij KNCS. Otopina postaje plava.
c) Reakcija s natrijevim sulfidom (farmakopeja). Natrijev sulfid precipitira iz neutralnih i slabo alkalnih otopina soli željeza (III) u crni talog Fe 2 S 3:
2Fe 3+ + 3S 2- → Fe 2 S 3 ↓
Talog Fe 2 S 3 topiv je u mineralnim kiselinama.
Izvođenje reakcije. U epruvetu se doda 3-4 kapi otopine soli željeza (III) i doda se 2-3 kapi otopine amonijevog sulfida ili sumporovodikove vode. Oslobađa se crni talog željezovog(III) sulfida.
d) Reakcija s hidroksidima. Precipitat željezovog hidroksida (III) Fe (OH) 3, koji nastaje međudjelovanjem Fe 3+ s hidroksidnim ionima, netopiv je u alkalnim otopinama i stoga prema kiselinsko-baznoj klasifikaciji Fe 3+ pripada skupini kationi čiji su hidroksidi netopivi u lužinama. Talog Fe(OH) 3 topiv je u razrijeđenim kiselinama; nećemo otopiti u zasićenoj otopini amonijevog klorida (za razliku od bijelog taloga Fe (OH) 2).
Izvođenje reakcije. U epruvetu se doda 3-4 kapi otopine soli željeza (III) i doda se 3-4 kapi NaOH. Ispada crvenosmeđi talog željezovog hidroksida (III) Fe (OH) 3.
e) Reakcija sa sulfosalicilnom kiselinom (farmakopeja). Kation Fe 3+ reagira u vodenim otopinama sa sulfosalicilnom kiselinom pri pH ≈ 9-11,5 s stvaranjem žutih kompleksa: Fe 3+ + L 2- → 3- ,
gdje je L 2- oznaka sulfosalicilatnog aniona koji nastaje iz sulfosalicilne kiseline eliminacijom dvaju protona, vjerojatno iz skupina
–COOH i –SO3H.
Najstabilniji kompleks je žuti, koji sadrži željezo (III) i anione sulfosalicilne kiseline u molarnom omjeru željezo (III): sulfosalicilatni anioni, jednakom 1:3, tj. Postoje tri sulfosalicilatna liganda po atomu željeza. Ovaj kompleks dominira u otopini amonijaka. Točna struktura kompleksa u otopini nije poznata. Osjetljivost reakcije je 5-10mkg.
Izvođenje reakcije. U epruvetu se doda ~5 kapi otopine soli željeza (III), ~10 kapi otopine sulfosalicilne kiseline i ~0,5 ml koncentrirane otopine amonijaka. Otopina poprima žutu boju.
Analitičke reakcije magnezijevih (II) kationa.
a) Reakcija s lužinama. Alkalne otopine odvajaju od otopina magnezijevih soli bijeli želatinozni talog magnezijevog hidroksida Mg (OH) 2, lako topiv u kiselinama i otopinama amonijevih soli:
Mg(OH) 2 ↓+ 2HCI→MgCI 2 + 2H 2 O
Mg(OH) 2 ↓+ 2NH 4 CI→ MgCI 2 + 2NH 4 OH
Izvođenje reakcije. U 1-2 kapi otopine koja sadrži magnezijeve ione dodajte 2-3 kapi 1M NaOH. Nastaje bijeli želatinozni talog. Dobiveni talog podijeli se u 2 epruvete. Dodajte 3-4 kapi HCl u 1. epruvetu, talog se otapa. U 2. epruvetu dodamo 3-4 kapi NH 4 Cl, talog se također otapa.
b) Reakcija s kalijevim hipojoditom. Kada jod stupi u interakciju s lužinom, nastaje kalijev hipojodit KIO; u ovom slučaju, ravnoteža u otopini se pomiče udesno i postaje bezbojna:
I 2 + 2OH - ↔I - + IO - + H 2 O
Kada se doda magnezijeva sol, ioni Mg 2+ tvore talog Mg (OH) 2 s OH ionima – talog Mg (OH) 2, koji uzrokuje pomak ravnoteže ulijevo. Jod koji se pri tome oslobodi adsorbira talog Mg (OH) 2 i oboji ga u crveno-smeđu boju.
Izvođenje reakcije. Lugolova otopina se obezboji dodavanjem kap po kap otopine KOH. Dobivenoj bezbojnoj otopini doda se otopina magnezijeve soli. Odmah se ističe amorfni talog, obojen crvenkastosmeđom bojom.
c) Reakcija s natrijevim hidrogenfosfatom (farmakopeja). Natrijev hidrogenfosfat stvara bijeli kristalni talog s magnezijevim ionima u prisutnosti NH 3 pri pH ~ 9:
Kod pH > 10 mogu nastati Mg(OH) 2 i Mg 3 (PO 4) 2. Preporuča se dodati NH 3 u kiselu analiziranu otopinu do pH ~9. Zbog stvaranja NH 4 C1 pH otopine se održava konstantnim. Talog je topiv u jakim kiselinama i u octenoj kiselini:
MgNH 4 PO 4 ↓+ 3HCI → H 3 PO 4 + MgCI 2 + NH 4 CI
MgNH 4 PO 4 ↓+ 2CH 3 COOH → Mg(CH 3 COO) 2 + NH 4 H 2 PO 4
Granica detekcije magnezija je 10 μg. Ometaju ione koji tvore teško topive fosfate; NH 4 + , K(I) i Na(I) ne interferiraju.
Izvođenje reakcije. U 1-2 kapi otopine koja sadrži magnezijeve ione dodati 2-3 kapi 2 M HCl, 1 kap otopine Na 2 HPO 4 i uz miješanje dodavati kap po kap 2 M NH 3 dok se ne pojavi miris amonijaka (pH ~ 9). Ispada bijeli kristalni talog.
d) Reakcija s 8-hidroksikinolinom (luminiscentna reakcija). 8-oksikinolin stvara s magnezijevim ionima pri pH 9 - 12 fluorescentno zeleno svjetlo oksikinolin:
Granica detekcije magnezija je 0,025 μg. Intenzitet sjaja se povećava kada se mokro mjesto tretira magnezijevim oksikinolinatom s otopinom NH 3 . Al(III), Zn(II) interferiraju.
Izvođenje reakcije. Kap otopine koja sadrži magnezijeve ione i kap otopine reagensa u etanolu nanese se na filter papir. Dobiveni magnezijev hidroksikinolinat tretira se s kapljicom 10% otopine amonijaka. Kada se promatra mokro mjesto u ultraljubičastom svjetlu, uočava se zeleni sjaj.
e) Reakcija s kinalizarinom (1,2,5,8-tetraoksiantrakinon)(I). Kvinalizarin (1,2,5,8-tetrahidroksiantrakinon)(I) s magnezijevim ionima tvori slabo topiv plavi spoj u alkalnoj otopini, kojem se pripisuje struktura (II):
 |
|||
 |
|||
Pretpostavlja se da je kinalizarinski lak adsorpcijski spoj magnezijevog hidroksida s reagensom. Vrlo je vjerojatno stvaranje kelata promjenjivog sastava.
Granica detekcije magnezija je 5 μg. Detekciju ne ometaju ioni zemnoalkalijskih metala; u prisutnosti dovoljno velike količine lužine, aluminijski ioni ne interferiraju.
Amonijev ion ometa detekciju magnezijevog iona jer sprječava stvaranje magnezijevog hidroksida. Otopina reagensa u alkalnom mediju obojena je ljubičastom bojom, pa je neophodan kontrolni pokus.
Izvođenje reakcije. U 1 - 2 kapi otopine koja sadrži ione magnezija dodajte 1 kap otopine kinalizarina i 2 kapi 30% otopine NaOH. Nastaje plavi talog. Za provedbu kontrolnog pokusa dodajte jednu kap otopine kinalizarina, 2 kapi 30% otopine NaOH u 1 - 2 kapi vode. Otopina postaje ljubičasta.
4. Testna kontrola 1
Kvalitativne reakcije na željezo (III)
Ioni željeza (III ) u otopini može se odrediti pomoću kvalitativnih reakcija. Idemo kroz neke od njih. Uzmite za pokus otopinu željeznog klorida ( III).
1. III) - reakcija s lužinom.
Ako otopina sadrži ione željeza ( III ), nastaje željezni hidroksid ( III ) Fe(OH) 3 . Baza je netopiva u vodi i smeđe je boje. (željezni hidroksid ( II ) Fe(OH) 2 . - također netopiv, ali sivo-zelene boje). Smeđi talog ukazuje na prisutnost iona željeza u početnoj otopini ( III).
FeCl 3 + 3 NaOH = Fe(OH) 3 ↓+ 3 NaCl
2. Kvalitativna reakcija na ion željeza ( III ) - reakcija sa žutom krvnom soli.
Žuta krvna sol je kalijev heksacijanoferatK 4 [ Fe( CN) 6]. (Za određivanje željeza (II) koristiti crvenu krvnu solK 3 [ Fe( CN) 6 ]). U dio otopine željeznog klorida dodajte otopinu žute krvne soli. Plavi precipitat pruske plave* ukazuje na prisutnost željeznih iona u početnoj otopini.
3 DO 4 +4 FeCl 3 = K Fe ) ↓ + 12 KCl
3. Kvalitativna reakcija na ion željeza ( III ) - reakcija s kalijevim tiocijanatom.
Prvo, razrijedimo testnu otopinu - inače nećemo vidjeti očekivanu boju. U prisutnosti iona željeza (III) kada se doda kalijev tiocijanat, nastaje crvena tvar. To je željezni tiocijanatIII). Rhodanide od grčkog "rodeos" - crveno.
FeCl 3 + 3 KCNS= Fe( CNS) 3 + 3 KCl
Prusku plavu je slučajno nabavio početkom 18. stoljeća u Berlinu farbar Diesbach. Disbach je kupio neobičnu potašu (kalijev karbonat) od trgovca: otopina te potaše postala je plava kada su joj dodane soli željeza. Prilikom provjere potaše pokazalo se da je kalcinirana goveđom krvlju. Ispostavilo se da je boja prikladna za tkanine: svijetla, stabilna i jeftina. Ubrzo je postao poznat recept za dobivanje boje: potaš je staljen sa osušenom životinjskom krvlju i željeznim strugotinama. Ispiranjem takve legure dobivala se žuta krvna sol. Sada se pruska plava koristi za dobivanje tiskarske tinte i polimera za boje. .
Oprema: tikvice, pipeta.
Sigurnost . Pridržavajte se pravila za rukovanje otopinama i otopinama lužina heksacijanoferati. Izbjegavati kontakt otopina heksacijanoferata s koncentriranim kiselinama.
Izjava o iskustvu – Elena Makhinenko, tekst– dr. sc. Pavel Bespalov.
Iz Wikipedije, slobodne enciklopedije
| Željezo(III) tiocijanat | |
| Općenito | |
|---|---|
| Sustavno Ime |
Željezo(III) tiocijanat |
| Tradicionalna imena | željezni tiocijanat; tiocijanat željezo |
| Chem. formula | Fe(SCN) 3 |
| Fizička svojstva | |
| država | crveni kristali zelenkaste nijanse |
| Molekulska masa | 230,09 g/ madež |
| Podaci su dati za standardni uvjeti (25 °C, 100 kPa), osim ako nije drugačije naznačeno. | |
Željezo(III) tiocijanat- anorganski spoj, metalna sol žlijezda I tiocijanska kiselina s formulom Fe(SCN) 3, otapa se u vodi, stvara kristalni hidrat- crveni kristali.
Priznanica
- reakcije razmjene:
- Neutralizacija otopine tiocijanska kiselina svježe posađeno željezov(III) hidroksid :
Fizička svojstva
Željezo(III) tiocijanat tvori Fe(SCN) 3 3H 2 O kristalni hidrat - paramagnetski Crvena higroskopna kristali topljivi u vodi etanol , emitirati, slabo topiv u ugljični disulfid , benzen , kloroform , toluen.
Vodene otopine sadrže Fe 6H 2 O dimere.
Kemijska svojstva
- Tvori koordinacijske spojeve s tiocijanatima drugih metala heksatiocijanatoferati (III), na primjer Li 3 n H2O, Na312H2O, K34H2O, Cs32H2O, (NH4)34H2O.
Napišite recenziju na članak "Željezo(III) tiocijanat"
Književnost
- Kemijska enciklopedija / Urednik: Knunyants I.L. i dr. - M.: Sovjetska enciklopedija, 1990. - T. 2. - 671 str. - ISBN 5-82270-035-5.
- Ripan R., Četjanu I. Anorganska kemija. Kemija metala. - M .: Mir, 1972. - T. 2. - 871 str.
| Ovaj članak članka oko anorganske tvari. Možete pomoći projektu dodavanjem. |
Izvod koji karakterizira željezov(III) tiocijanat
- U sljedeći život? - ponovio je princ Andrej, ali Pierre mu nije dao vremena da odgovori i uzeo je ovo ponavljanje za poricanje, pogotovo jer je poznavao nekadašnja ateistička uvjerenja princa Andreja.– Kažete da ne možete vidjeti carstvo dobrote i istine na zemlji. A ja ga nisam vidio, a ne možete ga vidjeti ako na naš život gledate kao na kraj svega. Na zemlji, upravo na ovoj zemlji (Pierre je pokazao na polje), nema istine - sve je laž i zlo; ali u svijetu, u cijelom svijetu, postoji kraljevstvo istine, a mi smo sada djeca zemlje, i zauvijek djeca cijelog svijeta. Ne osjećam li u duši da sam dio ove ogromne, skladne cjeline. Zar ne osjećam da sam u ovom ogromnom, bezbrojnom broju bića u kojima se očituje Božansko - najviša moć, kako hoćete - da sam jedna karika, jedan korak od nižih bića do viših. Ako vidim, jasno vidim ove ljestve koje vode od biljke do čovjeka, zašto bih onda mislio da su ove ljestve kod mene prekinute, a ne vode dalje i dalje. Osjećam da ne samo da ne mogu nestati, kao što ništa na svijetu ne nestaje, nego da ću uvijek biti i uvijek sam bio. Osjećam da osim mene duhovi žive iznad mene i da ima istine na ovom svijetu.
„Da, to je Herderovo učenje“, reče princ Andrej, „ali neće me to, dušo moja, uvjeriti, nego život i smrt, to je ono što uvjerava. To uvjerava da vidite drago stvorenje koje je povezano s vama, pred kojim ste bili krivi i nadali se da ćete se opravdati (princ Andrej je zadrhtao u glasu i okrenuo se) i odjednom to stvorenje pati, pati i prestaje biti . .. Zašto? Ne može biti da nema odgovora! I vjerujem da je... To je ono što uvjerava, to je ono što me uvjerilo - rekao je princ Andrej.
"Pa, da, da", rekao je Pierre, "nije li i ja to rekao!"
- Ne. Kažem samo da te ne uvjeravaju argumenti u potrebu budućeg života, nego kad hodaš u životu ruku pod ruku s osobom, i ta osoba odjednom nestane u nigdje, a ti sam zastaneš pred ovim ponorom i pogledaj u to. I pogledao sam...
- Pa, pa što! Znate li što je tamo i što je netko? Postoji budući život. Netko je Bog.
Princ Andrija nije odgovorio. Kočija i konji odavno su dovedeni na drugu stranu i već su bili položeni, a sunce je već napola nestalo, a večernji mraz zvijezdama je prekrio lokve kraj trajekta, a Pierre i Andrei, na iznenađenje lakeja, kočijaša i prevoznika, još su stajali na trajektu i razgovarali.
- Ako postoji Bog i postoji budući život, onda postoji istina, postoji vrlina; a najviša je sreća čovjeka nastojati ih postići. Moramo živjeti, moramo voljeti, moramo vjerovati, - rekao je Pierre, - da ne živimo sada samo na ovom komadu zemlje, nego smo živjeli i živjet ćemo zauvijek tamo u svemu (pokazao je na nebo). Princ Andrej je stajao naslonjen na ogradu trajekta i, slušajući Pierrea, ne skidajući pogled, gledao je crveni odsjaj sunca nad plavom poplavom. Pierre šuti. Bilo je potpuno tiho. Trajekt je davno pristao, a samo su valovi struje uz tihi zvuk udarali o dno trajekta. Princu Andreju se činilo da ovo ispiranje valova govori Pierreovim riječima: "Istina, vjeruj u ovo."
Princ Andrej je uzdahnuo i blistavim, djetinjastim, nježnim pogledom pogledao Pierreova zajapurenog, oduševljenog, ali još uvijek bojažljivog pred svojim nadređenim prijateljem.
“Da, kad bi to bio slučaj!” - On je rekao. "Ali, idemo sjesti", dodao je princ Andrej i napustivši trajekt pogledao u nebo, na koje mu je Pierre ukazao, i prvi put, nakon Austerlitza, ugledao ono visoko, vječno nebo, koje je vidio kako leži na Austerlitzovom polju, i nešto dugo zaspalo, nešto najbolje što je bilo u njemu, odjednom se radosno i mladenački probudilo u njegovoj duši. Taj je osjećaj nestao čim je princ Andrej ponovno ušao u uobičajene uvjete života, ali je znao da taj osjećaj, koji nije znao kako razviti, živi u njemu. Susret s Pierreom bio je za princa Andreja epoha iz koje je, iako je izgledom bio isti, ali u unutarnjem svijetu, započeo njegov novi život.
Već se smračilo kad su se princ Andrej i Pierre dovezli do glavnog ulaza u kuću Lysogorskog. Dok su se vozili, princ Andrej je sa smiješkom skrenuo Pierreovu pozornost na previranja koja su se dogodila na stražnjem trijemu. Pognuta starica s naprtnjačom na leđima i nizak muškarac u crnom ogrtaču i duge kose, ugledavši kočiju koja je ušla, pojurili su natrag kroz kapiju. Dvije su žene potrčale za njima, a sve četiri, osvrnuvši se na kočiju, uplašene su potrčale na stražnji trijem.
"Ovo su Božji strojevi", rekao je princ Andrej. Uzeli su nas za svog oca. I to je jedino u čemu ga ona ne posluša: on zapovijeda da tjera te lutalice, a ona ih prihvaća.
- Što su Božji ljudi? upitao je Pierre.
Princ Andrej nije imao vremena da mu odgovori. Sluge su mu izašle u susret, a on je upitao gdje je stari knez i koliko ga uskoro čekaju.
Stari je knez još bio u gradu, a oni su ga čekali svake minute.
Princ Andrei odveo je Pierrea u njegove odaje, koje su ga uvijek čekale u savršenom redu u očevoj kući, a on je sam otišao u vrtić.
"Idemo do moje sestre", reče princ Andrej, vraćajući se Pierreu; - Nisam je još vidio, sad se skriva i sjedi sa svojim Božjim narodom. Služi joj kako treba, bit će joj neugodno, i vidjet ćeš Božji narod. C "est curieux, ma parole. [Ovo je zanimljivo, iskreno.]
- Qu "est ce que c" est que [Što je] Božji narod? upitao je Pierre.
- Ali vidjet ćeš.
Princeza Mary je bila stvarno posramljena i pocrvenjela je na mrljama kada su ušli u nju. U njenoj udobnoj sobi sa svjetiljkama ispred kutija ikona, na sofi, kod samovara, sjedio je pored nje dječak s dugim nosom i dugom kosom, u monaškoj mantiji.
Na naslonjaču, pokraj njega, sjedila je naborana, mršava starica s krotkim izrazom dječjeg lica.
- Andre, pourquoi ne pas m "avoir prevenu? [Andrey, zašto me nisu upozorili?] - rekla je s krotkim prijekorom, stojeći pred svojim lutalicama, kao kokoš pred kokošima.