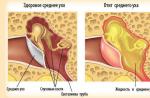
Sistemul reproducător feminin este un mecanism complex și subtil. Ciclul menstrual este un indicator al modului în care funcționează acest mecanism. Stabilitatea ciclului, durata normală a perioadei menstruale, nivelul de sângerare în intervalul normal - acești factori indică funcționarea sănătoasă și corectă a sistemului reproductiv nu numai a întregului organism, ci a întregului organism. Oricine indică o defecțiune a corpului și necesitatea de a vizita un medic.
Frecvența ciclului este determinată de regulare (din latina regulatio - ordonare). Acest termen se referă la secvența ordonată de producție de hormoni, maturizarea ouălor, modificările endometrului și - fie alte modificări hormonale necesare dezvoltării fetale corespunzătoare, fie respingerea excesului de sânge și mucus și începerea ulterioară a unui nou ciclu.
Niveluri de reglare a ciclului menstrual
Reglarea ciclului menstrual este similară cu o ierarhie - nivelurile superioare „direcționează” munca celor inferioare. Procesul de reglare începe cu un impuls trimis de creier, trece prin hipotalamus și glanda pituitară, apoi afectează ovarele, stimulând maturizarea ouălor și se termină în endometru. Deci, ce este important în reglarea ciclului menstrual?
Primul și cel mai înalt nivel de reglare a ciclului este cortexul cerebral. Aici se află majoritatea motivelor eșecului ciclului, care sunt de natură psihologică. Stres sever, lipsa de dorință sau teama de a rămâne însărcinată, atitudinea psihologică inițială față de o întârziere, care ar veni la îndemână în legătură cu o vacanță sau o nuntă - toți acești factori psihologici afectează cortexul cerebral, de unde este trimisă o comandă la nivelul inferior (hipotalamus) pentru a opri producția de hormoni. Traumatismele craniocerebrale, care afectează activitatea cortexului cerebral, pot provoca, de asemenea, o insuficiență a ciclului la primul nivel.
La al doilea nivel se află hipotalamusul - o mică zonă responsabilă de activitatea neuroendocrină a organismului. O regiune separată a acestei zone este implicată în reglarea ciclului - cea hipofizotropă. Această zonă este responsabilă de secreția hormonilor stimulatori ai foliculilor (hormoni ai primei faze a ciclului, care contribuie la maturizarea foliculilor) și a hormonilor luteinizatori (hormonii fazei corpului luteum, de asemenea LH).

Al treilea nivel este ocupat de glanda hipofizară, a cărei funcție principală este producția de hormoni de creștere. În ciclul menstrual, este implicat lobul anterior al glandei hipofizare, care este responsabil pentru echilibrul hormonilor produși, care sunt necesare pentru maturizarea corespunzătoare a ovulului și pentru dezvoltarea normală a fătului în cazul concepției.
Locul la cel de-al patrulea nivel este ocupat de ovare. Maturizarea și ruperea foliculului, eliberarea unui ou în tubul uterin (ovulație), producerea ulterioară, producerea de steroizi.
In cele din urma, al cincilea, cel mai mic nivel de reglare - organele genitale interne și externe, precum și glandele mamare. După ovulație, în aceste organe apar modificări ciclice (în principal, aceste modificări privesc endometrul), care sunt necesare pentru întreținerea și dezvoltarea fătului. Dacă ovulul nu a fost fertilizat, ciclul se încheie cu respingerea excesului și revenirea organelor genitale „la poziția lor inițială”, după care ciclul începe din nou.
Reglarea hormonală a ciclului menstrual
În timpul fazei foliculare (FSH), care sunt secretate de glanda pituitară anterioară, acestea promovează producerea hormonului estradiol de către ovar. Aceasta, la rândul său, provoacă modificări ale endometrului - umflare, îngroșarea pereților. Când se atinge un anumit nivel de estradiol în sânge, foliculul se rupe și un ovul matur este eliberat din ovar.
În timpul debutului în celulele rămase ale foliculului rupt, începe să se producă corpul luteum. Acest proces este însoțit de producerea de estradiol și progesteron, hormonul sarcinii.
Dacă concepția nu s-a produs, corpul luteum intră în faza inversă a dezvoltării. Nivelul hormonilor scade și, odată cu acesta, suportul hormonal necesar dezvoltării fătului dispărește. Modificările endometrului iau, de asemenea, o fază inversă. Se produce respingerea sângelui și a mucusului, grosimea pereților endometrului scade, după care începe din nou producția de hormoni.
Schema de reglare a ciclului menstrual
Reglarea sistemului reproductiv este un proces extrem de complex. Descrierea și explicarea ei în cuvinte este dificilă. Un număr mare de termeni medicali complică și mai mult percepția informațiilor de către o persoană care este departe de medicament. Diagrama de mai jos, constând dintr-o ilustrare a fazelor ciclului menstrual și un grafic care prezintă reglarea hormonală, demonstrează clar cursul ciclului menstrual și face percepția informației simplă și clară.

Prelegere pentru medici „Rolul hormonilor în reglarea ciclului menstrual”. Un curs de prelegeri despre obstetrică patologică pentru studenții medicali. Lectura pentru conduitele medicilor Dyakova S.M., obstetrician-ginecolog, profesor, experiență de muncă totală de 47 de ani.
Rolul hormonilor în reglarea ciclului menstrual. Partea 1.
Rolul hormonilor în reglarea ciclului menstrual. Partea 2.
Rolul hormonilor în reglarea ciclului menstrual. Partea a 3-a.
Ciclul menstrual și reglarea acestuia
Sistemul de reproducere (RS) are multe funcții, dintre care cea mai importantă este continuarea unei specii. Sistemul reproducător își atinge activitatea funcțională optimă până la vârsta de 16-18 ani, când corpul este gata să conceapă, să transporte și să hrănească un copil. O caracteristică a SM este, de asemenea, decolorarea treptată a diferitelor funcții: până la vârsta de 45 de ani, funcția generativă se estompează, până la vârsta de 50 de ani, funcția menstruală, apoi funcția hormonală.
Sistemul reproducător este format din cinci niveluri: extrahipatamic (cortexul cerebral), hipotalamus, glanda hipofizară, ovare și organe și țesuturi țintă (Fig. 1).
Sistemul de reproducere funcționează în mod ierarhic, adică. nivelul inferior se supune celui superior (datorită conexiunilor directe între legăturile de reglare). Baza pentru reglementarea funcțiilor SM este principiul feedbackului negativ între diferite niveluri (Fig. 1), adică. cu o scădere a concentrației de hormoni periferici (ovarian, în special, estradiol), crește sinteza și eliberarea hormonilor hipotalamusului și a glandei hipofizare (hormon care eliberează gonadotropină (GiRH) și respectiv hormoni gonadotropi). O caracteristică a reglării SM de sex feminin este prezența unui feedback pozitiv, când, ca răspuns la o creștere semnificativă a nivelului de estradiol în foliculul preovulator, producția de GnRH și gonadotropine crește (vârful ovulator al secreției de LH și FSH). Funcționarea sistemului reproducător al femeii este caracterizată de ciclicitatea (repetabilitatea) proceselor de reglare, ale căror idei se încadrează în conceptul modern al ciclului menstrual.
Ciclul menstrual este o modificare repetitivă a activității sistemului hipotalamus-hipofizar-ovar și a modificărilor structurale și funcționale ale organelor reproductive cauzate de aceștia: uter, trompe uterine, glande mamare, vagin.
Fiecare ciclu culminează cu sângerare menstruală (menstruația), a cărei primă zi este considerată începutul ciclului menstrual. Prima menstruație din viața unei fete se numește menarche, vârsta medie a menarchei este de 12-14 ani.
Fig. 1. Reglarea sistemului reproducător feminin: RG - hormoni de eliberare, FSH - hormon de stimulare a foliculilor, LH - hormon luteinizant, TSH - hormon stimulator tiroidian, ACTH - hormon adrenocorticotrop, Prl - prolactină, T4 - tiroxină, ADH - hormon antidiuretic E - estrogeni, P - progesteron, I - inhibină, P - factori de creștere; săgeți solide - legături înainte, săgeți punctate - legături înapoi negative.
Durata ciclului menstrual este determinată din prima zi a uneia până în prima zi a următoarei menstruații și este în mod normal de la 21 la 35 de zile (la adolescenți în intervalul 1,5-2 ani de la menarcă, durata ciclului poate fi mai variabilă - de la 21 la 40-45 de zile) ... Acest ciclu se numește norma de stabilire. Un fel de ciclu de normopontare este ciclu perfect care durează 28 de zile. Se numește un ciclu menstrual scurtat (mai puțin de 21 de zile) anteponation (ciclu de antepunere), prelungire (mai mult de 35 de zile) - postponation (ciclul de amânare).
Durata menstruației normale este în medie de 3-5 zile (în mod normal de la 3 la 7 zile), iar pierderea medie de sânge este de 50-70 ml (în mod normal până la 80 ml).
Ciclul menstrual este împărțit în mod convențional în cicluri ovariene și uterine. Ciclul ovarian (ovarian) implică procese ciclice care au loc în ovare sub influența hormonilor gonadotropi și care eliberează. Modificări ciclice în corpul unei femei uzură caracter bifazic. Prima fază (foliculară, foliculară) ciclul este determinat de maturizarea foliculului și a oului în ovar, după care acesta se rupe și oul îl părăsește - ovulația. A doua fază (luteală) asociate cu formarea unui corp galben. Simultan, într-un mod ciclic în endometru, regenerare și proliferare strat funcțional, alternativ activitate secretorie glandele sale sfârșindu-se descuamare strat funcțional (menstruație). Procesele ciclice din endometru reprezintă succesiv înlocuirea fazelor ciclul uterin.
Semnificația biologică a modificărilor care apar în timpul ciclului menstrual în ovare și endometru este de a asigura funcția de reproducere în stadiile de maturare a oului, fertilizarea și implantarea embrionului în uter. Dacă fertilizarea ovulului nu se produce, stratul funcțional al endometrului este respins, apare descărcarea sângeroasă din tractul genital, iar în sistemul reproducător, procesele apar din nou și în aceeași secvență menite să asigure maturizarea ovulului.
V superior-al treilea nivel de reglementareciclul menstrual este cortexși anume sistemul limbic și nucleii amigdaloidului. Cortexul cerebral exercită controlul asupra sistemului hepatalamo-hipofizar prin neurotransmițători (neurotransmițători), adică. transmițători ai impulsurilor nervoase către nucleele neurosecretorii ale hipotalamusului. Cel mai important rol îl joacă neuropeptidele (dopamina, norepinefrina, serotonina, săptă-peptidă, familia de peptide opioide), precum și hormonul glandei pineale melatonina. În situații stresante, cu o schimbare a climatului, a ritmului de lucru (de exemplu, schimburi de noapte), se observă tulburări de ovulație, care se realizează prin modificări în sinteza și consumul de neurotransmițători în neuronii creierului, precum și melatonina în glanda pineală.
SNC conține un număr mare de receptori pentru estradiol și alți hormoni steroizi, ceea ce indică rolul lor important nu numai în implementarea feedback-ului, ci și în metabolismul neurotransmițătorilor.
IV nivelul sistemului reproductiv - hipotalamus- este cel mai înalt centru vegetativ, un hibrid al sistemelor nervoase și endocrine, coordonând funcțiile tuturor organelor și sistemelor interne, menținând homeostazia în organism. Hipotalamusul controlează glanda hipofizară și reglarea glandelor endocrine: gonadele (ovarele), glanda tiroidă și glandele suprarenale (Fig. 1). În hipotalamus, există două tipuri de celule neurosecretorii care realizează interacțiunea hipotalamo-hipofizară:
Locul sintezei hormon de eliberare gonadotropă (GnRH) sunt nucleele arcuite ale hipotalamusului mediobasal. A izolat, a sintetizat și a descris hormonul care eliberează LH - luliberină. Până în prezent, nu a fost posibilă izolarea și sintetizarea foliberinei. Prin urmare, liberinele gonadotrope hipotalamice denotă GnRH, deoarece acestea stimulează eliberarea atât a LH cât și a FSH din glanda pituitară anterioară. Secreția de GnRH este programată genetic și apare într-un anumit ritm pulsatoriu - 1 dată în 60-90 minute (ritm de secreție circhoral, pe oră). În prezent, rolul permisiv (declanșator) al GnRH în funcționarea SM a fost dovedit. Frecvența pulsului secreției de GnRH se formează la pubertate și este un indicator al maturității structurilor neurosecretorii ale hipotalamusului. Secreția circurorală a GnRHlansează sistemul hipotalamic-hipofizar-ovarian. Sub influența GnRH, LH și FSH sunt eliberate din glanda pituitară anterioară.
Secreția de GnRH este modulată de neuropeptide ale structurilor extrahipotalamice, precum și de hormoni sexuali în conformitate cu principiul feedback-ului. Ca răspuns la o creștere a vârfului preovulator al estradiolului, crește sinteza și eliberarea de GnRH, sub influența căreia crește secreția de gonadotropine, ca urmare a ovulației. Progesteronul are atât un efect inhibitor, cât și un efect stimulant asupra producției de gonadotropine, acționând după principiul feedback-ului atât la nivelul hipotalamusului, cât și la nivelul glandei hipofizare (Fig. 1).
Rolul principal în reglarea secreției de prolactină aparține structurilor dopaminergice ale hipotalamusului. Dopamina (DA) inhibă eliberarea de prolactină din hipofiza, tiroliberină - stimulează. Antagoniștii dopaminei cresc eliberarea de prolactină.
Neurosecretoria hipotalamusului are un efect biologic asupra organismului în diferite moduri. Calea principală este parafisfeaza prin vene care curg în sinusurile dura mater, iar de acolo în circulația sistemică. Calea transhipofiza - prin sistemul venei portal (portal) către glanda pituitară anterioară; o caracteristică a sistemului circulator portal este posibilitatea fluxului de sânge în el în ambele direcții (atât spre hipotalamus, cât și spre glanda pituitară), ceea ce este important pentru implementarea mecanismelor de feedback. Efectul opus asupra glandei hipofizare a hormonilor sexuali ai ovarelor se realizează prin arterele vertebrale.
Astfel, secreția ciclică de GnRH declanșează sistemul hipotalamic-hipofizar-ovarian, însă funcția acestuia nu poate fi considerată autonomă, este modulată atât de neuropeptide SNC, cât și de steroizi ovarieni, în conformitate cu principiul feedback-ului.
III nivel - lobul anterior al glandei hipofizare (adenohipofiza).În adenohipofiză se disting trei tipuri de celule: cromofobe (de rezervă), acidofile și bazofile. Aici se sintetizează hormonii gonadotropi: hormonul stimulant al foliculilor sau folitropina (FSH), luteinizarea sau luteotropina (LH); precum și prolactină (Prl) și alți hormoni tropici: hormonul stimulant tiroidian, tirotropina (TSH), hormonul de creștere (STH), hormonul adrenocorticotrop, corticotropina (ACTH); hormon melanostimulant, melanotropină (MSH) și hormon lipotrop (LPH). LH și FSH sunt glicoproteine, Prl este un polipeptid.
Secreția LH și FSH este controlată(fig. 1):
- GnRH, care intră în adenohipofiză prin sistemul portal și stimulează secreția de gonadotropine;
- hormoni sexuali ovarieni (estradiol, progesteron) conform principiului feedbackului negativ sau pozitiv;
- inhibinele A și B. Inhibina B este sintetizată în ovare și împreună cu estradiolul suprimă secreția de FSH în a doua jumătate a fazei foliculare a ciclului (după selecția și creșterea foliculului dominant). Odată cu vârsta, pe măsură ce numărul foliculilor scade, producția de inhibină B scade, ceea ce duce la o creștere progresivă a FSH, care tinde să asigure niveluri normale de estradiol.
LH și FSH determină primele etape ale sintezei steroizilor sexuali din ovare prin interacțiunea cu receptorii specifici din țesuturile gonadelor. Eficacitatea reglării hormonale este determinată atât de cantitatea de hormon activ, cât și de nivelul receptorilor din celula țintă.
Rolul biologic al FSH:
- creșterea foliculilor din ovare, proliferarea celulelor granuloase din foliculi;
- sinteza aromatazelor - enzime care metabolizează androgenii în estrogeni (producția de estradiol);
- sinteza receptorilor LH pe celulele granuloase ale foliculului (preparat pentru ovulație);
- stimularea secreției de activină, inhibină, factori de creștere asemănători insulinei (IGF), care joacă un rol important în foliculogeneza și în sinteza steroizilor sexuali.
Rolul biologic al LH:
- provoacă ovulația (împreună cu FSH);
- sinteza estradiolului în foliculul dominant;
- sinteza de androgeni în celulele teca (celule de membrană) ale foliculului;
- luteinizarea celulelor granuloase ale foliculului ovulat și formarea corpusului luteum;
- sinteza progesteronului și a altor steroizi în celulele luteale ale corpului luteum.
Prolactină (Prl)- un polipeptid sintetizat de celulele adenohipofizei (lactotrofe), controlează lactația, stimulează creșterea canalelor glandelor mamare, susține funcția corpului luteum și sinteza progesteronului, are diverse efecte biologice: reduce densitatea minerală osoasă, crește activitatea celulelor pancreatice, conducând la rezistența la insulină (efect diabetogenic ), participă la reglarea metabolismului, a comportamentului alimentar, a ciclurilor de somn și de veghe, libido etc.
II nivelul sistemului reproductiv - ovare.Unitatea structurală principală a ovarului este foliculul care conține ovulul (ovocitul). Creșterea și maturarea foliculilor, ovulația, formarea corpusului luteum, sinteza steroizilor sexuali apar la gonade.
Proces foliculogenezaîn ovare apare continuu - de la perioada antenatală la postmenopauză. La naștere, ovarele unei fete conțin aproximativ 2 milioane de foliculi primordiali (embrionari primari). Cele mai multe dintre ele suferă modificări atretice (atrezie - dezvoltare inversă) de-a lungul vieții și doar o parte foarte mică trece prin ciclul complet de dezvoltare de la primordial la matur cu ovulația și formarea ulterioară a corpului luteum. Până la menarche, ovarele conțin 200-450 de mii de foliculi primordiali (așa-numita rezervă ovariană). Dintre acestea, doar 400-500 pot ovula în timpul vieții, restul suferă de atrezie (aproximativ 90%). În procesul de atrezie foliculară, un rol important îl joacă apoptoza (moartea celulelor programate) - un proces biologic care are ca rezultat resorbția completă a celulei sub influența propriului aparat lizozomal. În timpul unui ciclu menstrual, de regulă, se dezvoltă doar un singur folicul cu un ovul în interior. În cazul maturizării unui număr mai mare, sunt posibile sarcini multiple.
Factorii de creștere joacă un rol important în mecanismele reglării auto și paracrine a funcției nu numai a ovarului, ci și a întregului sistem reproducător.
Factorii de creștere (FR)- substanțe biologic active care stimulează sau inhibă diferențierea celulelor care transmit semnalul hormonal. Sunt sintetizate în celule nespecifice ale diferitelor țesuturi ale corpului și au efecte autocrine, paracrine, intracrine și endocrine. Efectul autocrin este realizat prin acționarea asupra celulelor care sintetizează direct acest RF. Paracrină - realizată prin acționarea asupra celulelor vecine. Efect intracelular - RF acționează ca un mesager intracelular (emițător de semnal). Efectul endocrin este realizat prin fluxul sanguin către celulele îndepărtate.
Cel mai important rol în fiziologia sistemului reproductiv îl joacă următorii RF: insulin-like (IGF), epidermică (EGF), transformant (TGF-α, TGF-β), endotelial vascular (vasculoendothelial) factor de creștere (VEGF), inhibine, activine, hormon anti-Muller ( AMG).
Factorii de creștere asemănători insulinei I și II (IGF-I, IGF-II) sintetizat în celulele granuloase și alte țesuturi, stimulează sinteza de androgeni în celulele teca ovariene, aromatizarea androgenilor în estrogeni, proliferarea celulelor granuloase, formarea receptorilor LH pe celulele granuloase. Producția lor este reglementată de insulină.
Factorul de creștere epidermică (FEG)- cel mai puternic stimulent al proliferării celulare, întâlnit în celulele granuloase, stroma endometrială, glandele mamare și alte țesuturi; are efect oncogen în țesuturile dependente de estrogen (endometru, glande mamare).
Factorul de creștere endotelială vasculară (VEGF)joacă un rol important în angiogeneza foliculilor în creștere, precum și în mio și endometru. VEGF crește activitatea mitogenă a celulelor endoteliale, permeabilitatea peretelui vascular. Expresia VEGF este crescută în endometrioză, miom uterin, tumori ovariene și de sân, PCOS etc.
Factorii de creștere transformanți (TGF-α, TFR-β) stimulează proliferarea celulelor, participă la creșterea și maturarea foliculilor, proliferarea celulelor granuloase; au efect mitogen și oncogen, expresia lor este crescută în cancerul endometrial și ovarian. Substanțele proteice din familia TGF-β includ inhibitori, activină, follistatină și AMG.
Inhibinele (A și B)- substanțele proteice, formate în celulele granuloase și alte țesuturi, participă la reglarea sintezei FSH, inhibând-o, la fel ca estradiolul, printr-un mecanism de feedback similar. Formarea inhibinei B crește în mijlocul fazei foliculare a ciclului în paralel cu o creștere a concentrațiilor de estradiol după selecția foliculului dominant și, după atingerea maximului, inhibă eliberarea de FSH.
activincare se găsește în celulele granuloase ale foliculului și gonadotrofelor hipofizare, stimulează sinteza FSH, proliferarea celulelor granuloase, aromatizarea androgenilor în estrogeni, suprimă sinteza de androgeni în celulele teca, previne luteinizarea spontană (prematură, înainte de ovulație) foliculului preovulator în stimularea foliculului.
fOLLISTATIN- proteină care blochează FSH, secretată de celulele glandei hipofizare anterioare, granuloasă; suprimă secreția de FSH.
Hormon anti-Müllerian (AMH)- un reprezentant al familiei TGF-β, produs la femeile din celulele granuloase ale foliculilor antantrali și antrali mici, joacă un rol important în mecanismele de recrutare și selecție a foliculilor, este un indicator cantitativ al rezervei ovariene și este utilizat în practica clinică pentru a evalua și prezice răspunsul ovarian la stimularea ovulației, și poate servi, de asemenea, ca marker al tumorilor celulelor granuloase ale ovarelor, în care AMH este semnificativ crescut. AMH nu este controlat de gonadotropine, nu este implicat în bucla de feedback clasic (spre deosebire de FSH, estradiol și inhibină B), nu depinde de faza ciclului și acționează ca un factor paracrin în reglarea sistemului reproducător.
Foliculogeneza în ovare
În ovarul unei femei, foliculii se află în diferite stadii de maturitate. Foliculogeneza începe din săptămâna a 12-a de dezvoltare antenatală; cea mai mare parte a foliculilor suferă de atrezie. Nu se știe pe deplin care sunt factorii responsabili pentru creșterea foliculilor primordiali. Foliculi primordiali caracterizat printr-un strat de celule pregranulare plane, un ovocit imatur mic (care nu completează a doua diviziune a meiozei), celulele teca (coajă) sunt absente.
Etapele de creștere a foliculelor:
- Prima etapă de creștere – de la foliculii primordiali la cei preantrali– creștere non-hormonală(nu depinde de FSH). Durează aproximativ 3-4 luni, până la formarea foliculilor cu un diametru de 1-4 mm. ÎN foliculii preantrali primari există un strat de celule granuloase, ovocitul începe să crească, apare theca. Foliculii preantrali secundari caracterizat prin 2-8 straturi
- Etapa a doua - creșterea foliculilor preantrali până la stadiul foliculilor antrali.Durează aproximativ 70 de zile și apare în prezența concentrațiilor minime de FSH - stadiul dependent de hormoni de creștere foliculară.În această etapă, de asemenea, IPFR-I și AMG joacă un rol important. Foliculii antici au o cavitate în centru umplută cu lichid, diametrul lor la începutul ciclului menstrual este de 3-4 mm (determinat prin ultrasunete în orice zi a ciclului menstrual), acestea tind să crească rapid în faza foliculară timpurie (Fig. 2, 3).

Fig. 2. Etapele dezvoltării foliculilor

Astfel, durata totală a foliculogenezei din momentul inițierii creșterii foliculilor primordiali până la ovulația foliculului matur este de aproximativ 200 de zile; faza foliculară a ciclului menstrual următor nu reprezintă decât stadiul final al formării foliculului dominant și ovulației. Deoarece procesele de foliculogeneză apar continuu, acest lucru poate explica prezența în ovarele foliculilor în diferite stadii de maturitate, determinate prin analize ecografice, în orice zi a ciclului menstrual (Fig. 3).
Ciclul ovarianeste format din două faze: folicular și luteal. Numărătoarea inversă faza foliculară ciclul începe în prima zi a următoarei menstruații, cu un ciclu menstrual ideal, prima fază durează aproximativ 2 săptămâni, se caracterizează prin creșterea și maturizarea foliculului dominant și se încheie cu ovulația sa, care apare în 13-14 zile ale ciclului. Apoi vine faza luteală ciclu, care durează între 14-15 și 28 de zile, timp în care are loc formarea, dezvoltarea și regresia corpusului luteum. Cu un ciclu de amânare sau amânare, durata fazei foliculare poate diferi de cea dintr-un ciclu ideal sau apropiat de acesta.
Faza foliculară a ciclului ovarian.
Creșterea foliculară dependentă de gonadotropină începe la sfârșitul ciclului menstrual anterior. Conform principiului, apare o creștere a sintezei și eliberării de FSH de către glanda hipofizară feedback negativ ca răspuns la scăderea nivelului de progesteron, estradiol și inhibină B cu regresie a corpului luteum.Sub influența FSH, creșterea foliculilor antrali continuă și în faza foliculară timpurie a ciclului menstrual (4-5 zile de la debutul menstruației) dimensiunea lor este de 4-5 mm în diametru. În această perioadă, FSH stimulează proliferarea și diferențierea celulelor granuloase, sinteza receptorilor LH din ele, activarea aromatazelor și sinteza de estrogeni și inhibină. LH în faza foliculară timpurie afectează în primul rând sinteza de androgeni, precursorii estrogenilor.
FSH atinge valoarea maximă până la a 5-6-a zi a ciclului menstrual, după care scade (sub influența concentrațiilor crescânde de estradiol și inhibină B, sintetizată de granuloza foliculilor antrali în creștere), apoi crește din nou simultan cu LH până la vârful ovulator în zilele 13-14 ciclu (Fig. 4). Selecția dominantă a foliculilor apare în 5-7 zi a ciclului din bazinul de foliculi antrali cu un diametru de 5-10 mm. Dominant devine un folicul cu cel mai mare diametru, cu cel mai mare număr de celule granuloase și receptori FSH, datorită căruia foliculul dominant își păstrează capacitatea de a crește și sintetiza în continuare estradiolul, în ciuda scăderii nivelului de FSH în sânge. Creșterea suplimentară a foliculului dominant, începând de la mijlocul fazei foliculare a ciclului, devine nu numai dependentă de FSH, dar și de LH și de FSH. În creșterea rapidă a foliculului principal, concentrațiile crescânde de estradiol și RF - IGF, VEGF - joacă și ele un rol. Până la ovulație, foliculul dominant atinge o dimensiune de 18-21 mm (Fig. 3). În foliculii antrali rămași, o scădere a nivelului seric de FSH determină procese de atrezie (apoptoză). În mecanismele de atrezie a foliculilor imaturi, un anumit rol este atribuit concentrațiilor mari de androgeni sintetizați în aceeași folicule mici (Fig. 2, 3).
ovulaţia- ruperea unui folicul matur și eliberarea unui ovul din acesta. Procesul de ovulație are loc atunci când nivel maxim de estradiolîn foliculul preovulator (Fig. 4), care este feedback pozitiv stimulează eliberarea ovulatorie de LH și FSH de către glanda hipofizară. Ovulația are loc la 10-12 ore după vârful LH sau 24-36 ore după vârful estradiol (Fig. 4). Procesul de rupere a membranei subsolului a foliculului are loc prin influența diferitelor enzime și substanțe biologic active în celulele granuloase luteinizate: enzime proteolitice, plasmină, histamină, colagenază, prostaglandine, oxitocină și relaxină. S-a arătat rolul important al progesteronului, care este sintetizat în celulele luteinizate ale foliculului preovulator sub influența vârfului LH, în activarea enzimelor proteolitice implicate în ruperea membranei subterane foliculare. Ovulația este însoțită de sângerare din capilarele distruse care înconjoară celulele theca.

Faza luteală a ciclului ovarian
După ovulație, capilarele formate cresc rapid în cavitatea foliculului ovulat, celulele granuloase suferă în continuare luteinizare cu formarea unui corpus luteum care secretă progesteron sub influența LH. Luteinizarea celulelor granuloase se manifestă morfologic printr-o creștere a volumului lor și formarea incluziunilor lipidice. corpus luteum - formarea activă hormonală tranzitorie, care funcționează timp de 14 zile, indiferent de durata totală a ciclului menstrual. Un luteum complet al corpului se dezvoltă numai în faza în care în foliculul preovulator se formează un număr adecvat de celule granuloase cu un conținut ridicat de receptori LH. În dezvoltarea corpusului luteum se disting următoarele etape:
- proliferare- caracterizat prin luteinizarea activă a celulelor granuloase sub influența LH;
- vascularizării- germinarea capilarelor în corpul luteum;
- înflorirea- această fază se încadrează în 21-22 de zile ale ciclului, caracterizează finalizarea formării structurale a corpului luteum, ceea ce corespunde unei creșteri progresive a concentrației de steroizi sexuali (Fig. 4); acțiunea combinată a progesteronului și a estradiolului contribuie la prepararea preimplantare a endometrului (transformare secretorie);
- dezvoltare inversă (regresie)- o scădere a activității corpusului luteum asociată cu o scădere a numărului de receptori LH; Efectul luteolitic se exercită și prin concentrații crescute de estradiol și Prl la sfârșitul ciclului menstrual; regresia corpusului luteum duce la o scădere a nivelului de progesteron (Fig. 4), care provoacă descuamarea endometrului în uter - ciclul se repetă.
Dacă apare concepția și implantarea ovulului (în zilele 21-22 ale ciclului), corionul care formează începe să producă gonatropină corionică umană (hCG), ceea ce stimulează dezvoltarea ulterioară a corpului luteum. În acest caz, corpus luteum de sarcină,care continuă să sintetizeze progesteronul în concentrații mari necesare prelungirii sarcinii. Corpusul luteum al sarcinii există până la 8-10 săptămâni de gestație, apoi suferă regresie, iar placenta formată până la sfârșitul primului trimestru preia suportul hormonal pentru sarcină.
Funcția hormonală ovariană
Procesele ciclice din ovar se caracterizează nu numai prin modificări morfologice ale foliculilor și corpului luteum, ci și prin procesele de steroidogeneză legate în mod inextricabil cu aceștia - formarea hormonilor sexuali. În prezent, este în general acceptat teoria cu două celulebiosinteza steroizilor din ovare, conform cărora LH stimulează sinteza de androgeni în celulele teca, în timp ce FSH - sinteza enzimelor de aromatază care metabolizează androgenii la estrogeni în celulele granuloase.
Structurile producătoare de steroizi ale ovarelor sunt celule granuloase, teca și, într-o măsură mai mică, stromă. Celulele teca sunt principala sursă de androgeni, celule granuloase - estrogeni, progesteronul este sintetizat în celulele teca și maxim în celulele luteale ale corpului luteum (celule granuloase luteinizate). Colesterolul este un substrat pentru toți steroizii, inclusiv suprarenalele și testiculele (Fig. 5).

Sinteza hormonilor sexuali apare de asemenea extragonadal. Este cunoscut faptul că țesutul adipos conține sistemul enzimei P450 aromatază, care este implicat în conversia androgenilor în estrogeni. Acest proces poate fi inițiat de diferite RF-uri mitogenice sau de estradiolul în sine. În plus, testosteronul biologic activ (dihidrotestosteron) este, de asemenea, sintetizat extragonadal în țesuturile țintă periferice (foliculii de păr, glandele sebacee) sub influența enzimei 5-α-reductază.
Aproximativ 96% din toți steroizii sexuali sunt într-o stare legată de proteine, în special cu globulină de legătură cu steroizi sexuali (SHBG), precum și albumină, a cărei sinteză se realizează în ficat. Efectul biologic al hormonilor este determinat de fracțiuni nelimitate, libere, al căror nivel se schimbă în diferite condiții patologice, în special rezistența la insulină, boli hepatice etc.
Estrogenii.Principalele fracții de estrogen sunt estrone (E 1 ), estradiol (E 2 ), estriol (E 3 ). Cel mai activ biologic este estradiolul. Estriolul este un metabolit periferic al estronei și estradiolului și nu este un produs independent al secreției ovariene. În 1965, a fost descris și al patrulea estrogen - estrol (E 4 ), până acum puțin studiat, cu un efect estrogenic slab.
Acțiunea biologică a estrogenilor:
- pe reproducătororgane țintă:
- proliferarea endo- și miometrului, epiteliului vaginal, colului uterin;
- secreția de mucus în canalul cervical;
- creșterea canalelor glandelor mamare;
- pe unreproductivețesut țintă:
- procese proliferative ale membranei mucoase a uretrei, vezicii urinare;
- dezvoltarea sistemului musculo-scheletic, creșterea mineralizării osoase (prin stimularea sintezei osteoblastelor);
- scăderea secreției glandelor sebacee;
- creșterea sintezei și maturarea colagenului la nivelul pielii;
- scăderea hirsutismului (efect antiandrogenic prin reducerea clearance-ului SHBG);
- acțiune antiaterogenă (reducerea fracțiunilor lipidice aterogene);
- distribuția țesutului adipos și formarea scheletului în funcție de tipul feminin, timbre vocal feminin;
- îmbunătățirea funcțiilor sistemului nervos central (cognitiv etc.);
- efect protector asupra endoteliului vascular (efect antiatherosclerotic);
- creșterea proprietăților de coagulare a sângelui, formarea trombului (datorită sintezei crescute a factorilor de coagulare din ficat);
- creșterea libidoului.
Efectul biologic al estrogenilor asupra diferitelor organe și țesuturi depinde de numărul și tipul receptorilor specifici și de sensibilitatea acestora. S-a stabilit prezența a două tipuri de receptori pentru estradiol: ER- α - receptori nucleari; având un efect proliferativ și membrană ER- β , având efect antiproliferativ.
Gestagene.Principalul gestagen este progesteronul, care se formează în principal în corpul luteum al ovarelor.
Acțiunea biologică a progesteronului:
Acțiunea progesteronului se realizează prin intermediul receptorilor tip A și B. În funcție de prevalența unuia sau altui tip de receptor, țesuturile țintă răspund cu efecte diferite. De exemplu, în endometru și epiteliu al glandelor mamare, PR tip A , prin urmare, progesteronul își dă seama acțiune antiproliferativă(analogii de progesteron sunt utilizați pe scară largă pentru tratamentul și prevenirea proceselor hiperplastice ale endometrului și ale glandelor mamare, mastopatie fibrocistică). Miometrul este dominat de PR tip B și progesteron expune efect proliferativ... Astfel, conform conceptelor moderne, i se atribuie un rol important în patogeneza fibroamelor uterine, iar modulatorii de PR selectivi care blochează receptorii de tip B sunt folosiți cu succes în tratamentul acestei tumori.Androgenii.Principalele fracții de androgeni sunt androgenii puternici testosteron, predecesorul său slab androstendion, și dihidroandrostenedion (DHEA) și sulfatul său (DHEA-S). Cel mai activ biologic este metabolitul testosteronului - dihidrotestosteron, sintetizat în țesuturile țintă periferice (foliculii de păr, glandele sebacee) sub influența enzimei 5-α-reductază. Principalele site-uri pentru sinteza androgenilor din corpul feminin sunt ovarele, glandele suprarenale, precum și țesutul adipos și pielea cu apendicele sale.
Efectele biologice ale androgenilor:
eunivelreglarea funcției reproductive este alcătuită din părți interne și externe ale sistemului reproducător (uter, trompe uterine, mucoasă vaginală), sensibile la fluctuațiile nivelurilor de steroizi sexuali, precum și ale glandelor mamare. Cele mai pronunțate modificări ciclice apar în endometru și alcătuiesc ciclul uterin.Ciclul uterin
Modificările ciclice ale endometrului o afectează strat de suprafață funcțional, compus din celule epiteliale compacte și celule intermediare, care sunt respinse în timpul menstruației. Stratul bazal, nu este respins în timpul menstruației, asigură refacerea straturilor descuamate.
Transformările ciclice ale stratului funcțional al endometrului se desfășoară în funcție de ciclul ovarian în trei etape succesive – stadiu de proliferare, stadiu de secreție, stadiu de descuamare (menstruație).
Faza de descuamare.Sângerarea menstruală observată la sfârșitul fiecărui ciclu menstrual se datorează respingerii stratului funcțional al endometrului. Debutul menstruației este considerat prima zi a ciclului menstrual. Durata sângerării menstruale este în medie de 3-5 zile. În legătură cu regresia corpului luteum și o scădere accentuată a conținutului de steroizi sexuali din endometru, hipoxia crește. Debutul menstruației este facilitat de spasmul prelungit al arterelor, ceea ce duce la staza de sânge și formarea cheagurilor de sânge. Hipoxia tisulară (acidoză tisulară) este agravată de permeabilitatea endotelială crescută, fragilitatea pereților vasului, numeroase hemoragii minore și infiltrare masivă de leucocite. Enzimele proteolitice lisozomale secretate din leucocite sporesc topirea elementelor tisulare. În urma unui vasospasm prelungit, expansiunea lor paretică are loc cu creșterea fluxului de sânge. În același timp, există o creștere a presiunii hidrostatice în patul microcirculator și ruperea pereților vaselor de sânge, care în acest moment își pierd în mare măsură rezistența mecanică. În acest context, are loc descuamarea activă a zonelor necrotice ale stratului funcțional. Până la sfârșitul primei zile de menstruație, 2/3 din stratul funcțional este respins, iar descuamarea completă a acestuia se termină de obicei în a 3-a zi.
Fluxul menstrual conține sânge și mucus cervical și este bogat în leucocite. Sângele menstrual aproape nu coagulează, este bogat în ioni de calciu, conține puțin fibrinogen și lipsește protrombină. În medie, o femeie pierde 50 - 70 ml sânge în timpul menstruației.
Imediat după producerea respingerii endometrului necrotic stadiu de regenerare , caracterizată prin epitelizarea suprafeței plăgii a endometrului, datorită celulelor stratului bazal. Procesele de regenerare au loc sub controlul estrogenilor și contribuie, împreună cu vasospasmul și formarea trombului, la stoparea sângerărilor menstruale. Unii autori disting regenerarea ca o etapă separată a ciclului uterin.
Faza de proliferare.Descuamarea și regenerarea membranei mucoase după menstruație se încheie până la a 3-5-a zi a ciclului. Apoi, sub influența unei concentrații crescânde de estrogeni, grosimea stratului funcțional crește datorită creșterii tuturor elementelor stratului bazal: glande, stroma, vase de sânge. Glandele endometriale sunt tuburi drepte sau mai multe convolute cu un lumen drept. Arterele spiralate sunt ușor răsucite. În stadiul de proliferare târzie (11-14 zile ale ciclului), glandele endometriale devin convolute, asemănătoare cu ondulație, rotunjite, lumenul lor oarecum extins. Arterele spirale care cresc din stratul bazal ajung la suprafața endometrului, ele sunt oarecum convolute. Grosimea stratului funcțional al endometrului până la sfârșitul fazei de proliferare atinge 7-8 mm.
Faza de secreție (transformare secretorie)începe după ovulație în 13-14 zile ale ciclului, durează 14 zile și este direct legată de activitatea corpului luteum. Se caracterizează prin faptul că epiteliul glandelor sub influența progesteronului și estradiolul începe să producă un secret care conține glicozaminoglicani acide, glicoproteine, glicogen.
În faza timpurie a fazei de secreție (15-18 zile ale ciclului)apar primele semne ale transformărilor secretorii. Glandele devin mai convolute, lumenul lor este oarecum extins. În straturile de suprafață ale endometrului, pot exista hemoragii focale asociate cu o scădere pe termen scurt a estrogenului după ovulație.
În faza de mijloc a fazei de secreție (19-23 de zile ale ciclului),când concentrația de progesteron este maximă și nivelul de estrogen crește, stratul funcțional al endometrului devine mai mare (9-12 mm) și este împărțit clar în 2 straturi. Strat profund (spongios, spongios), se învecinează cu bazalul, conține un număr mare de glande puternic convolute și o cantitate mică de stroma. Strat dens (compact) este - 1 / 4-1 / 5 din grosimea stratului funcțional. Are mai puține glande și mai multe celule de țesut conjunctiv. Cea mai pronunțată secreție este în zilele 20-21 ale ciclului. Până în acest moment, în stroma endometrului se produc transformări asemănătoare cu deciduuri (celulele stratului compact devin mari, rotunde sau poligonale, glicogenul apare în citoplasma lor). Arterele spiralelor sunt brusc răsucite, formează „încurcături” și se găsesc în întregul strat funcțional, permeabilitatea vasculară crește, lumenele vasculare se extind, volumul alimentării cu sânge către endometru crește. Aceste modificări ale glandelor și vaselor endometrului constituie esența pregătirii sale de preimplantare și sunt sincronizate în timp cu intrarea în cavitatea uterină a ovulului (așa-numita fereastră de implantare - a 7-a zi de la concepție). Dacă implantarea are succes, endometrul va suferi o transformare decisivă sub influența concentrației crescânde de progesteron. În absența sarcinii, în endometru apar modificări degenerative.
Etapa târzie a fazei de secreție (24-27 zile ale ciclului)caracterizată printr-o încălcare a trofismului endometrului și o creștere treptată a acestuia a modificărilor degenerative. Înălțimea endometrului scade, stroma stratului funcțional se micșorează, plierea pereților glandelor crește și dobândesc contururi stelate sau cu dantelă. În ziua de 26-27 a ciclului, se observă extinderea lacunară a capilarelor și hemoragiilor focale în stroma în straturile superficiale ale stratului compact. Se numește starea endometrului, pregătită în acest fel pentru descompunere și respingere menstruația anatomicăși este descoperit cu o zi înainte de început menstruație clinică(sângerare).
Membrană mucoasă istmul uteruluiîn structura morfologică, este similar cu endometrul, dar nu face distincție între stratul funcțional și bazal.
În canalul cervicalapar și modificări ciclice. În timpul menstruației, descuamarea apare nu a membranei mucoase a canalului cervical, ci doar a epiteliului său superficial. Sub influența estrogenilor în faza foliculară a ciclului, canalul cervical se extinde, faringele externe se deschide ușor („simptom pupilar” pozitiv), producția de mucus cervical crește, atingând un maxim până la ovulație („simptom de ferigă” pozitiv, „simptom de tensiune a mucusului cervical” - 8-10 cm) ). Sub influența progesteronului în faza luteală a ciclului, canalul cervical se îngustează, cel extern se închide (negativ
"Simptomul pupilei"), mucusul cervical devine gros, dens, nu se întinde (tabelul 1), membrana mucoasă a colului uterin, vaginul devine cianotic.
Modificări ciclice apar și în mucoasa vaginala, care este reprezentat de epiteliu scuamoz non-keratinizant stratificat, deci în prima jumătate a ciclului, sub influența estrogenilor
există o proliferare a straturilor intermediare și superficiale ale membranei mucoase. În frotiul vaginal predomină celulele mature, superficiale, indicele cariotipicototic (IPC) este ridicat - 60-80% în perioada preovulatoare (Tabelul 1). În a doua fază a ciclului, sub influența progesteronului, apar apoptoza și descuamarea celulelor de suprafață. În frotiu predomină celulele intermediare, acestea au o formă alungită și sunt localizate în principal în grupuri (indice de aglomerație; CRP scăzut - 20-25%, vezi Tabelul 1).
Tabelul 1. Teste de diagnosticare funcțională

Notă: TFD - teste de diagnosticare funcțională, KPI - indice cariopycnotic, BT - temperatura bazală; zile ale ciclului menstrual: 0 - ziua ovulației, numere cu semn "-" - cu zile înainte de ovulație (faza foliculară a ciclului), numere cu semn "+" - zile după ovulație (faza luteală a ciclului).
În glandele mamaresub influența estrogenilor din prima jumătate a ciclului menstrual, proliferează epiteliul pasajelor lactifere, iar în a doua fază, sub influența progesteronului, apare proliferarea epiteliului secretor în acini (lobuli).
Vizualizați și cumpărați cărți despre ecografia lui Medvedev:
În reglarea ciclului menstrual sunt implicate 5 legături / niveluri:
cortex
hipotalamus
pituitară
ovare
uter.
Primul nivel fundamental de guvernare este cortex... Aici are loc recunoașterea și procesarea semnalelor din mediul extern, apoi transmiterea impulsurilor către hipotalamus. Orice informație din lumea exterioară care afectează starea emoțională și mentală a unei femei este reflectată în activitatea sistemului reproducător.
Al doilea nivel este zona hipotalamusului, locul „ceasului biologic” al corpului feminin. Hipotalamus este o colecție de celule nervoase, unele dintre ele sintetizând factori de eliberare. Aceștia au stabilit natura ciclică a tuturor proceselor care au loc în corpul unei femei și determină modul în care va funcționa întregul sistem reproductiv (inclusiv reglarea ciclului menstrual și posibilitatea de a rămâne însărcinată).
Sistemul de reproducere s-a format în lumea antică și de atunci s-au schimbat multe. In orice caz, hipotalamus continuă să monitorizeze procesele care au loc în corpul feminin și să ia o decizie cu privire la disponibilitatea femeii pentru sarcină. Astfel, hipotalamusul a confundat obezitatea și sindromul metabolic pentru inflamația cronică. Pasiune pentru sport - pentru migrația tribului. Conflicte la locul de muncă și acasă - pentru concurență în cadrul tribului. În toate aceste condiții, hipotalamusul încearcă să protejeze femeia, împiedicând-o să rămână însărcinată, perturbând ciclul menstrual. Dacă nu detectează factori „periculoși”, atunci ciclul menstrual își păstrează natura ciclică.
Al treilea nivel este pituitară... Glanda hipofizară sintetizează hormoni care sunt responsabili de producerea hormonilor sexuali din ovare. Hormonii hipofizari care reglează ciclul menstrual includ:
Hormonul stimulant al foliculilor (FSH) și hormonul luteinizant (LH) - sunt responsabili pentru creșterea foliculului și ovulația;
Prolactina - crește și funcția glandelor mamare depinde de aceasta;
Oxitocină - Este responsabilă pentru contracția stratului muscular al uterului.
Al patrulea nivel - ovare... Ouăle se coacă și se produc hormoni sexuali feminini - estrogen și progesteron. Estrogenii sunt responsabili de creșterea și dezvoltarea uterului, glandelor mamare și vaginului. Dezvoltarea corectă a sarcinii depinde de progesteron.
Al cincilea nivel - uter, trompe uterine și vagin. În diferite faze ale ciclului menstrual, sub influența hormonilor, apar modificări în endometru. În uter, în a doua fază a ciclului, endometrul (stratul interior al uterului) crește, ceea ce indică faptul că uterul se pregătește să primească un ou fecundat. Dacă nu a avut loc fertilizarea, endometrul este respins și începe menstruația.
Ciclu menstrual - este un complex de procese biologice complexe care apar în corpul unei femei, care se caracterizează prin modificări ciclice în toate părțile sistemului reproductiv și este conceput pentru a asigura concepția și dezvoltarea sarcinii.
Menstruația este o sângerare ciclică uterină scurtă rezultată din respingerea stratului funcțional al endometrului la sfârșitul ciclului menstrual bifazic. Prima zi a menstruației este luată ca prima zi a ciclului menstrual.
Durata ciclului menstrual este perioada cuprinsă între primele zile ale ultimelor două menstruații și variază normal între 21 și 36 de zile, în medie 28 de zile; durata menstruației - de la 2 la 7 zile; volumul pierderii de sânge este de 40-150 ml.
Fiziologia sistemului reproducător feminin
Reglarea neurohumorală a sistemului reproductiv este organizată după un principiu ierarhic. Se distinge
cinci niveluri, fiecare dintre ele fiind reglat de structurile de bază conform unui mecanism de feedback: cortexul cerebral, hipotalamusul, glanda hipofizară, ovarele, uterul și alte țesuturi țintă pentru hormonii sexuali.
cortex
Cel mai înalt nivel de reglare este cortexul cerebral: neuronii specializați primesc informații despre starea mediului intern și extern, îl transformă în semnale neurohumorale, care, prin sistemul neurotransmițătorilor, intră în celulele neurosenzoriale ale hipotalamusului. Funcția neurotransmițătorilor este îndeplinită de amine biogenice-catecolamine - dopamină și norepinefrină, indolii - serotonină, precum și neuropeptide opioide - endorfine și encefaline.
Dopamina, norepinefrina și serotonina controlează neuronii hipotalamici care secretă hormonul care eliberează gonadotropina (GnRH): dopamina susține secreția de GnRH în nucleele arcuate și inhibă, de asemenea, eliberarea prolactinei de către adenohipofiză; norepinefrina reglează transmiterea impulsurilor către nucleele prebiotice ale hipotalamusului și stimulează eliberarea ovulatoare a GnRH; serotonina controlează secreția ciclică a hormonului luteinizant (LH). Peptidele opioide suprimă secreția de LH, inhibă efectul stimulant al dopaminei, iar antagonistul acestora, naloxonă, provoacă o creștere accentuată a nivelului de GnRH.
Hipotalamus
Hipotalamusul este una dintre principalele structuri ale creierului implicate în reglarea funcțiilor autonome, viscerale, trofice și neuroendocrine. Nucleii zonei hipofizo-otrope a hipotalamusului (supraoptic, paraventricular, arcuat și ventromedial) produc neurosecrete specifice cu efecte farmacologice diametral opuse: eliberând hormoni care eliberează hormoni tropici în hipofiza anterioară și statine, inhibând secreția lor.
În prezent, 6 hormoni de eliberare (RH) sunt cunoscuți: RH gonadotropă, RH stimulatoare tiroidiană, RG adrenocorticotropă, RH somatotropă, RH melanotropă, prolactină-RH și trei statine: hormon inhibitor melanotropic, somatot-
un hormon inhibitor rapid, hormon inhibitor al prolactinei.
GnRH este eliberat în fluxul sanguin portal într-un mod pulsatoriu: o dată la 60-90 minute. Acest ritm se numește circ. Rata de eliberare a GnRH este programată genetic. În timpul ciclului menstrual, se modifică în limite mici: frecvența maximă este înregistrată în perioada preovulatoare, minimă - în faza a II-a a ciclului.
Glanda pituitară
Celulele bazofile ale adenohipofizei (gonadotropocite) secretă hormoni - gonadotropine, care sunt direct implicate în reglarea ciclului menstrual; acestea includ folitropina sau hormonul de stimulare a foliculilor (FSH) și lutropina sau hormonul luteinizant (LH); un grup de celule acidofile ale glandei hipofizare anterioare - lactotropocitele produc prolactină (PRL).
Secreția de prolactină are un ritm de secreție circadiană.
Există două tipuri de secreție de gonadotropină - tonică și ciclică. Eliberarea tonică de gonadotropine promovează dezvoltarea foliculilor și producerea acestora de estrogeni; ciclic - oferă o schimbare în fazele secreției joase și mari a hormonilor și, în special, a vârfului lor pre-ovulator.
Acțiunea biologică a FSH: stimulează creșterea și maturizarea foliculilor, proliferarea celulelor granuloase; induce formarea receptorilor LH pe suprafața celulelor granuloase; crește nivelul aromatazelor din foliculul matur.
Acțiunea biologică a LH: stimulează sinteza de androgeni (precursori de estrogen) în celulele teca; activează acțiunea prostaglandinelor și enzimelor proteolitice, care duc la subțierea și ruperea foliculului; are loc luteinizarea celulelor granuloase (formarea unui corp galben); împreună cu PRL stimulează sinteza progesteronului în celulele granuloase luteinizate ale foliculului ovulat.
Acțiunea biologică a PRL: stimulează creșterea glandelor mamare și reglează lactația; are efect de mobilizare a grăsimilor și hipotensiv; în cantități crescute inhibă creșterea și maturizarea foliculului; participă la reglarea funcției endocrine a corpusului luteum.
ovarele
Funcția generativă a ovarelor se caracterizează prin maturizarea ciclică a foliculului, ovulația, eliberarea unui ovul care este capabil să conceapă și furnizarea de transformări secretorii în endometru necesare pentru percepția unui ovul fecundat.
Principala unitate morfofuncțională a ovarelor este foliculul. În conformitate cu Clasificarea Histologică Internațională (1994), se disting 4 tipuri de foliculi: primordial, primar, secundar (antral, cavitate, vezicular), matur (preovulator, graaf).
Foliculii primordiali se formează în a cincea lună de dezvoltare intrauterină a fătului (ca urmare a meiozei, conțin un set haploid de cromozomi) și continuă să existe pe parcursul vieții unei femei până la menopauză și timp de câțiva ani după încetarea persistentă a menstruației. Până la naștere, ambele ovare conțin aproximativ 300-500 de mii de foliculi primordiali, ulterior numărul acestora scade brusc și până la vârsta de 40 de ani este de aproximativ 40-50 de mii din cauza atreziei fiziologice.
Foliculul primordial este format dintr-un ovul înconjurat de un singur rând de epiteliu folicular; diametrul său nu depășește 50 microni.
Etapa foliculului primar se caracterizează prin proliferarea crescută a epiteliului folicular, celulele cărora dobândesc o structură granulară și formează un granular (strat granular). Secretul secretat de celulele acestui strat se acumulează în spațiul intercelular. Mărimea ovocitului crește treptat până la 55-90 microni în diametru.
În procesul formării unui folicul secundar, pereții săi sunt întinși de lichid: ovocitul din acest folicul nu mai crește (până la acest moment diametrul său este de 100-180 microni), dar diametrul foliculului în sine crește și este de 20-24 mm.
Într-un folicul matur, celula de ou, închisă într-un tub tub portant, este acoperită cu o membrană transparentă, pe care celulele granulare sunt situate în direcția radială și formează o coroană radiantă.
Ovulația - ruperea unui folicul matur cu eliberarea unei celule de ovule, înconjurată de o coroană radiantă, în cavitatea abdominală,
iar mai târziu în ampula tubului uterin. Încălcarea integrității foliculului are loc în partea cea mai convexă și cea mai subțire a acestuia, numită stigmată.
La o femeie sănătoasă, un folicul se maturizează în timpul ciclului menstrual și aproximativ 400 de ouă ovulate pe întreaga perioadă de reproducere, restul ovocitelor suferă de atrezie. Viabilitatea oului se menține timp de 12-24 ore.
Luteinizarea este o transformare specifică a foliculului în perioada postovulatoare. Ca urmare a luteinizării (colorarea galbenă datorită acumulării pigmentului lipochromic - luteină), înmulțirea și proliferarea celulelor membranei granulare a foliculului ovulat, se formează o formațiune numită corpus luteum. În acele cazuri în care nu are loc fertilizarea, corpul luteum există timp de 12-14 zile și apoi suferă o dezvoltare inversă.
Astfel, ciclul ovarian este format din două faze - foliculare și luteale. Faza foliculară începe după menstruație și se termină cu ovulația; faza luteală are loc între ovulație și debutul menstruației.
Funcția hormonală ovariană
Celulele membranei granuloase, căptușeala interioară a foliculului și corpul luteum în timpul existenței lor îndeplinesc funcția glandei endocrine și sintetizează trei tipuri principale de hormoni steroizi - estrogeni, gestageni și androgeni.
Estrogenii sunt secretați de celulele membranei granulare, de căptușeala interioară și, în mai mică măsură, de celule interstițiale. În cantități mici, estrogenii se formează în corpul luteum, cortexul suprarenal, iar la femeile însărcinate - în placentă. Principalii estrogeni ovarieni sunt estradiolul, estrona și estriolul (în principal primii doi hormoni sunt sintetizați). Activitatea de 0,1 mg de estronă este luată ca 1 UI de activitate estrogenică. Conform testului Allen și Doisy (cea mai mică cantitate de medicament care provoacă estru la șoarecii castrați), estradiolul are cea mai mare activitate, apoi estronul și estriolul (raport 1: 7: 100).
Metabolizarea estrogenului. Estrogenii circulă în sânge într-o formă liberă și legată de proteine \u200b\u200b(inactive biologic). Din sânge, estrogenii intră în ficat, unde sunt inactivați prin formarea de compuși în pereche cu acizi sulfurici și glucuroni, care intră în rinichi și sunt excretați în urină.
Efectul estrogenului asupra organismului este realizat astfel:
Efect vegetativ (strict specific) - estrogenii au un efect specific asupra organelor genitale feminine: stimulează dezvoltarea caracteristicilor sexuale secundare, provoacă hiperplazie și hipertrofia endometrului și a miometrului, îmbunătățesc aprovizionarea cu sânge a uterului, promovează dezvoltarea sistemului excretor al glandelor mamare;
- efecte generative (mai puțin specifice) - estrogenii stimulează procesele trofice în timpul maturării foliculului, promovează formarea și creșterea granulozei, formarea unui ovul și dezvoltarea corpului luteum - pregătesc ovarul pentru efectele hormonilor gonadotropi;
- efect general (nespecific) - estrogenii în cantități fiziologice stimulează sistemul reticuloendotelial (crește producția de anticorpi și activitatea fagocitelor, crește rezistența organismului la infecții), reține azot, sodiu, lichid în țesuturile moi, calciu și fosfor în oase. Ele provoacă o creștere a concentrației de glicogen, glucoză, fosfor, creatinină, fier și cupru în sânge și mușchi; reduce conținutul de colesterol, fosfolipide și grăsimi totale din ficat și sânge, accelerează sinteza acizilor grași superiori.
Progestogenii sunt secretați de celulele luteale ale corpului luteum, celulele luteinizante ale granulozei și membranelor foliculare, precum și cortexul suprarenal și placenta. Principalul progestogen al ovarelor este progesteronul. Pe lângă progesteron, ovarele sintetizează 17a-hidroxiprogesteronă, D4-grossenol-20a-OH-3, D4-sarcenol-20b-OH-3.
Efectele gestagenelor:
Efect vegetativ - gestagenii afectează organele genitale după stimularea estrogenică preliminară: suprimă proliferarea endometrului cauzată de estrogeni, realizează transformări secretorii în endometru; în timpul fertilizării ovulului, gestagenii suprimă ovulația, previn contracția uterină („protectorul” sarcinii), promovează dezvoltarea alveolelor în glandele mamare;
- efecte generative - gestagenele în doze mici stimulează secreția de FSH, în doze mari blochează atât FSH cât și LH; provoacă excitația centrului termoregulator, localizat în hipotalamus, care se manifestă printr-o creștere a temperaturii bazale;
- efect general - în condiții fiziologice, gestagenii reduc conținutul de azot aminic în plasma sanguină, cresc excreția de aminoacizi, cresc secreția de suc gastric și inhibă separarea bilei.
Androgenii sunt secretați de celulele mucoasei interioare a foliculului, de celulele interstițiale (în cantități nesemnificative) și de celulele cortexului suprarenal (sursa principală). Principalii androgeni ai ovarelor sunt androstenedionul și dehidroepiandrosterona, testosteronul și epitestosteronul sunt sintetizate în doze mici.
Efectul specific al androgenilor asupra sistemului reproductiv depinde de nivelul secreției lor (dozele mici stimulează funcția glandei hipofize, dozele mari îl blochează) și se pot manifesta sub forma următoarelor efecte:
Efect viril - doze mari de androgeni provoacă hipertrofie clitorisă, creșterea părului cu model masculin, proliferarea cartilajului cricoid, acnee;
- efect gonadotropic - doze mici de androgeni stimulează secreția de hormoni gonadotropi, promovează creșterea și maturarea foliculilor, ovulația, luteinizarea;
- efect antigonadotrop - un nivel ridicat de concentrație de androgeni în perioada pre-ovulatoare suprimă ovulația și, ulterior, provoacă atrezie foliculară;
- efect estrogenic - în doze mici de androgeni provoacă proliferarea endometrului și a epiteliului vaginal;
- efect antiestrogenic - doze mari de androgeni blochează procesele de proliferare din endometru și duc la dispariția celulelor acidofile din frotiul vaginal.
- efect general - androgenii au o activitate anabolică accentuată, îmbunătățesc sinteza proteinelor tisulare; reține azot, sodiu și clor în organism, reduce excreția de uree. Accelerarea creșterii osoase și osificarea cartilajului epifizal, crește numărul de eritrocite și hemoglobină.
Alți hormoni ovarieni: inhibina, sintetizată de celulele granulare, are un efect inhibitor asupra sintezei de FSH; oxitocină (care se găsește în lichidul folicular, corpul luteum) - în ovare are efect luteolitic, promovează regresia corpului luteum; relaxina, formată în celule granuloase și corpus luteum, promovează ovulația, relaxează miometrul.
Uter
Sub influența hormonilor ovarieni, se observă modificări ciclice în miometru și endometru, corespunzând fazelor foliculare și luteale din ovare. Faza foliculară se caracterizează prin hipertrofia celulelor stratului muscular al uterului, iar faza luteală se caracterizează prin hiperplazia lor. Modificările funcționale ale endometrului sunt reflectate de o modificare secvențială a etapelor de regenerare, proliferare, secreție, descuamare (menstruație).
Faza de regenerare (3-4 zile ale ciclului menstrual) este scurtă, caracterizată prin regenerarea endometrului din celulele mulsului bazal.
Epitelializarea suprafeței plăgii are loc din secțiunile marginale ale glandelor stratului bazal, precum și din secțiunile profunde nerefuite ale stratului funcțional.
Faza de proliferare (corespunzătoare fazei foliculinei) se caracterizează prin transformări care apar sub influența estrogenilor.
Etapa timpurie a proliferării (până la 7-8 zile ale ciclului menstrual): suprafața membranei mucoase este căptușită cu un epiteliu cilindric aplatizat, glandele arată ca niște tuburi scurte drepte sau ușor convoluite, cu un lumen îngust, epiteliul glandelor este dintr-un singur rând, scăzut, cilindric.
Etapa mijlocie de proliferare (până la 10-12 zile ale ciclului menstrual): suprafața membranei mucoase este căptușită cu epiteliu prismatic ridicat, glandele se prelungesc, devin mai convolute, stroma este umflată, slăbită.
Etapa târzie de proliferare (înainte de ovulație): glandele devin brusc convolute, uneori în formă de spur, lumenul lor se extinde, epiteliul căptușește glandele este multi-rând, stroma este suculentă, arterele spirale ajung la suprafața endometrului, moderat convolut.
Faza de secreție (corespunzătoare fazei luteale) reflectă modificările cauzate de expunerea la progesteron.
Etapa timpurie a secreției (până în a 18-a zi a ciclului menstrual) se caracterizează prin dezvoltarea ulterioară a glandelor și extinderea lumenului lor, cea mai caracteristică a acestei etape este apariția în epiteliu a vacuolelor subnucleare care conțin glicogen.
Etapa mijlocie a secreției (19-23 de zile ale ciclului menstrual) reflectă transformările caracteristice înălțimii în corpul luteum, adică. perioada de saturație gestagenă maximă. Stratul funcțional devine mai înalt, este divizat clar în straturi profunde și superficiale: profund - spongios, spongios; superficial - compact. Glandele se extind, pereții lor devin pliați; în lumenul glandelor apare un secret care conține glicogen și mucopolizaharide acide. Arterele spiralate sunt răsucite brusc și formează „încurcături” (cel mai de încredere semn care determină efectul luteinizant). Structura și starea funcțională a endometrului în zilele 20-22 ale ciclului menstrual de 28 de zile reprezintă condiții optime pentru implantarea blastocistului.
Etapa tardivă a secreției (24-27 de zile ale ciclului menstrual): procese asociate cu regresia corpului luteum și, în consecință, se observă o scădere a concentrației de hormoni produși de acesta - trofismul endometrului este perturbat, se formează modificările degenerative.
Morfologic regresează endometrul, apar semne de ischemie. În același timp, suculența tisulară scade, ceea ce duce la încrețirea stromului stratului funcțional. Plierea pereților glandelor crește. În ziua de 26-27 a ciclului menstrual, în zonele superficiale ale stratului compact, se observă dilatații lacunare ale capilarelor și hemoragii focale în stroma; datorită topirii structurilor fibroase apar zone de separare a celulelor stromale și epiteliului glandelor. Această afecțiune a endometrului se numește „menstruație anatomică” și precedă imediat menstruația clinică.
Faza de sângerare, descuamare (28-29 zile ale ciclului menstrual). În mecanismul sângerării menstruale, rolul principal este acordat tulburărilor circulatorii cauzate de spasmul prelungit al arterelor (staza, cheaguri de sânge, fragilitatea și permeabilitatea peretelui vascular, hemoragii în stroma, infiltrarea leucocitelor). Rezultatul acestor transformări este necrobioza tisulară și topirea acesteia. Datorită vasodilatației care apare după un spasm prelungit, o cantitate mare de sânge intră în țesutul endometrial, ceea ce duce la ruperea vaselor de sânge și respingerea - descrierea - secțiunilor necrotice ale stratului funcțional al endometrului, adică. la hemoragii menstruale.
Țesuturile țintă sunt punctele de aplicare a acțiunii hormonilor sexuali. Acestea includ: țesutul creierului, organele genitale, glandele mamare, foliculii de păr și pielea, oasele, țesutul adipos. Celulele acestor organe și țesuturi conțin receptori pentru hormonii sexuali. Mediatorul acestui nivel de reglare a sistemului reproductiv este cAMP, care reglează metabolismul în celulele țesutului țintă în conformitate cu nevoile organismului ca răspuns la hormoni. Regulatoarele intercelulare includ, de asemenea, prostaglandine, care sunt formate din acizi grași nesaturați din toate țesuturile corpului. Acțiunea prostaglandinelor se realizează prin cAMP.
Creierul este un organ țintă pentru hormonii sexuali. Hormonii sexuali prin factori de creștere pot afecta atât neuronii cât și celulele gliale. Hormonii sexuali afectează formarea de semnale în acele zone ale sistemului nervos central care sunt implicate în reglarea comportamentului reproductiv (ventromedial, hipotalamic și amigdala), precum și în zonele care reglează sinteza și eliberarea hormonilor de către glanda hipofizară (în nucleul hipotalamic arcat și în preoptic) zonă).
În hipotalamus, ținta principală pentru hormonii sexuali sunt neuronii care formează nucleul arcuat, în care GnRH este sintetizat, eliberat într-un mod pulsat. Opioidele pot avea un efect excitant și inhibitor asupra neuronilor care sintetizează GnRH în hipotalamus. Estrogenii stimulează sinteza receptorilor opioizi endogeni. β-endorfina (β-EP) este cea mai activă peptidă opioidă endogenă care influențează comportamentul, induce analgezie, este implicată în termoreglare și are proprietăți neuroendocrine. La femeile aflate în postmenopauză și după ooforectomie, nivelul r-EF scade, ceea ce contribuie la apariția bufeurilor și la transpirația crescută, precum și la modificări ale stării de spirit, ale comportamentului și ale tulburărilor moniceptive. Estrogenii excită sistemul nervos central printr-o creștere a sensibilității receptorilor la neurotransmițătorii neuronilor sensibili la estrogen, ceea ce duce la creșterea stării de spirit, a creșterii activității și a efectelor antidepresive. Nivelurile scăzute de estrogen în timpul menopauzei sunt asociate cu dezvoltarea depresiei.
Androgenii joacă, de asemenea, un rol în comportamentul sexual al femeii, răspunsurile emoționale și funcția cognitivă. Deficitul de androgeni în menopauză duce la scăderea creșterii părului pubian, forța musculară și scăderea libidoului.
Tuburile uterine
Starea funcțională a trompelor uterine variază în funcție de faza ciclului menstrual. Deci, în faza luteală a ciclului, este activat aparatul ciliat al epiteliului ciliat, înălțimea celulelor sale crește, peste partea apicală din care se acumulează secretul. Tonul stratului muscular al tuburilor se modifică și: până la momentul ovulației, se înregistrează o scădere și creștere a contracțiilor lor, care au atât un pendul, cât și o natură de rotație-translație. Activitatea musculară este inegală în diferite părți ale organului: undele peristaltice sunt mai caracteristice părților distale. Activarea aparatului ciliat al epiteliului ciliat, labilitatea tonului muscular al trompelor uterine în faza luteală, asincronismul și variabilitatea activității contractile în diferite părți ale organului sunt toate determinate pentru a asigura condiții optime pentru transportul gameților.
În plus, în diferite faze ale ciclului menstrual, natura microcirculației în vasele trompelor se schimbă. În perioada ovulației, venele, care acoperă în mod obișnuit pâlnia și pătrund adânc în franjurile sale, se revarsă de sânge, ca urmare a creșterii tonului fimbriei și pâlnia, apropiindu-se de ovar, o acoperă, care, în paralel cu alte mecanisme, asigură intrarea oului ovulat în tub. Când stagnarea sângelui în venele inelare ale pâlniei se oprește, aceasta din urmă se îndepărtează de suprafața ovarului.
vaginul
În timpul ciclului menstrual, structura epiteliului vaginal suferă faze proliferative și regresive. Faza proliferativă corespunde stadiului foliculin al ovarelor și se caracterizează prin proliferarea, mărirea și diferențierea celulelor epiteliale. În perioada corespunzătoare fazei foliculare timpurii, creșterea epiteliului are loc în principal datorită celulelor stratului bazal, până la mijlocul fazei, conținutul de celule intermediare crește. În perioada pre-ovulatoare, când epiteliul vaginal atinge o grosime maximă de 150-300 microni, se observă activarea maturării celulelor stratului de suprafață.
Faza regresivă corespunde stadiului luteal. În această fază, creșterea epiteliului se oprește, grosimea acestuia scade și unele dintre celule suferă o dezvoltare inversă. Faza se încheie cu descuamarea celulelor în grupuri mari și compacte.
Glandele mamare se măresc în timpul ciclului menstrual, începând din momentul ovulației și ajungând la maximum până în prima zi de menstruație. Înainte de menstruație, există o creștere a fluxului de sânge, o creștere a conținutului de lichide în țesutul conjunctiv, dezvoltarea edemului interlobular, extinderea canalelor interlobulare, ceea ce duce la o creștere a glandei mamare.
Reglarea neurohumorală a ciclului menstrual
Reglarea ciclului menstrual normal se realizează la nivelul neuronilor specializați din creier, care primesc informații despre starea mediului intern și extern, îl transformă în semnale neurohormonale. Acestea din urmă prin sistemul de neurotransmițători intră în celulele neurosecretorii ale hipotalamusului și stimulează secreția de GnRH. GnRH prin rețeaua circulatorie locală a sistemului portal hipotalamo-hipofizar pătrunde direct în adenohipofiză, unde asigură secreția circhorală și eliberarea de gonadotropine glicoproteine: FSH și LH. Acestea intră în ovare prin sistemul circulator: FSH stimulează creșterea și maturarea foliculului, LH - steroidogeneză. Sub influența FSH și LH, ovarele produc estrogeni și progesteron cu participarea PRL, care, la rândul lor, provoacă transformări ciclice în organele țintă: uter, trompe uterine, vagin, precum și în piele, foliculi de păr, oase, țesut adipos, creierul.
Starea funcțională a sistemului reproducător este reglementată de anumite legături de legătură între subsistemele sale constitutive:
a) o buclă lungă între ovare și nucleele hipotalamusului;
b) o buclă lungă între hormonii ovarieni și hipofiza;
c) o buclă ultrashortă între hormonul care eliberează gonadotropină și neurocitele hipotalamice.
Relația dintre aceste subsisteme se bazează pe principiul feedback-ului, care are atât caracter negativ (interacțiune de tip „plus-minus”) cât și pozitiv (interacțiune de tip „plus-plus”). Armonia proceselor care apar în sistemul reproducător este determinată de: utilitatea stimulării gonadotrope; funcționarea normală a ovarelor, în special desfășurarea corectă a proceselor din veziculele graaf și corpul luteum care se formează la locul ei; interacțiunea corectă a legăturilor periferice și centrale - aferenta inversă.
Rolul prostaglandinelor în reglarea sistemului reproducător feminin
Prostaglandinele reprezintă o clasă specială de substanțe biologic active (acizi grași hidroxilați nesaturați) care se găsesc în aproape toate țesuturile corpului. Prostaglandinele sunt sintetizate în interiorul celulei și eliberate în aceleași celule pe care acționează. Prin urmare, prostaglandinele sunt numite hormoni celulari. Corpul uman îi lipsește o sursă de prostaglandine, deoarece sunt inactivate într-o perioadă scurtă de timp când intră în fluxul sanguin. Estrogenii și oxitocina cresc sinteza prostaglandinelor, progesteronului și prolactinei au un efect inhibitor. Medicamentele antiinflamatoare nesteroidiene au un efect puternic antiprostaglandin.
Rolul prostaglandinelor în reglarea sistemului reproducător feminin:
1. Participarea la procesul de ovulație. Sub influența estrogenilor, conținutul prostaglandinelor din celulele granuloase atinge maximul până la ovulație și asigură o ruptură a peretelui matric folicul (prostaglandinele cresc activitatea contractilă a elementelor musculare netede ale membranei foliculului și reduc formarea colagenului). Prostaglandinele sunt, de asemenea, atribuite capacității de luteoliză - regresia corpusului luteum.
2. Transportul oului. Prostaglandinele afectează activitatea contractilă a trompelor uterine: în faza foliculară determină contracția părții istmice a tuburilor, în faza luteală - relaxarea acesteia, creșterea peristaltismului ampulei, ceea ce contribuie la pătrunderea ovulului în cavitatea uterină. În plus, prostaglandinele acționează asupra miometrului: de la colțurile tubare spre fundul uterului, efectul stimulant al prostaglandinelor este înlocuit cu unul inhibitor și, astfel, favorizează nidarea blastocistului.
3. Reglarea sângerărilor menstruale. Intensitatea menstruației este determinată nu numai de structura endometrului în momentul respingerii acestuia, ci și de activitatea contractilă a miometrului, arteriolelor și agregării plachetare.
Aceste procese sunt strâns legate de gradul de sinteză și degradare a prostaglandinelor.
Ciclu menstrual - modificări repetate ciclic în corpul femeii, în special în legăturile sistemului reproducător, a căror manifestare externă sângerează din tractul genital - menstruație. Ciclul menstrual se stabilește după menarche (prima menstruație) și persistă în perioada reproducătoare sau reproductivă, din viața unei femei, cu capacitatea de a reproduce urmași. Modificările ciclice ale corpului unei femei sunt bifazice. Prima fază (foliculară) a ciclului este determinată de maturizarea foliculului și ovulul în ovar, după care acesta se rupe și ovulul îl părăsește - ovulația. A doua fază (luteală) este asociată cu formarea corpusului luteum.
În același timp, într-un mod ciclic în endometru, se produce secvențial regenerarea și proliferarea stratului funcțional, urmată de activitatea secretorie a glandelor sale. Schimbările endometrului se termină cu descuamarea stratului funcțional (menstruație). Semnificația biologică a modificărilor care apar în timpul ciclului menstrual în ovare și endometru este de a asigura funcția de reproducere în etapele de maturare a ovulului, fertilizarea și implantarea embrionului în uter. Dacă nu are loc fertilizarea ovulului, stratul funcțional al endometrului este respins, apare descărcarea sângeroasă din tractul genital, iar în sistemul reproducător, procesele apar din nou și în aceeași secvență menite să asigure maturizarea ovulului.
Menstruaţie - Aceasta este o sângerare repetitivă din tractul genital la intervale regulate pe întreaga perioadă de reproducere a vieții unei femei în afara sarcinii și alăptării. Menstruația este punctul culminant al ciclului menstrual și apare la sfârșitul fazei luteale ca urmare a respingerii stratului funcțional al endometrului. Prima perioadă (menarhe) are loc între 10 și 12 ani. În următorii 1 - 1,5 ani, menstruația poate fi neregulată și abia atunci este stabilit un ciclu menstrual regulat. Prima zi de menstruație se ia în mod convențional ca prima zi a ciclului, iar durata ciclului este calculată ca intervalul dintre primele zile din următoarele două perioade.
ginecologia ovulației reproductive menstruale
Fig. 1. Reglarea hormonală a ciclului menstrual (diagrama): a - creierul; b - modificări ale ovarului; c - modificarea nivelului hormonal; d - modificări ale endometrului
Parametri externi ai ciclului menstrual normal: durata de la 21 la 35 de zile (pentru 60% dintre femei, durata medie a ciclului este de 28 de zile); durata fluxului menstrual de la 2 la 7 zile; cantitatea de pierdere de sânge în zilele menstruale este de 40-60 ml (în medie 50 ml).
Procesele care asigură evoluția normală a ciclului menstrual sunt reglementate de un singur sistem neuroendocrin funcțional, care include diviziuni centrale (integratoare) și structuri periferice (efectoare) cu un anumit număr de legături intermediare. În conformitate cu ierarhia lor (de la structurile de reglementare superioare la organele direct direct), în reglarea neuroendocrine se pot distinge 5 niveluri, interacționând după principiul relațiilor directe și invers pozitive și negative (Fig.)
Primul (cel mai înalt) nivel de reglementare funcționarea sistemului reproducător sunt structuri care alcătuiesc acceptorul tuturor influențelor externe și interne (din departamentele subordonate) - cortexul cerebral al sistemului nervos central și structurile cerebrale extrahipotalamice (sistemul limbic, hipocampul, amigdala). Adecvarea percepției sistemului nervos central asupra influențelor externe și, în consecință, influența acestuia asupra departamentelor subordonate care reglementează procesele din sistemul reproducător depinde de natura stimulilor externi (forța, frecvența și durata acțiunii lor), precum și de starea inițială a sistemului nervos central, care afectează rezistența sa la stres. loturile.
Este bine cunoscut despre posibilitatea încetării menstruației în timpul stresului sever (pierderea persoanelor dragi, condiții de război etc.), precum și fără influențe externe evidente cu dezechilibru mental general („falsă sarcină” - menstruație întârziată cu dorință puternică sau cu frică puternică) a rămâne însărcinată). Părțile reglatoare superioare ale sistemului reproductiv percep influențe interne prin receptori specifici pentru principalii hormoni sexuali: estrogeni, progesteron și androgeni. Ca răspuns la stimuli externi și interni din cortexul cerebral și structurile extrahipotalamice, are loc sinteza, eliberarea și metabolismul neuropeptidelor, neurotransmițătorilor, precum și formarea receptorilor specifici, care la rândul lor afectează selectiv sinteza și eliberarea hormonului de eliberare hipotalamică. Cei mai importanți neurotransmițători, adică. substanțele emițătoare includ norepinefrină, dopamină, acid gamma-aminobutiric (GABA), acetilcolină, serotonină și melatonină. Neurotransmițătorii cerebrali reglează producerea hormonului care eliberează gonadotropină (GnRH): norepinefrină, acetilcolină și GABA stimulează eliberarea lor, în timp ce dopamina și serotonina au efectul opus.
neuropeptides (peptidele opioide endogene - EOP, factorul care eliberează corticotropina și galanina) afectează, de asemenea, funcția hipotalamusului și funcționarea echilibrată a tuturor părților sistemului reproducător. În prezent, există 3 grupuri de EOP: encefaline, endorfine și dinorfine. Aceste substanțe se găsesc nu numai în diferite structuri ale creierului și ale sistemului nervos autonom, ci și în ficat, plămâni, pancreas și alte organe, precum și în unele fluide biologice (plasma sanguină, conținutul foliculilor). Conform conceptelor moderne, PES sunt implicate în reglementarea formării GnRH. O creștere a nivelului de EOP suprima secreția de GnRH și, în consecință, eliberarea de LH și FSH, care poate fi cauza anovulării și, în cazuri mai severe, amenoree. Cu o creștere a EOP, apariția diferitelor forme de amenoree de geneză centrală este asociată cu stresul, precum și cu efort fizic excesiv, de exemplu, la sportivi. Numirea inhibitorilor receptorilor opioizi (medicamente precum naloxonă) normalizează formarea GnRH, ceea ce contribuie la normalizarea funcției ovulatorii și a altor procese din sistemul reproducător la pacienții cu amenoree centrală. Cu o scădere a nivelului de steroizi sexuali (cu închiderea funcțională ovariană legată de vârstă sau chirurgicală), EOP nu are un efect inhibitor asupra eliberării GnRH, care devine probabil cauza creșterii producției de gonadotropine la femeile aflate în postmenopauză. Astfel, echilibrul sintezei și transformărilor metabolice ulterioare ale neurotransmițătorilor, neuropeptidelor și neuromodulatoarelor în neuronii creierului și în structurile suprahipotalamice asigură desfășurarea normală a proceselor asociate funcției ovulatorii și menstruale.
Al doilea nivel de reglementare funcția reproductivă este hipotalamusul, în special zona sa hipofizară, formată din neuroni ai nucleelor \u200b\u200barcuite ventro- și dorsomediale, care au activitate neurosecretorie. Aceste celule au proprietățile atât ale neuronilor (reproducerea impulsurilor electrice regulatoare) cât și a celulelor endocrine, care au fie un efect stimulator (liberine), fie blocante (statine). Activitatea neurosecreției în hipotalamus este reglată atât de hormonii sexuali, care provin din fluxul sanguin, cât și de neurotransmițătorii și neuropeptidele, formate în cortexul cerebral și structurile suprahipotalamice. Hipotalamusul secretă GnRH, care conține hormoni de stimulare a foliculilor (RGFSH - foliberină) și hormoni luteinizanti (RHLH - luliberină) care acționează asupra glandei hipofizare. Hormonul care eliberează LH (RHLH - luliberină) a fost izolat, sintetizat și descris în detaliu. Până în prezent, nu a fost posibil să se izoleze și să sintetizeze hormonul care eliberează foliculul-stimulator. Cu toate acestea, s-a constatat că RHLH decapeptidă și analogii săi sintetici stimulează eliberarea gonadelor de către otrofe nu numai de LH, ci și de FSH. În acest sens, a fost adoptat un termen pentru liberinele gonadotrope - hormonul care eliberează gonadotropina (GnRH), care este în esență un sinonim pentru RHLH. De asemenea, liberina hipotalamică, care stimulează formarea de prolactină, nu a fost identificată, deși s-a stabilit că sinteza acesteia este activată de hormonul care eliberează TSH (tiroliberina). Producția de prolactină este activată și de serotonină și de peptide opioide endogene care stimulează sistemele serotonergice. Dopamina, pe de altă parte, inhibă eliberarea de prolactină din lactotrofele adenohipofizei. Utilizarea medicamentelor dopaminergice precum parlodelul (bromocriptina) poate trata cu succes hiperprolactinemia funcțională și organică, care este o cauză foarte frecventă a tulburărilor menstruale și ovulatorii. Secreția de GnRH este programată genetic și are o natură pulsatorie (circhorală): vârfurile secreției hormonale crescute care durează câteva minute sunt înlocuite cu intervale de 1-3 ore de activitate secretorie relativ redusă. Frecvența și amplitudinea secreției de GnRH este reglată de nivelul de estradiol - eliberarea de GnRH în perioada preovulatoare pe fundalul eliberării maxime de estradiol este semnificativ mai mare decât în \u200b\u200bfazele foliculare și luteale timpurii.
Al treilea nivel de reglementare funcția reproductivă este glanda hipofizară anterioară, în care se secretă hormonii gonadotropi - hormonul stimulator al foliculilor, sau folitropina (FSH) și luteinizarea, sau lutropina (LH), prolactina, hormonul adrenocorticotropic (ACTH), hormonul somatotropic (STH) și hormonul stimulator tiroidian TTG). Funcționarea normală a sistemului de reproducere este posibilă numai cu o alocare echilibrată a fiecăruia dintre ele. FSH stimulează creșterea și maturizarea foliculilor din ovar, proliferarea celulelor granuloase; formarea receptorilor FSH și LH pe celulele granuloase; activitatea aromatazei în foliculul matur (aceasta îmbunătățește conversia androgenilor în estrogeni); producerea de inhibină, activină și factori de creștere ca insulina LH promovează formarea de androgeni în celulele teca; ovulația (împreună cu FSH); remodelarea celulelor granuloase în timpul luteinizării; sinteza progesteronului în corpul luteum. Prolactina are o varietate de efecte asupra corpului unei femei. Rolul său biologic principal este acela de a stimula creșterea glandelor mamare, de a regla lactația și, de asemenea, de a controla secreția de progesteron de corpul luteum, activând formarea receptorilor pentru LH în ea. În timpul sarcinii și alăptării, inhibarea sintezei de prolactină se oprește și, ca urmare, o creștere a nivelului său în sânge. ...
La al patrulea nivel reglarea funcției reproductive include organe endocrine periferice (ovare, glande suprarenale, glanda tiroidă). Rolul principal aparține ovarelor, iar alte glande își îndeplinesc propriile funcții, păstrând în același timp funcționarea normală a sistemului reproducător. În ovare, creșterea și maturarea foliculilor, ovulația, formarea corpusului luteum, sinteza de steroizi sexuali. La naștere, ovarele unei fete conțin aproximativ 2 milioane de foliculi primordiali. Cei mai mulți dintre ei suferă modificări atretice de-a lungul vieții și doar o parte foarte mică trece prin ciclul complet de dezvoltare de la primordial la matur, cu formarea ulterioară a unui corp luteum. Până la menarche, ovarele conțin 200-400 de mii de foliculi primordiali. În timpul unui ciclu menstrual, de regulă, se dezvoltă doar un singur folicul cu un ovul în interior. În cazul maturizării unui număr mai mare, sunt posibile sarcini multiple.
foliculogeneza începe sub influența FSH în partea târzie a fazei luteale a ciclului și se termină la începutul vârfului eliberării gonadotropinelor. Cu aproximativ 1 zi înainte de debutul menstruației, nivelul FSH crește din nou, ceea ce asigură intrarea în creștere sau recrutarea foliculilor (1-4 zile ale ciclului), selecția foliculului dintr-o cohortă omogenă - cvasi-sincronizată (5-7 zile), maturarea foliculului dominant (a 8-12-a zi) și a ovulației (a 13-15-a zi). Acest proces, care constituie faza foliculară, durează aproximativ 14 zile. Ca urmare, se formează un folicul preovulator, iar restul cohortei de foliculi care au intrat în creștere suferă de atrezie. Selecția unui singur folicul ovulant este inseparabilă de sinteza estrogenilor din el. Stabilitatea producției de estrogen depinde de interacțiunea dintre celulele teca și granuloasă, a cărei activitate este, la rândul ei, modulată de numeroase mecanisme endocrine, paracrine și autocrine care reglează creșterea și maturarea foliculilor. În funcție de stadiul de dezvoltare și de semnele morfologice, se disting foliculii primordiali, preantrali, antrali și preovulatori sau dominanți. Foliculul primordial este format dintr-un ovul imatur, care se află în epiteliul folicular și granular (granular). În exterior, foliculul este înconjurat de o membrană de țesut conjunctiv (celule teca). În timpul fiecărui ciclu menstrual, 3 - 30 foliculi primordiali încep să crească, transformându-se în foliculii preantrali (primari). Foliculul preantral. În foliculul preantral, ovocitul crește ca mărime și este înconjurat de o membrană numită zona pellucida. Celulele epiteliului granuloase proliferează și se rotunjesc pentru a forma stratul granular al foliculului (strat granulosum), iar stratul de teacă este format din stroma înconjurătoare. Această etapă se caracterizează prin activarea producției de estrogeni formați în stratul de granuloză.
Foliculul preovulator (dominant) (Fig. 2.2) se remarcă printre foliculii în creștere cu dimensiunea cea mai mare (diametrul la momentul ovulației ajunge la 20 mm). Foliculul dominant are un strat bogat vascularizat de celule teca și granuloză cu un număr mare de receptori FSH și LH. Împreună cu creșterea și dezvoltarea foliculului preovulator dominant în ovare, atresia foliculilor rămași care au intrat inițial în creștere (recrutată) apare în paralel, iar atresia foliculilor primordiali continuă. În timpul maturizării, în foliculul preovulator apare o creștere de 100 de ori a volumului de lichid folicular. În procesul de maturizare a foliculilor antrali, compoziția lichidului folicular se modifică.
Folicul antral (secundar) suferă o creștere a cavității formată de lichidul folicular acumulat produs de celulele stratului de granuloză. De asemenea, crește activitatea formării steroizilor sexuali. Androgenii (androstenedione și testosteron) sunt sintetizați în celulele teca. Odată ajuns în celulele granuloase, androgenii sunt aromatizați activ, determinând transformarea lor în estrogeni. În toate etapele dezvoltării foliculare, cu excepția preovulatoriei, conținutul de progesteron este la un nivel constant și relativ scăzut. Întotdeauna există mai puține gonadotropine și prolactină în lichidul folicular decât în \u200b\u200bplasma sanguină, iar nivelul de prolactină tinde să scadă pe măsură ce foliculul se maturizează. FSH este determinat de la începutul formării cavității, iar LH poate fi detectat doar într-un folicul preovulator matur împreună cu progesteronul. Lichidul folicular conține de asemenea oxitocină și vasopresină, iar în concentrații de 30 de ori mai mari decât în \u200b\u200bsânge, ceea ce poate indica formarea locală a acestor neuropeptide. Prostaglandinele de clasă E și F sunt detectate numai în foliculul preovulator și numai după debutul creșterii nivelurilor de LH, ceea ce indică implicarea directă a acestora în procesul de ovulație.
ovulaţia - ruperea foliculului preovulator (dominant) și eliberarea unui ovul din acesta. Ovulația este însoțită de sângerare din capilarele distruse care înconjoară celulele teca (Fig. 2.3). Se crede că ovulația are loc la 24 până la 36 de ore după vârful preovulator al estradiolului, ceea ce determină o creștere accentuată a secreției de LH. În acest context, sunt activate enzimele proteolitice - colagenază și plasmină, care distrug colagenul peretelui foliculului și reduc astfel rezistența acestuia. În același timp, creșterea observată a concentrației de prostaglandină F2a, precum și oxitocină, induce ruperea foliculului ca urmare a stimulării lor de contracție musculară netedă și de expulzare a ovocitului cu movila purtătoare de ou din cavitatea foliculului. Ruptura foliculului este facilitată și de o creștere a concentrației de prostaglandină E2 și relaxină, care reduc rigiditatea pereților săi. După eliberarea ovulului, capilarele formate cresc rapid în cavitatea foliculului ovulat. Celulele granulare suferă de luteinizare, care se manifestă morfologic într-o creștere a volumului lor și în formarea incluziunilor lipidice. Acest proces, care conduce la formarea unui corp luteum, este stimulat de LH, care interacționează activ cu receptorii specifici ai celulelor granuloase.
corpus luteum - educație tranzitorie hormonală activă, care funcționează timp de 14 zile, indiferent de durata totală a ciclului menstrual. Dacă sarcina nu a avut loc, corpul luteum regresează. Un luteum corpus complet se dezvoltă numai în faza când un număr adecvat de celule granuloase cu un conținut ridicat de receptori LH se formează în foliculul preovulator. În perioada de reproducere, ovarele sunt principala sursă de estrogeni (estradiol, estriol și estrone), dintre care estradiolul este cel mai activ. Pe lângă estrogeni, progesteronul și o anumită cantitate de androgeni sunt produși în ovare. În plus față de hormonii steroizi și inhibințele care intră în fluxul sanguin și care afectează organele țintă, compușii biologic activi cu un efect predominant hormonal local sunt sintetizați în ovare. Astfel, prostaglandinele, oxitocina și vasopresina formate joacă un rol important ca declanșatori ai ovulației. Oxitocina are, de asemenea, un efect luteolitic, oferind o regresie a corpului luteum. Relaxina promovează ovulația și are un efect tocolitic asupra miometrului. Factorii de creștere - factorul de creștere epidermică (EGF) și factorii de creștere asemănători insulinei 1 și 2 (IPFR-1 și IPFR-2) activează proliferarea celulelor granuloase și maturarea foliculelor. Aceiași factori sunt implicați, împreună cu gonadotropinele, în reglarea fină a selecției foliculului dominant, atresia foliculilor degeneratori din toate stadiile, precum și în încheierea funcționării corpului luteum. Formarea de androgeni în ovare rămâne stabilă pe tot parcursul ciclului. Principalul scop biologic al secreției ciclice a steroizilor sexuali în ovar este de a regla modificările fiziologice fiziologice din endometru. Hormonii ovarieni nu numai că determină modificări funcționale în sistemul reproducător în sine. De asemenea, afectează activ procesele metabolice din alte organe și țesuturi care au receptori pentru steroizi sexuali. Acești receptori pot fi atât citoplasmici (receptori citosolici) cât și nucleari.
Receptorii citoplasmici sunt strict specifici estrogenilor, progesteronului și testosteronului, iar receptorii nucleari pot fi acceptoare nu numai de hormoni steroizi, ci și de aminopeptide, insulină și glucagon. Pentru legarea receptorului de progesteron, glucocorticoizii sunt considerați antagoniști. La nivelul pielii, sub influența estradiolului și a testosteronului, se activează sinteza de colagen, care ajută la menținerea elasticității acestuia. Creșterea uleiului, acneei, foliculitei, porozității și creșterii excesive a părului sunt asociate cu expunerea crescută la androgeni. În oase, estrogeni, progesteron și androgeni susțin remodelarea normală prin prevenirea resorbției osoase. În țesutul adipos, echilibrul de estrogeni și androgeni determină atât activitatea metabolismului său, cât și distribuția în organism. Steroizii sexuali (progesteron) modulează în mod semnificativ centrul hipotalamic de termoreglare. Cu receptorii pentru steroizi sexuali în sistemul nervos central, în structurile hipocampului care reglează sfera emoțională, precum și în centrele care controlează funcțiile autonome, se asociază fenomenul „valului menstrual” din zilele anterioare menstruației. Acest fenomen se manifestă printr-un dezechilibru în procesele de activare și inhibare a cortexului, fluctuații ale tonului sistemelor simpatice și parasimpatice (afectând în mod vizibil funcționarea sistemului cardiovascular), precum și modificări ale dispoziției și o anumită iritabilitate. Cu toate acestea, la femeile sănătoase, aceste schimbări nu depășesc granițele fiziologice.
Al cincilea nivel reglarea funcției reproductive este alcătuită din părți interne și externe ale sistemului reproducător (uter, trompe uterine, mucoasă vaginală), sensibile la fluctuațiile nivelurilor de steroizi sexuali, precum și ale glandelor mamare. Cele mai pronunțate modificări ciclice apar în endometru.
Modificări ciclice în endometru atinge-i stratul de suprafață, format din celule epiteliale compacte, și cel intermediar, care sunt respinse în timpul menstruației. Stratul bazal, care nu este respins în timpul menstruației, asigură refacerea straturilor descuamate. Conform modificărilor endometrului în timpul ciclului, se disting faza de proliferare, faza de secreție și faza de sângerare (menstruație).
Faza de proliferare ("folicular") durează în medie 12-14 zile, începând cu ziua 5. În această perioadă, se formează un nou strat de suprafață cu glande tubulare alungite căptușite cu epiteliu cilindric cu activitate mitotică crescută. Grosimea stratului funcțional al endometrului este de 8 mm.
Faza de secreție (luteală) asociate cu activitatea corpului luteum, durează 14 zile (+ 1 zi). În această perioadă, epiteliul glandelor endometriale începe să producă un secret care conține glicozaminoglicani acide, glicoproteine, glicogen. Activitatea de secreție devine cea mai mare în ziua de 20-21. Până în acest moment, cantitatea maximă de enzime proteolitice se regăsește în endometru, iar transformările decidurale apar în stroma (celulele stratului compact se măresc, dobândind o formă rotunjită sau poligonală, glicogenul se acumulează în citoplasmă). Există o vascularizare ascuțită a stromei - arterele spiralate sunt răsucite brusc, formând „încurcături” care se găsesc în întregul strat funcțional. Venele sunt dilatate. Astfel de modificări ale endometrului, remarcate în ziua de 20-22a (6-8 zi după ovulație) a ciclului menstrual de 28 de zile, oferă cele mai bune condiții pentru implantarea unui ovul fecundat. Până în ziua de 24-27, datorită debutului regresiei corpului luteum și a scăderii concentrației de hormoni produși de acesta, trofismul endometrului este perturbat cu o creștere treptată a modificărilor degenerative din acesta. Granulele care conțin relaxină sunt eliberate din celulele granulare ale stromului endometrial, care pregătește respingerea menstruală a membranei mucoase. În zonele superficiale ale stratului compact, se remarcă expansiunea lacunară a capilarelor și hemoragiilor în stroma, care poate fi detectată în 1 zi. înainte de debutul menstruației.
Menstruaţie include descuamarea și regenerarea stratului funcțional al endometrului. În legătură cu regresia corpului luteum și o scădere accentuată a conținutului de steroizi sexuali din endometru, hipoxia crește. Debutul menstruației este facilitat de spasmul prelungit al arterelor, ceea ce duce la staza de sânge și formarea cheagurilor de sânge. Hipoxia tisulară (acidoză tisulară) este agravată de permeabilitatea endotelială crescută, fragilitatea pereților vasului, numeroase hemoragii minore și infiltrare masivă de leucocite. Enzimele proteolitice lisozomale secretate din leucocite sporesc topirea elementelor tisulare. În urma unui vasospasm prelungit, expansiunea lor paretică are loc cu creșterea fluxului de sânge. În același timp, există o creștere a presiunii hidrostatice în patul microcirculator și ruperea pereților vaselor de sânge, care în acest moment își pierd în mare măsură rezistența mecanică. În acest context, are loc descuamarea activă a zonelor necrotice ale stratului funcțional. Până la sfârșitul primei zile de menstruație, 2/3 din stratul funcțional este respins, iar descuamarea completă a acestuia se termină de obicei în a 3-a zi. Regenerarea endometrială începe imediat după respingerea stratului funcțional necrotic.
Baza regenerării este celulele epiteliale ale stromului stratului bazal. În condiții fiziologice, deja în a 4-a zi a ciclului, întreaga suprafață a plăgii a membranei mucoase este epiteliată. Aceasta este urmată de modificări ciclice în endometru - fazele de proliferare și secreție. Modificări consecutive în întregul ciclu în endometru: proliferarea, secreția și menstruația depind nu numai de fluctuațiile ciclice ale nivelurilor de steroizi sexuali din sânge, dar și de starea receptorilor tisulari pentru acești hormoni. Concentrația receptorilor nucleari pentru estradiol crește până la mijlocul ciclului, atingând un vârf până la sfârșitul perioadei fazei de proliferare endometrială. După ovulație, există o scădere rapidă a concentrației receptorilor nucleari pentru estradiol, continuând până în faza secretorie târzie, când expresia lor devine mult mai mică decât la începutul ciclului. S-a stabilit că inducerea formării receptorilor atât pentru estradiol cât și pentru progesteron depinde de concentrația de estradiol în țesuturi. În faza proliferativă timpurie, conținutul receptorilor de progesteron este mai mic decât cel al estradiolului, dar apoi apare o creștere pre-ovulatoare a nivelului receptorilor progesteronici.
După ovulație, nivelul receptorilor nucleari de progesteron atinge valoarea maximă pentru întregul ciclu. În faza proliferativă, estradiolul stimulează direct formarea receptorilor de progesteron, ceea ce explică absența unei relații între nivelul de progesteron din plasmă și conținutul receptorilor săi din endometru. Reglarea concentrației locale de estradiol și progesteron este mediată în mare măsură de apariția diverselor enzime în timpul ciclului menstrual. Conținutul de estrogeni din endometru depinde nu numai de nivelul lor în sânge, ci și de educație. Endometrul unei femei este capabil să sintetizeze estrogenii prin transformarea androstenedione și testosteron cu participarea aromatazei (aromatizare). Această sursă locală de estrogen îmbunătățește estrogenarea celulelor endometriale, ceea ce caracterizează faza proliferativă. În această fază, se remarcă cea mai mare capacitate de aromatizare a androgenilor și cea mai mică activitate a enzimelor care metabolizează estrogenul. Recent, s-a stabilit că endometrul este de asemenea capabil să secrete prolactină, care este complet identic cu hipofiza. Sinteza prolactinei de către endometru începe în a doua jumătate a fazei luteale (activată de progesteron) și coincide cu decidualizarea celulelor stromale. Activitatea ciclică a sistemului reproducător este determinată de principiile directului și feedback-ului, care este furnizat de receptori specifici pentru hormoni în fiecare dintre legături. O legătură directă constă în efectul stimulant al hipotalamusului asupra glandei hipofizare și în formarea ulterioară a steroizilor sexuali în ovar. Feedback-ul este determinat de influența concentrației crescute de steroizi sexuali asupra nivelurilor superioare. În interacțiunea legăturilor sistemului reproducător, există bucle „lungi”, „scurte” și „ultrashort”. Bucla „lungă” - efectul prin intermediul receptorilor sistemului hipotalamico-hipofizar asupra producției de hormoni sexuali. Bucla „scurtă” definește legătura dintre glanda hipofizară și hipotalamus. Bucla „ultrashort” este o legătură între hipotalamus și celulele nervoase, care realizează reglarea locală cu ajutorul neurotransmițătorilor, neuropeptidelor, neuromodulatorilor și stimulilor electrici.
Evaluarea stării sistemului reproductiv conform testelor de diagnosticare funcțională... Timp de mulți ani în practica ginecologică, au fost utilizate așa-numitele teste de diagnosticare funcțională a stării sistemului reproducător. Valoarea acestor studii destul de simple a supraviețuit până în zilele noastre. Măsurarea cea mai frecvent utilizată a temperaturii bazale, evaluarea fenomenului de „pupilă” și a mucusului cervical (cristalizare, extensibilitate), precum și calculul indicelui kariopicototic (KPI,%) al epiteliului vaginal.
Test de temperatură bazală bazat pe capacitatea progesteronului (într-o concentrație crescută) de a determina restructurarea centrului hipotalamic de termoreglare, ceea ce duce la o reacție hipertermică tranzitorie. Temperatura se măsoară zilnic dimineața în rect, fără a te ridica din pat. Rezultatele sunt prezentate grafic. Într-un ciclu menstrual normal bifazic, temperatura bazală crește în faza de progesteron cu 0,4-0,8 ° C. În ziua menstruației sau cu 1 zi înainte de debutul acesteia, temperatura bazală scade. Un ciclu persistent în două faze (temperatura bazală trebuie măsurată pe 2-3 cicluri menstruale) indică faptul că s-a produs ovulația și un corp luteum activ funcțional. Lipsa unei creșteri a temperaturii în a doua fază a ciclului indică anovulare, o întârziere a creșterii și / sau a duratei sale scurte (o creștere a temperaturii cu 2-7 zile) - o scurtare a fazei luteale, o creștere insuficientă (cu 0,2-0,3 ° C) - - lipsa funcției corpului luteum. Un rezultat fals pozitiv (o creștere a temperaturii bazale în absența corpului luteum) poate apărea în infecții acute și cronice, cu unele modificări ale sistemului nervos central, însoțite de excitabilitate crescută. Simptom de elev reflectă cantitatea și starea secrețiilor mucoase din canalul cervical, care depind de saturația de estrogen a organismului. Cea mai mare cantitate de mucus cervical se formează în timpul ovulației, cel mai puțin - înainte de menstruație. Fenomenul „elevului” se bazează pe extinderea osului extern al canalului cervical datorită acumulării de mucus vitros transparent în colul uterin. În zilele preovulatorii, deschiderea externă dilatată a canalului cervical seamănă cu o elevă. Fenomenul „elevului”, în funcție de gravitatea acestuia, este estimat cu 1-3 plusuri. Testul nu poate fi utilizat pentru modificări patologice la nivelul colului uterin.
Evaluarea calității mucusului cervical reflectă cristalizarea și gradul de tensiune. Cristalizarea (fenomenul „ferigă”) al mucusului cervical atunci când este uscat este cel mai pronunțat în timpul ovulației, apoi scade treptat și înainte de menstruația este absentă. Cristalizarea mucusului uscat în aer este, de asemenea, evaluată în puncte (de la 1 la 3). Tensiunea mucusului cervical depinde de saturația estrogenului. Cu un forcepsang, mucusul este îndepărtat din canalul cervical, fălcile instrumentului sunt împinse în afară, determinând gradul de tensiune. Înainte de menstruație, lungimea firului este maximă (12 cm). Mucusul poate fi afectat negativ de inflamația organelor genitale, precum și dezechilibrul hormonal.
Indicele cariopycnotic... Fluctuațiile ciclice ale hormonilor ovarieni sunt asociate cu modificări ale compoziției celulare a mucoasei endometriale. Într-un frotiu din vagin, în funcție de caracteristicile morfologice, se disting 4 tipuri de celule ale epiteliului stratificat scuamoase:
- a) keratinizarea;
- b) intermediar;
- c) parabazal;
- d) bazal. Indicele cariopycnotic (KPI) este raportul dintre numărul de celule cu un nucleu picnotic (adică celule keratinizante) și numărul total de celule epiteliale dintr-un frotiu, exprimat în procente.
În faza foliculară a ciclului menstrual, KPI este de 20-40%, în zilele preovulatorii crește la 80-88%, iar în faza luteală a ciclului scade la 20-25%. Astfel, raporturile cantitative ale elementelor celulare din frotiile mucoasei vaginale ne permit să apreciem saturația corpului cu estrogeni.