Bolile ereditare sunt boli a căror apariție și dezvoltare sunt asociate cu tulburări complexe în aparatul ereditar al celulelor transmise prin gameți (celule reproductive). Apariția unor astfel de afecțiuni este cauzată de tulburări în procesele de stocare, implementare și transmitere a informațiilor genetice.
Cauzele bolilor ereditare
La baza bolilor acestui grup se află mutațiile informațiilor genice. Ele pot fi detectate la un copil imediat după naștere sau pot apărea la un adult după mult timp.
Apariția bolilor ereditare poate fi asociată cu doar trei motive:
- Perturbarea cromozomilor. Aceasta este adăugarea unui cromozom suplimentar sau pierderea unuia dintre cei 46.
- Modificări ale structurii cromozomilor. Bolile sunt cauzate de modificările care apar în celulele reproducătoare ale părinților.
- Mutații genetice. Bolile apar din cauza mutațiilor ambelor gene individuale și din cauza perturbării unui complex de gene.
Mutațiile genetice sunt clasificate ca predispuse ereditar, dar manifestarea lor depinde de influența mediului extern. De aceea, cauzele unor astfel de boli ereditare precum diabetul zaharat sau hipertensiunea arterială, pe lângă mutații, includ, de asemenea, o alimentație proastă, suprasolicitarea prelungită a sistemului nervos și traumele mentale.
Tipuri de boli ereditare
Clasificarea unor astfel de boli este strâns legată de cauzele apariției lor. Tipurile de boli ereditare sunt:
- boli genetice - apar ca urmare a leziunilor ADN-ului la nivel de gene;
- boli cromozomiale - asociate cu o anomalie complexă a numărului de cromozomi sau cu aberațiile acestora;
- boli cu predispoziție ereditară.
Pentru un tratament de calitate, cunoașterea bolilor umane ereditare nu este suficientă, este imperativ să le identificăm în timp sau probabilitatea apariției lor. Pentru a face acest lucru, oamenii de știință folosesc mai multe metode:
- Genealogic. Prin studierea pedigree-ului unei persoane, este posibil să se identifice caracteristicile de moștenire atât ale caracteristicilor normale, cât și ale patologice ale corpului.
- Geamănă. Acest diagnostic de boli ereditare este un studiu al asemănărilor și diferențelor dintre gemeni pentru a identifica influența mediului extern și a eredității asupra dezvoltării diferitelor boli genetice.
- citogenetic. Studiul structurii cromozomilor la persoanele bolnave și sănătoase.
- Metoda biochimică. Observarea caracteristicilor.
În plus, aproape toate femeile sunt supuse examinărilor cu ultrasunete în timpul sarcinii. Face posibilă identificarea malformațiilor congenitale pe baza caracteristicilor fetale, începând din primul trimestru și, de asemenea, suspectarea prezenței anumitor boli ereditare ale sistemului nervos sau boli cromozomiale la copil.
Prevenirea bolilor ereditare
Până de curând, nici măcar oamenii de știință nu știau care sunt posibilitățile de tratare a bolilor ereditare. Dar studiul patogenezei  a făcut posibilă găsirea unei modalități de vindecare a anumitor tipuri de boli. De exemplu, defectele cardiace astăzi pot fi tratate cu succes chirurgical.
a făcut posibilă găsirea unei modalități de vindecare a anumitor tipuri de boli. De exemplu, defectele cardiace astăzi pot fi tratate cu succes chirurgical.
Multe boli genetice, din păcate, nu au fost pe deplin studiate. Prin urmare, în medicina modernă, se acordă o mare importanță prevenirii bolilor ereditare.
Metodele de prevenire a apariției unor astfel de boli includ planificarea nașterii și refuzul de a naște un copil în cazurile cu risc ridicat de patologie congenitală, întreruperea sarcinii în cazul unei probabilități mari de boli fetale, precum și corectarea manifestării genotipurilor patologice. .
Cunoașterea naturii genetice a multor defecte biochimice congenitale ne permite să abordăm îndeaproape problema tratamentului și prevenirii acestora (Fig. 10). După cum am menționat mai devreme, consecințele unei mutații genice pentru organism se reduc în multe cazuri la acumularea de cantități mari de substanță ca urmare a deficienței de enzime. De exemplu, în cazul fenilcetonuriei, concentrațiile mari de fenilalanină și fenilpiruvat în țesuturi duc la suprimarea proceselor de absorbție a glucozei și, prin urmare, la lipsa de energie. Pentru a reduce concentrația acestor substanțe în organism, imediat după depistarea fenilcetonuriei, copilului i se prescrie o dietă care conține cantități foarte mici de fenilalanină. Atunci când se folosește o astfel de dietă „sintetică” pentru un număr de ani, manifestările clinice ale fenilcetonuriei la astfel de copii sunt slab exprimate sau complet absente.
O altă metodă de tratament este stimularea activității reziduale a enzimei mutante. Astfel, în cazul unui defect genetic al glucozo-6-fosfatazei hepatice, una dintre formele de glicogenoză la copii, se utilizează inducerea unei enzime anormale cu ajutorul cortizonului, un hormon suprarenal. În homocistinurie, s-au efectuat studii pe cistationin sintetaza, o enzimă defectuoasă în această boală. Ca urmare, a fost dezvoltat un regim de tratament cu vitamina B6, bazat pe inducerea activității enzimei mutante și s-a obținut o îmbunătățire clinică semnificativă.
Din păcate, în majoritatea cazurilor de defecte biochimice genetice cunoscute, nu este posibilă selectarea unei diete adecvate sau inducerea unei enzime inactive. În acest sens, se încearcă în mod constant găsirea unei modalități de a livra o enzimă normală la locul său de activitate normală din organism. Pentru o serie de mutații genetice, succesul temporar a fost obținut prin perfuzarea pacienților cu o masă de globule albe normale.
Inducţie - stimularea sintezei acestei enzime ca răspuns la un efect specific.
În prezent, este posibilă purificarea și izolarea multor enzime într-o formă destul de pură. Pentru a proteja aceste proteine pe drumul lor către țesuturile pacienților de distrugerea de către enzimele serice, sunt utilizate diverse „capsule” biologice.
„Ingineria genetică”, principiile și dificultățile sale. Geneticienii microbieni au folosit de multă vreme fenomenul de transformare și transducție genetică. Transformarea genetică a caracteristicilor individuale ale bacteriilor are loc atunci când li se adaugă ADN dintr-o altă varietate. De exemplu, la pneumococii care nu au mucoasă, apare la ceva timp după ce sunt tratați cu un preparat ADN obținut din bacterii din linia „mucoasei”. Transformarea genetică este posibilă și pentru celulele umane. ADN-ul care transformă trăsăturile genetice pare a fi încorporat în genomul celulei și funcționează activ ca o unitate genetică. Cu toate acestea, „grefarea” genelor în acest fel în întregul organism al unui pacient mutant este foarte dificilă. Faptul este că în fluidele și celulele biologice, ADNazele sunt foarte active - enzime care distrug ADN-ul introdus.
Până de curând, transducția genelor părea posibilă doar în lumea bacteriilor. Conceptul de „transducție” poate fi definit ca transferul uneia sau al unui grup de gene de la o celulă la alta folosind un virus. Transducția genetică cea mai amănunțită studiată implică unul dintre virusurile umane Escherichia coli, cunoscut sub numele de fagul lambda.
Când o celulă bacteriană este infectată de fagul lambda, ADN-ul viral este integrat în cromozomul circular al celulei gazdă. Celula infectată nu moare și, înmulțindu-se, reproduce genomul fagului în număr nenumărat. Când virusul este activat din nou și distruge celula gazdă, particulele fagice nou formate, pe lângă genele lor, pot conține și gene bacteriene. Astfel, s-au putut obține linii de fag lambda, care au în lor
conține gena pentru galactoză-1-fosfat uridiltransferaza, o enzimă importantă în metabolismul zahărului.
Transplantul acestei gene în celule umane a avut succes în 1971 de către oamenii de știință americani Merrill, Geyer și Petricciani. Obiectele din aceste experimente au fost celulele pielii de la pacienți cu o lipsă de activitate a galactozei-1-fosfat uridil transferazei (galactozemie). Donatorul a fost fagul lambda menționat mai sus care conține această genă de origine microbiană. În celulele infectate ale pacienților cu galactozemie a apărut activitatea galactoz-1-fosfat uridil transferazei. Astfel, transplantul de gene de la bacterii la oameni a devenit un fapt. Activitatea enzimatică dobândită de celule a fost moștenită de celulele fiice, adică gena transplantată nu a fost „respinsă”.
Mesajul senzațional de la oamenii de știință americani a stârnit un interes larg răspândit. S-a deschis perspectiva tratării erorilor înnăscute severe ale metabolismului. Cu toate acestea, munca în această direcție nu promite un succes imediat. Problema este de a obține o gamă suficientă de viruși purtători de anumite gene care se pot integra în genomul celulelor umane din organism.
Recent, au fost dezvoltate tehnici de sinteză a genelor individuale. Astfel, poliribozomii au fost izolați din globulele roșii de iepure și din acestea - mARN-ul globinei (partea proteică a hemoglobinei). Este relativ ușor de izolat din aceste celule diferențiate. Apoi, folosind enzima virală ADN polimeraza dependentă de ARN, oamenii de știință americani au sintetizat pentru prima dată o copie ADN a acestui ARNm. Cu toate acestea, această metodă poate obține doar o regiune structurală a unei gene fără „anexe” de reglementare importante. Cu toate acestea, metodele de obținere a genelor „in vitro” sunt de mare interes.
Consultatie medicala genetica. În ciuda progreselor semnificative în tratamentul bolilor ereditare, rolul principal în lupta împotriva acestora revine prevenției. S-au înregistrat progrese semnificative în această direcție.
Măsurile preventive pot fi luate în diferite direcții. Aceasta include studiul mecanismelor specifice ale procesului de mutație, monitorizarea nivelului de radiații și a efectelor diverșilor mutageni. Dezvoltarea patologică a corpului, moartea unui embrion, făt sau copil poate fi cauzată de oricare dintre tipurile cunoscute de mutații. Mutațiile care duc la moartea fătului în timpul perioadei prenatale sau la scurt timp după naștere sunt numite letale. Studiul mecanismelor efectelor letale ale mutațiilor cromozomiale și genetice abia a început, dar este de mare importanță pentru prevenirea patologiei ereditare.
La fel de importantă este și prevenirea infecțiilor și a leziunilor, care în multe cazuri contribuie la manifestarea sau agravarea unei boli ereditare. Efectele nocive ale factorilor de mediu care interacționează cu factorii genetici afectează în special perioada embrionară a dezvoltării organismului. Vârsta înaintată a mamei are, de asemenea, un efect semnificativ, crescând riscul ca aceasta să aibă urmași bolnavi.
În prezent, consilierea medicală genetică este de cea mai mare importanță pentru prevenirea bolilor ereditare. În acest scop, s-au desfășurat consultații medico-genetice speciale sau săli medico-genetice la mari asociații de tratament și prevenție, unde este posibilă efectuarea unor metode speciale de cercetare - citologice, biochimice și imunologice.
Consilierea genetică în scop preventiv este cea mai eficientă nu atunci când se aplică după nașterea unui copil bolnav, ci atunci când se evaluează gradul de risc ca un cuplu de părinți să aibă copii cu orice defecte genetice, mai ales în cazurile în care există sau se suspectează o patologie ereditară. în familie.
Întrebări despre prognosticul medical și genetic pentru urmași pot apărea și în rândul persoanelor dintr-o căsătorie consanguină, în rândul soților care au o discrepanță în factorul sanguin Rh, precum și în cazurile în care femeile au avorturi repetate și nașteri morti. În prezent, a fost dovedit rolul semnificativ al anomaliilor cromozomiale în nașterea mortii și avorturile spontane.
Consilierea genetică medicală se bazează pe stabilirea naturii moștenirii în fiecare caz concret. Se determină calculul riscului de boală
gradul condiționalității sale ereditare și tipul de transmitere ereditară. Cu moștenirea dominantă a unei gene patologice, 50% dintre copii se vor îmbolnăvi și își vor transmite boala generației următoare. Restul de 50% vor rămâne sănătoși și vor avea urmași complet sănătoși.
Cu moștenire autosomal recesivă, în cazurile în care ambii părinți sunt purtători heterozigoți ai unei gene mutante, 25% dintre copiii lor vor fi bolnavi (homozigoți), 50% sunt sănătoși din punct de vedere fenotipic, dar sunt purtători heterozigoți ai aceleiași gene mutante, pe care o pot transmite. pentru descendenții lor, 25 % rămân indemne de boală. Pentru bolile cu transmitere recesivă, căsătoriile consanguine sunt contraindicate. Din acest punct de vedere, pare o sarcină importantă identificarea heterozigozității la membrii unei familii împovărate și în populație în general, deoarece purtătorii heterozigoți ai genei mutante sunt cei care își mențin concentrația constantă în populație.
Când moștenește boli legate de sex (cromozomul X), o femeie sănătoasă din punct de vedere fenotipic transmite boala la jumătate dintre fiii săi bolnavi. Jumătate dintre fiicele ei sunt și purtătoare ale genei mutante, fiind aparent sănătoase.
Uneori, a da o concluzie se dovedește a fi foarte dificil. Acest lucru se datorează faptului că există o serie de boli care sunt similare în manifestarea lor cu cele ereditare, dar sunt cauzate de influența factorilor de mediu (așa-numitele fenocopii); multe boli ereditare au variații semnificative în manifestarea lor (așa-numitul polimorfism).
Nu orice boală congenitală și nu orice boală familială este ereditară, la fel cum nu orice boală cu etiologie ereditară este congenitală sau familială. Acest lucru este valabil mai ales pentru malformațiile congenitale, care în unele cazuri pot fi cauzate nu de mecanisme genetice, ci de efectele patogene asupra fătului în timpul sarcinii. Astfel, în unele țări străine, femeile care au luat somnifere în timpul sarcinii au născut copii cu deformări.
Probabilitatea de a moșteni o genă patologică într-o familie cu antecedente familiale rămâne aceeași pentru fiecare copil ulterior, indiferent dacă copilul născut anterior era sănătos sau bolnav.
În cazurile în care tipul de transmitere ereditară a unei gene mutante nu poate fi stabilit sau este de natură poligenică, consilierea genetică medicală se bazează pe probabilitatea stabilită empiric de risc de a avea un copil bolnav. Consilierea genetică medicală, bazată pe calcularea gradului de risc de îmbolnăvire la rudele pacienților, a devenit recent din ce în ce mai specifică datorită extinderii capacităților de diagnosticare pentru purtarea heterozigotă. Metodele de detectare a transportului heterozigot au fost dezvoltate de mult timp, dar determinarea sa fiabilă a devenit posibilă numai în legătură cu progresul metodelor de diagnostic biochimic. În prezent, transportul heterozigot a fost stabilit pentru mai mult de 200 de boli, ceea ce este necesar pentru consultarea medicală și genetică bazată științific.
Diagnosticul prenatal poate fi considerat o metodă foarte promițătoare pentru prevenirea bolilor ereditare. Dacă se suspectează nașterea unui copil cu defect ereditar, se face amniocenteză la 14-16 săptămâni de sarcină și se obține o anumită cantitate de lichid amniotic. Conține celule epiteliale descuamate ale embrionului. Studiul acestui material face posibilă determinarea unui defect ereditar chiar înainte de nașterea unui copil. În prezent, această metodă poate diagnostica mai mult de 50 de boli metabolice ereditare și toate bolile cromozomiale.
Medicul care dă sfaturi genetice medicale explică persoanei consultate gradul de risc de apariție a bolii la copiii sau rudele acestuia. Decizia finală aparține persoanei care este consultată; medicul nu îi poate interzice să aibă copii, ci doar îl ajută să evalueze în mod realist gradul de pericol. Cu explicația medico-genetică corectă, pacientul ia de obicei singur decizia corectă. Un rol semnificativ îl joacă nu numai amploarea riscului, ci și severitatea patologiei ereditare:
deformări semnificative, demență severă. În aceste cazuri, mai ales dacă în familie există un astfel de copil, chiar și cu o boală rară, soții limitează în continuare nașterea. Uneori se întâmplă ca gradul de risc de a avea un copil cu o patologie ereditară să fie exagerat de membrii familiei, iar sfatul medicului alungă temerile nefondate.
ÎNCĂRCARE DE PATOLOGIE EREDITARĂ ÎN ASPECTE MEDICALE ȘI SOCIALE
Fiecare familie visează să aibă copii sănătoși. Acest lucru devine deosebit de relevant după nașterea unui copil bolnav. Numărul în scădere a copiilor în familiile din țările dezvoltate face ca rezultatul optim al fiecărei sarcini să fie extrem de important. În acest sens, prevenirea bolilor ereditare ar trebui să ocupe un loc de frunte atât în activitatea medicului, cât și în sistemul de sănătate.
Se știe că toată patologia ereditară este determinată de încărcătura mutațiilor care apar din nou și sunt moștenite de la generațiile anterioare. Efectele procesului de mutație pentru populaţiile umane se exprimă în aspecte evolutiv-genetice, medicale şi sociale. Consecințele genetice evolutive ale procesului de mutație (polimorfism echilibrat, letalitate) sunt discutate în Capitol. 1.
Consecințele medicale ale încărcării mutaționale - nevoia crescută de îngrijiri medicale și speranța de viață redusă bolnav.
Îngrijirea medicală este acordată persoanelor cu boli ereditare în ambulatoriu de 5-6 ori mai des decât persoanelor fără o astfel de patologie. În spitalele generale de copii, între 10 și 20% dintre pacienți sunt copii cu patologii ereditare, ceea ce este de 5-10 ori mai mare decât frecvența acestor pacienți în populație. Vizitele mai dese la medic ale persoanelor cu patologii ereditare sunt destul de de înțeles, la fel ca și spitalizarea lor mai îndelungată. În primul rând, boala în sine necesită o cantitate mare de îngrijire medicală și, uneori, un tratament constant. În al doilea rând, o boală ereditară nu exclude arsurile, traumatismele și bolile infecțioase. Dimpotrivă, ei
* Corectat și completat cu participarea dr. dr. miere. Științe T.I. Subbotina.
apar mai des, sunt mai severe și durează mai mult datorită capacității mai reduse de menținere a homeostaziei biochimice, imune și hormonale la pacienții cu patologie ereditară.
Într-o formă generalizată, consecințele medicale ale malformațiilor congenitale și ale bolilor ereditare sunt prezentate în tabel. 11.1.
Tabelul 11.1. Consecințele anomaliilor congenitale de diferite tipuri în țările dezvoltate (pe baza materialelor de la Organizația Mondială a Sănătății)
Speranța de viață a pacienților cu patologie ereditară depinde nu numai de boală în sine, ci și de nivelul de îngrijire medicală. Deși încă nu s-au făcut estimări exacte, pentru țările cu un sistem de sănătate bine dezvoltat se poate presupune cu mare încredere că cel puțin 50% din toți pacienții cu boli ereditare mor în copilărie. În Canada, a fost efectuată o evaluare cuprinzătoare a speranței de viață pentru toți pacienții cu patologie ereditară (cu vârste diferite de debut a bolilor și severitate diferită a acestora). S-a dovedit a fi cu 20 de ani mai puțin decât media națională (50 de ani în loc de 70).
Importanța socială și medicală a prevenirii bolilor ereditare este evidențiată de nivelul ridicat de handicap al pacienților și de costurile economice ale întreținerii acestora. De mulți ani, astfel de pacienți rămân cu dizabilități și nu pot avea grijă de ei înșiși. În pensiile pentru copii cu dizabilități, costul mediu pe copil pe lună este egal cu salariul mediu lunar pe țară. Astfel de copii trăiesc în școli-internat în medie 10 ani. Din cei 1 milion de nou-născuți, aproximativ 5.000 sunt candidați pentru dizabilitate severă pe termen lung din copilărie.
Alături de semnificația medicală și socială a prevenirii bolilor ereditare, nu mai puțin importante sunt aspecte psihologiceîntr-o familie cu un copil bolnav. Severitatea și progresia evoluției bolii creează, după cum arată observațiile, tensiune psihologică chiar și în familiile foarte unite. Soții sau rudele află (sau bănuiesc) cine este vinovat pentru nașterea unui copil bolnav. Membrii familiei au opinii diferite despre transferul unui copil la un internat (abandonarea copilului), mai ales dacă acesta a locuit cu părinții săi. Îngrijirea constantă a unui copil bolnav necesită costuri materiale mari, forță morală și fizică, care într-un fel sau altul duce la conflicte. Preocuparea pentru un copil bolnav este însoțită de teama pentru o posibilă îmbolnăvire la alți copii.
Deși bolile ereditare, dintr-un punct de vedere comun, sunt rare, viața unei anumite familii se concentrează asupra copilului bolnav.
În fine, necesitatea prevenirii bolilor ereditare este dictată de modele de populație distributia lor. Cu o îngrijire medicală îmbunătățită, pacienții nu numai că vor trăi mai mult, ceea ce crește automat numărul de pacienți cu patologie ereditară în populație, ci și transmite mutațiile generațiilor ulterioare. De exemplu, în ultimii 100 de ani în Anglia, frecvența unei gene mutante care provoacă stenoză pilorică congenitală a crescut. Operația de tăiere a mușchiului piloric a transformat această anomalie dintr-o condamnare la moarte într-o cicatrice pe peretele abdominal. Purtătorii genei mutante (după intervenție chirurgicală nu mai sunt bolnavi în sens strict) lasă urmași, dintre care unii au și gena mutantă, iar noi cazuri de boală apar suplimentar în populație ca urmare a procesului de mutație.
Datorită mărimii planificate a familiei (de obicei 1-3 copii), diferența dintre numărul de copii dintre soții sănătoși și cei împovărați ereditar este în mare măsură echilibrată (compensarea reproductivă). Selecția naturală încetează să regleze numărul descendenților. În familiile împovărate ereditar există mai multe sarcini (este clar că unele sarcini se termină cu moartea puilor în orice stadiu al dezvoltării intrauterine), dar numărul copiilor în viață este același ca în familiile neîmpovărate. Unii dintre acești copii sunt heterozigoți, drept urmare un nivel crescut de reproducere al alelelor mutante este menținut artificial.
BAZELE GENETICE DE PREVENIRE A PATOLOGIEI EREDITARICE
Dispoziții generale
Din punct de vedere preventiv, se recomandă împărțirea tuturor patologiilor ereditare în 3 categorii:
Mutații nou apărute (în primul rând aneuploidii și forme severe de mutații dominante);
Moștenit de la generațiile anterioare (atât genetice, cât și cromozomiale);
Boli cu predispoziție ereditară. Există 3 tipuri de prevenire a patologiei ereditare.
Prevenție primară
Prevenția primară se referă la acțiunile care ar trebui să prevină conceperea unui copil bolnav; aceasta este planificarea nașterii și îmbunătățirea mediului uman.
Planificarea copilăriei include 3 pozitii principale:
Vârsta optimă de reproducere, care pentru femei este de 21-35 de ani (sarcinile mai devreme sau ulterioare cresc probabilitatea de a avea un copil cu patologie congenitală și boli cromozomiale) (vezi Fig. 5.29);
Refuzul de a naște copii în cazurile cu risc crescut de patologie ereditară și congenitală (în absența unor metode fiabile de diagnostic prenatal, tratament, adaptare și reabilitare a pacienților);
Refuzul de a avea copii în căsătoriile cu rude de sânge și între doi purtători heterozigoți ai unei gene patologice.
Îmbunătățirea habitatului controlul uman ar trebui să vizeze în principal prevenirea mutațiilor nou apărute printr-un control strict al conținutului de agenți mutageni și teratogeni din mediu. Acest lucru este deosebit de important pentru prevenirea întregului grup de boli genetice somatice (malformații congenitale, neoplasme maligne, stări de imunodeficiență etc.).
Prevenție secundară
Prevenirea secundară presupune întreruperea sarcinii cu o probabilitate mare de boală fetală sau prenatală
boala diagnosticata. Sarcina poate fi întreruptă numai în intervalul de timp prescris și cu acordul femeii. Baza pentru eliminarea unui embrion sau făt este o boală ereditară.
Întreruperea sarcinii nu este cea mai bună soluție, dar până acum este singura metodă de prevenire secundară a celor mai severe și fatale defecte genetice.
Prevenție terțiară
Prevenirea terțiară a patologiei ereditare este înțeleasă ca corectarea manifestării genotipurilor patologice. Acesta poate fi numit și copiere standard,întrucât cu un genotip patologic se străduiesc să obţină un fenotip normal.
Prevenția terțiară se realizează atât pentru bolile ereditare, cât și (mai ales des) pentru bolile cu predispoziție ereditară. Cu ajutorul acestuia, puteți obține normalizarea completă a funcțiilor sau puteți reduce severitatea procesului patologic. Pentru unele forme de patologie ereditară, aceasta poate coincide cu măsuri terapeutice în sens medical general.
Dezvoltarea unei boli ereditare (copierea normelor) poate fi prevenită în uter sau după naștere.
Pentru unele boli ereditare este posibil tratamentul intrauterin (de exemplu, cu incompatibilitate Rh, unele acidurie, galactozemie).
Dezvoltarea bolii poate fi prevenită în prezent prin corectare (tratament) după nașterea pacientului. Exemplele tipice de boli pentru care prevenirea terțiară este eficientă includ galactozemia, fenilcetonuria, hipotiroidismul (vezi mai jos), etc. De exemplu, boala celiacă apare odată cu începerea hrănirii complementare a copilului. Baza bolii este intoleranța la gluten. Excluderea acestei proteine din alimente garantează complet ameliorarea patologiei gastrointestinale severe.
Prevenirea bolilor ereditare și a bolilor cu predispoziție ereditară ar trebui să includă mai multe etape și să fie efectuată la nivel de populație. Ideile moderne despre patologia ereditară și capacitățile metodologice fac posibilă realizarea prevenirii la diferite niveluri de ontogeneză. Caracteristicile și obiectivele lor sunt prezentate în tabel. 11.2.
Tabelul 11.2. Caracteristicile principalelor tipuri de programe de prevenire genetică a populației

După cum se vede din tabel. 11.2, măsurile preventive pot fi efectuate înainte de concepție și se încheie cu o anchetă generală a populației. În acest caz, este recomandabil să folosiți simultan două abordări fundamental diferite: familia și populația. Fiecare dintre aceste abordări are propriile capacități de rezoluție și limitări.
Baza modernă pentru prevenirea patologiei ereditare o reprezintă evoluțiile teoretice în domeniul naturii moleculare a bolilor ereditare, mecanismele și procesele dezvoltării lor în perioadele pre și postnatale, modelele de conservare a mutațiilor (și uneori răspândite) în familii și populațiilor, precum și studiul proceselor de apariție și formare a mutațiilor în celulele germinale și somatice.
În termeni genetici, există 5 abordări pentru prevenirea patologiei ereditare, care sunt discutate mai jos.
Controlul expresiei genetice
La mijlocul anilor 20 ai secolului XX. experimentele au scos la iveală fenomenele de penetrare și expresivitate, care au devenit în curând subiect de studiu în genetica medicală. S-a notat mai sus
N.K. Koltsov a formulat conceptul de „eufenism”, prin care a înțeles formarea calităților bune sau corectarea manifestărilor dureroase ale eredității la o persoană prin crearea unor condiții adecvate (medicamente, dietă, educație etc.). Aceste idei au început să fie implementate abia în anii 60 ai secolului XX, când s-au acumulat informații despre produsele primare ai genei patologice și mecanismele moleculare ale patogenezei bolilor ereditare. Cunoscând mecanismele de acțiune ale genelor patologice, este posibil să se dezvolte metode pentru corectarea lor fenotipică, cu alte cuvinte,
Pe măsură ce știința progresează, se acumulează informații despre metodele de prevenire a patologiei ereditare în diferite etape ale ontogenezei - asupra influențelor terapeutice sau dietetice. Un exemplu clinic de control al expresiei genelor care a fost deja supus unor teste practice pe termen lung este prevenirea consecințelor fenilcetonuriei, galactozemiei și hipotiroidismului congenital. Tabloul clinic al acestor boli se formează în perioada postnatală timpurie și, prin urmare, principiul prevenției terțiare este relativ simplu. Boala trebuie diagnosticată în câteva zile după naștere pentru a se aplica imediat un tratament profilactic pentru a preveni dezvoltarea fenotipului patologic (tabloul clinic). Copierea normală poate fi realizată prin metode dietetice (pentru fenilcetonurie, galactozemie) sau medicinale (pentru hipotiroidism).
Corectarea manifestării genelor patologice poate începe din stadiul embrionar de dezvoltare. Bazele așa-zisului preconcepţia şi prevenirea perinatală a bolilor ereditare(cu câteva luni înainte de concepție și înainte de naștere). De exemplu, o dietă cu hipofenilalanină pentru mamă în timpul sarcinii reduce manifestările fenilcetonuriei în perioada postnatală la copil. S-a observat că anomaliile congenitale ale tubului neural (moștenirea poligenă) sunt mai puțin frecvente la copiii femeilor care primesc cantități suficiente de vitamine. Testele ulterioare au arătat că dacă femeile sunt tratate cu o dietă cu hipervitamine (vitamina C, E, acid folic) timp de 3-6 luni înainte de concepție și în timpul primelor luni de sarcină, probabilitatea ca copilul să dezvolte anomalii ale tubului neural este semnificativ redusă. Acest lucru este important pentru familiile care au deja copii bolnavi, precum și pentru populațiile cu o incidență mare a bolilor patologice
gene ice (de exemplu, pentru anomalii congenitale ale tubului neural în rândul populației Irlandei). Pentru mai multe informații despre problemele de prevenire preconcepțională a sănătății reproducerii, vezi articolul lui L.F. Afumat pe un CD.
În viitor, pot fi dezvoltate noi metode de corecție intrauterină a expresiei patologice a genelor, ceea ce este deosebit de important pentru familiile în care întreruperea sarcinii este inacceptabilă din motive religioase.
Tabelul 11.3 oferă exemple de anomalii congenitale pentru care au fost deja dezvoltate metode de tratament intrauterin.
Tabelul 11.3. Exemple de tratament intrauterin al bolilor congenitale

Experiența cu terapia prenatală pentru fetușii de sex feminin cu deficit de 21-hidroxilază poate servi ca punct de plecare pentru dezvoltarea tratamentelor pentru alte boli ereditare. Tratamentul se efectuează conform următorului plan.
Femeilor însărcinate cu risc de a avea un copil cu hiperplazie suprarenală congenitală li se prescrie dexametazonă (20 mcg/kg) înainte de a 10-a săptămână de sarcină, indiferent de starea și sexul fătului. Dexametazona suprimă secreția de androgeni de către glandele suprarenale fetale. În același timp, este necesar să se efectueze diagnosticul prenatal al sexului fătului și diagnosticul ADN al mutațiilor genei (prin biopsie a vilozităților coriale sau amniocenteză). Dacă se constată că fătul de sex masculin sau feminin nu este afectat, atunci terapia prenatală este oprită, iar dacă fătul
se constată că femelele au mutații în stare homozigotă, apoi tratamentul este continuat până la naștere.
Este puțin probabil ca tratamentul prenatal cu doze mici de dexametazonă să provoace reacții adverse. La observarea copiilor sub 10 ani, nu au fost găsite anomalii. Femeile care primesc dexametazonă prezintă efecte secundare minore (fluctuații de dispoziție, creștere în greutate, creșterea tensiunii arteriale, disconfort general), dar sunt dispuse să suporte aceste neplăceri de dragul sănătății fiicelor lor. Rezultatele pozitive ale tratării fetușilor de sex feminin cu deficit de 21-hidroxilază (sindrom adrenogenital) depășesc semnificativ aspectele negative.
Prevenirea terțiară bazată pe controlul expresiei genice este deosebit de importantă și eficientă pentru prevenirea bolilor cu predispoziție ereditară. Excluderea din mediu a factorilor care contribuie la dezvoltarea unui fenotip patologic și, uneori, îl condiționează, este o cale directă către prevenirea unor astfel de boli.
Toate formele monogenice de predispoziție ereditară pot fi prevenite prin excluderea factorilor manifestatori din mediu, în primul rând agenții farmacologici la purtătorii deficienței G6PD, pseudocolinesterazei anormale și acetiltransferazei mutante. În aceste cazuri, vorbim despre intoleranța primară (congenitală) la medicamente, și nu despre o boală medicamentoasă dobândită (vezi capitolul 8).
Pentru a lucra în condiții industriale care provoacă condiții morbide la persoanele cu alele mutante (de exemplu, contact cu plumb, pesticide, agenți oxidanți), este necesar să se selecteze lucrătorii în conformitate cu principiile stabilite (vezi capitolul 7).
Deși prevenirea afecțiunilor multifactoriale este mai complexă, deoarece acestea sunt cauzate de interacțiunea mai multor factori de mediu și complexe poligenice, cu istoricul familial corect și analiza genetică moleculară a markerilor polimorfi ai genelor de susceptibilitate la boli, este posibil să se identifice „slabe” legături în sănătatea individului și creează condiții favorabile pentru încetinirea sau oprirea dezvoltării unei boli multifactoriale (medicina preventivă). Pe acest principiu se bazează prevenirea hipertensiunii arteriale, a aterosclerozei și a cancerului pulmonar.
Eliminarea embrionilor și a fetușilor cu patologie ereditară
Mecanismele de eliminare a embrionilor și fetușilor neviabile au fost dezvoltate evolutiv. La om, acestea sunt avorturi spontane și nașteri premature. Desigur, nu toate apar din cauza inferiorității embrionului sau fătului; Unele dintre ele sunt legate de condițiile de gestație, de exemplu. cu starea corpului feminin. Cu toate acestea, cu siguranță în cel puțin 50% din cazurile de sarcină întreruptă, fetușii au fie malformații congenitale, fie boli ereditare.
Astfel, eliminarea embrionilor și a fetușilor cu patologii ereditare înlocuiește avortul spontan ca fenomen natural. Tehnicile de diagnostic prenatal evoluează rapid, astfel încât această abordare preventivă devine din ce în ce mai importantă. Stabilirea unui diagnostic de boală ereditară la făt servește ca indicație pentru întreruperea sarcinii.
Procedura de diagnostic prenatal și mai ales întreruperea sarcinii trebuie efectuată cu acordul femeii. După cum am menționat mai sus, în unele familii, din motive religioase, sarcina nu poate fi întreruptă.
Selecția naturală la om în perioada prenatală a permis embriologului american J. Workani să formuleze conceptul în 1978 teratanasia. Termenul „teratanasia” se referă la procesul natural de cernere (sau îndepărtare) a fetușilor cu patologie congenitală. Teratanasia poate fi efectuată prin crearea unor condiții „intolerabile” pentru un făt cu o patologie, deși astfel de condiții sunt destul de acceptabile pentru un făt normal. Acești factori par să dezvăluie o stare patologică și, în același timp, provoacă moartea fătului. Câteva dovezi experimentale în favoarea acestui punct de vedere sunt deja disponibile. Dezvoltarile științifice pot avea ca scop găsirea de metode pentru moartea selectivă indusă a unui făt cu genotip patologic. Metodele trebuie să fie fiziologice pentru mamă și absolut sigure pentru un făt normal.
Inginerie genetică la nivel de celule germinale
Prevenirea bolilor ereditare poate fi cea mai completă și eficientă dacă în zigot este inserată o genă care funcționează pentru a o înlocui pe cea mutantă. Eliminarea cauzei unei boli ereditare (și acesta este tocmai aspectul cel mai fundamental al
prevenire) înseamnă o manipulare destul de serioasă a informației genetice la zigot. Aceasta poate fi: introducerea unei alele normale în genom prin transfecție, mutația inversă a unei alele patologice, activarea unei gene normale dacă este blocată, oprirea unei gene mutante. Complexitățile acestor probleme sunt evidente, dar dezvoltările experimentale intensive în domeniul ingineriei genetice indică posibilitatea fundamentală de a le rezolva. Prevenirea prin inginerie genetică a bolilor ereditare nu a mai devenit o utopie, ci o perspectivă, deși una îndepărtată.
Precondițiile pentru corectarea genelor umane în celulele germinale au fost deja create. Ele pot fi rezumate după cum urmează.
Decodificarea genomului uman a fost finalizată, mai ales la nivel de secvențiere a alelelor normale și patologice. Genomica funcțională se dezvoltă rapid, datorită căreia vor fi cunoscute interacțiunile intergenice.
Nu este dificil să obțineți gene umane în forma lor pură pe baza sintezei chimice sau biologice. Interesant este că gena globinei umane a fost una dintre primele gene produse artificial.
Au fost dezvoltate metode pentru includerea genelor în genomul uman cu diferiți vectori sau în forma lor pură prin transfecție.
Metodele de mutageneză chimică direcționată fac posibilă inducerea unor mutații specifice într-un locus strict definit (obținerea de mutații inverse - de la o alele patologice la una normală).
Experimentele pe diferite animale au furnizat dovezi ale transfectării genelor individuale în stadiul zigot (drosophila, șoarece, capră, porc etc.). Genele introduse funcționează în organismul receptor și sunt moștenite, deși nu întotdeauna conform legilor mendeliane. De exemplu, gena pentru hormonul de creștere a șobolanului, introdusă în genomul zigoților de șoarece, funcționează la șoarecii născuți. Astfel de șoareci transgenici sunt semnificativ mai mari ca dimensiune și greutate corporală decât șoarecii normali.
Prevenirea prin inginerie genetică a bolilor ereditare la nivel de zigot este încă slab dezvoltată, deși alegerea metodelor de sinteză a genelor și a metodelor de livrare a acestora la celule este deja destul de largă. Rezolvarea problemelor transgenozei la oameni astăzi depinde nu numai de dificultățile de inginerie genetică, ci și de problemele etice. La urma urmei, vorbim despre compoziția noilor genomi care nu sunt creați de evoluție
luție, ci o ființă umană. Acești genomi se vor alătura fondului genetic al umanității. Care va fi soarta lor din punct de vedere genetic și social, vor funcționa ca genomul normal, este societatea pregătită să accepte consecințele unor rezultate nereușite? Astăzi este dificil să răspunzi la aceste întrebări și fără a le răspunde, studiile clinice nu pot începe, deoarece vor exista interferențe irevocabile în genomul uman. Fără o evaluare obiectivă a consecințelor evolutive ale ingineriei genetice, aceste metode nu pot fi utilizate la om (chiar în scopuri medicale în stadiul zigot). Genetica umană este încă departe de a înțelege complet toate caracteristicile funcționării genomului. Nu este clar cum va funcționa genomul după introducerea de informații genetice suplimentare în el, cum se va comporta după meioză, reducerea numărului de cromozomi, în combinație cu o nouă celulă germinală etc.
Toate cele de mai sus au dat motive pentru ca specialiștii în domeniul eticii biomedicale la nivel internațional [OMS (Organizația Mondială a Sănătății), UNESCO (Organizația Națiunilor Unite pentru Educație, Știință și Cultură), Consiliul Europei] să recomande abținerea temporară de la efectuarea de experimente , și cu atât mai mult din testele clinice cu transgenoză de celule germinale.
Planificare familială
Dacă există un risc mare (mai mult de 20%) de a avea un copil bolnav și nu există opțiuni de diagnostic prenatal, se recomandă refuzul de a avea copii. Este clar că o astfel de recomandare trebuie dată după un consult medico-genetic calificat, atunci când nu există metode de diagnostic prenatal sau pentru familie, din diverse motive, întreruperea sarcinii este inacceptabilă.
După cum se știe, căsătoriile consanguine cresc probabilitatea de a avea un copil cu o boală ereditară. Refuzul căsătoriilor consanguine sau restrângerea nașterii în acestea poate fi considerată o metodă de prevenire a patologiei ereditare. Următoarele fapte vorbesc despre asta.
Căsătoriile consanguine la nivel de văr primar sunt preferate de cel puțin 20% din populația lumii. Cel puțin 8,4% dintre copii sunt născuți din părinți înrudiți. Acest obicei este comun în estul Mediteranei și în sudul Indiei și printre multe populații tribale de mii de ani.
În SUA, Canada, Rusia, majoritatea țărilor europene, Australia, Noua Zeelandă, frecvența căsătoriilor consanguine este mai mică de 1%, în republicile din Asia Centrală, Japonia, India de Nord, țările din America de Sud - 1-10%, în țări din Africa de Nord, Orientul Mijlociu, India de Sud - de la 10 la 50%.
Obiceiul căsătoriilor consanguine în trecut a susținut femeia și familia. Totuși, acest lucru se reflectă în frecvența nașterilor copiilor cu boli recesive. Pentru părinții care nu sunt consanguini, riscul global de naștere morta, mortalitate infantilă și infantilă sau malformații congenitale majore este de aproximativ 2,5%, iar riscul de retard mintal este de încă 3%. În total, aceste riscuri se dublează aproximativ pentru copiii cuplurilor căsătorite - veri primari. Dacă mortalitatea infantilă într-o regiune este mare, atunci acest efect este puțin vizibil, dar dacă este scăzut, atunci efectul consanguinității sub formă de malformații congenitale și boli cronice invalidante devine evident.
În populațiile cu o frecvență ridicată a oricărei boli în care este diagnosticat purtătorul, este posibil refuzul de a se căsători cu purtători heterozigoți.
Pentru femeile după vârsta de 35 de ani, probabilitatea de a avea un copil cu boli cromozomiale crește semnificativ (vezi Capitolul 5), pentru bărbați - cu boli genetice (Tabelul 11.4).
Tabelul 11.4. Vârsta medie a taților la momentul nașterii copiilor cu boli autosomal dominante (cazuri sporadice)

Diferența de vârstă dintre tații probandilor și tații din eșantionul martor este în medie de 5 ani. Motivele acestui fenomen sunt neclare, dar pentru prevenirea bolilor ereditare trebuie luate în considerare.
Astfel, încetarea nașterii înainte de vârsta de 35 de aniși chiar mai devreme este unul dintre factorii de prevenire a bolilor ereditare. Când planificați nașterea a 2-3 copii, această perioadă este suficientă pentru majoritatea familiilor.
Protecția mediului
Variabilitatea ereditară umană este actualizată constant cu noi mutații. Mutațiile spontane nou apărute determină în general până la 20% din toată patologia ereditară. Pentru unele forme dominante severe, noile mutații sunt cauza a 90% din bolile ereditare sau mai mult. Bolile ereditare cauzate de mutații nou apărute nu pot fi de fapt prezise. Acestea sunt evenimente aleatorii, rare pentru fiecare genă.
Nu există încă condiții preliminare pentru a interfera cu procesul de mutageneză spontană la om, deși cercetările intensive în antimutageneză și antiteratogeneză pot duce la crearea de noi metode de prevenire a bolilor ereditare și a malformațiilor congenitale.
Alături de mutageneza spontană, mutageneza indusă (radiație, chimică, biologică) este posibilă la om. Natura universală a mutagenezei induse la toate nivelurile de organizare a eredității pentru toate ființele vii este dincolo de orice îndoială. În mod natural, mutageneza indusă poate servi ca o sursă suplimentară de boli ereditare. Din punctul de vedere al prevenirii bolilor ereditare, ar trebui exclus complet.
Trebuie subliniat faptul că procesul de mutație indusă este periculos în ceea ce privește nu atât un prognostic individual, cât unul populațional. De aici rezultă că excluderea factorilor mutageni din mediul uman este o metodă de prevenire a bolilor ereditare populaționale.
Au fost dezvoltate metode de testare a factorilor externi pentru mutagenitate, acestea pot fi introduse în reglementările de igienă pentru protecția mediului. Această întrebare este foarte importantă deoarece efectele mutagene ale factorilor de mediu nu apar la populația expusă, ci la descendenți pe parcursul mai multor generații.
Protecția mediului uman include și excepţie din ea factori care provoacă reacţii patologice ecogenetice
țiuni. De exemplu, pentru persoanele cu xeroderma pigmentosum (homozigoți) este necesar să se excludă contactul cu razele ultraviolete, pentru persoanele cu deficiență de inhibitor de protează - cu praf, pentru purtătorii mutației genei porfirinei - cu barbiturice etc.
CONSILIERE MEDICO-GENETICĂ
Dispoziții generale
Consilierea genetică medicală, un tip specializat de îngrijire medicală, este cea mai comună metodă de prevenire a bolilor ereditare.
Esența sa este de a determina prognosticul pentru nașterea unui copil cu patologie ereditară pe baza unui diagnostic rafinat, de a explica probabilitatea acestui eveniment celor care se consultă și de a ajuta familia să ia o decizie cu privire la continuarea nașterii.
Înapoi la sfârșitul anilor 20 ai secolului XX. S.N. Davidenkov a fost primul din lume care a organizat o consultație medico-genetică la Institutul de Prevenire Neuropsihiatrică. El a formulat clar sarcinile și metodele de consiliere genetică medicală. Cu toate acestea, dezvoltarea acestui domeniu de prevenire și genetică umană în ansamblu a încetinit în anii 1930 în aproape toate țările dezvoltate. Acest lucru s-a datorat faptului că Germania nazistă a folosit concepte genetice pentru a justifica genocidul și a introdus sterilizarea forțată ca metodă de „sănătate rasială”. Sterilizarea eugenică a fost realizată pe scară largă în SUA, Danemarca, Suedia și alte țări. În mare parte în legătură cu eugenia, precum și din motive politice, Institutul de Genetică Medicală a fost închis la Moscova (1936).
Deși în SUA au început să se organizeze consultații (birouri) medicale genetice deja în anii 40, dezvoltarea cu adevărat intensivă a unei astfel de asistențe în diferite țări (inclusiv Rusia și Germania) a început în anii 60 și 70. Până atunci, a avut loc o descoperire majoră în studiul patologiei cromozomiale și al bolilor metabolice ereditare.
Termen „consultat medical genetic” definește două concepte: o opinie medicală a unui genetician și o instituție medicală specializată (atât independentă, cât și ca parte a unei asociații).
Indicații pentru consilierea medicală genetică:
Prezența unei boli ereditare stabilite sau suspectate în familie;
Nașterea unui copil cu o malformație congenitală;
Întârzierea dezvoltării mentale sau fizice a copilului;
Avorturi spontane repetate, avorturi spontane, nașteri morti;
Risc ridicat de patologie fetală conform rezultatelor screening-ului biochimic al proteinelor serice marker ale unei femei gravide;
Prezența markerilor cu ultrasunete ai unei boli ereditare la făt;
Vârsta gravidei este de 35 de ani sau mai mult;
Căsătoriile consanguine;
Expunerea la teratogene în primele 3 luni de sarcină.
În principiu, este recomandabil ca fiecare cuplu căsătorit să se supună consilierii genetice medicale înainte de a planifica nașterea (prospectiv) și, bineînțeles, necesar după nașterea unui copil bolnav (retrospectiv).
Funcțiile unui genetician
Un genetician îndeplinește două funcții principale. În primul rând, cu ajutorul altor specialiști „îngust”. stabileste un diagnostic utilizarea metodelor genetice speciale în diagnosticul diferenţial; în al doilea rând, el determină prognosticul de sănătate viitor (sau deja născut) urmași. Medicul se confruntă mereu cu probleme medicale, genetice și deontologice; La diferite etape ale consilierii predomină una sau alta.
Consultatia medicala genetica cuprinde 4 etape: diagnostic, prognostic, concluzie, sfat. Comunicarea dintre un genetician și familia unui pacient ar trebui să fie confidențială și prietenoasă.
Diagnosticare
Consultarea începe întotdeauna cu clarificarea diagnosticului unei boli ereditare, deoarece un diagnostic precis rămâne o condiție prealabilă necesară pentru orice consultare. Inainte de a trimite un pacient la consult genetic medical, medicul curant trebuie, folosind metodele de care dispune, sa clarifice pe cat posibil diagnosticul si sa determine scopul consultatiei. Dacă este necesară utilizarea suplimentară a metodelor genealogice, citogenetice, biochimice și a altor metode genetice speciale (de exemplu, pentru a determina legătura dintre gene sau pentru a folosi metode genetice moleculare etc.), atunci pacientul este îndrumat pentru un consult genetic medical,
iar un genetician îl ajută pe medicul curant în stabilirea unui diagnostic. În acest caz, poate fi necesară trimiterea pacientului sau rudelor acestuia pentru o examinare suplimentară. La rândul său, geneticianul poate stabili alți specialiști (neurolog, endocrinolog, ortoped, oftalmolog etc.) cu o sarcină specifică - să recunoască simptomele unei boli ereditare suspectate la pacient sau la rudele acestuia. Un genetician însuși nu poate avea cunoștințe atât de universale încât să ofere pe deplin diagnosticul clinic pentru câteva mii de boli ereditare.
La prima etapă de consultare, geneticianul se confruntă cu multe probleme pur genetice (eterogenitatea genetică a bolii, mutația moștenită sau recent apărută, cauza de mediu sau genetică a acestei boli congenitale etc.).
Diagnosticul este clarificat într-un consult genetic medical cu ajutorul analizei genetice. În acest scop, un genetician folosește metode clinico-genealogice, citogenetice și genetice moleculare, precum și analiza legăturii genice, metode de genetică a celulelor somatice. Printre metodele non-genetice, sunt utilizate pe scară largă metode biochimice, imunologice și alte metode paraclinice, care ajută la stabilirea unui diagnostic precis.
Metoda clinica si genealogica supus unei culegeri minuțioase a pedigree-ului, oferă anumite informații pentru stabilirea diagnosticului unei boli ereditare. Metoda clinică și genealogică ne permite să descriem o nouă formă de boală întâlnită pentru prima dată. Dacă tipul de moștenire este clar vizibil în pedigree, atunci consilierea este posibilă chiar dacă diagnosticul nu este stabilit (trăsăturile utilizării metodei clinico-genealogice și capacitățile sale de rezolvare sunt discutate mai sus). În consultația medicală genetică, această metodă este utilizată în toate cazurile fără excepție.
Studiu citogenetic, după cum reiese din experiența multor consultații, este folosit în cel puțin 10% din cazuri. Acest lucru se datorează necesității unui prognostic pentru descendenți atunci când a fost diagnosticată o boală cromozomială și necesității de a clarifica diagnosticul în cazurile neclare de malformații congenitale. Astfel de probleme sunt adesea întâlnite în practica de consiliere. De regulă, nu sunt examinați doar probandii, ci și părinții.
Metode biochimice, imunologice și alte metode paraclinice nu sunt specifice consultației genetice, dar sunt utilizate la fel de larg ca și în diagnosticul bolilor neereditare. Pentru bolile ereditare, aceleași teste sunt adesea folosite nu numai asupra pacientului, ci și asupra altor membri ai familiei (întocmirea unui „pedigree”) biochimic sau imunologic.
În procesul de consiliere genetică, este adesea nevoie de un examen paraclinic suplimentar. În astfel de cazuri, pacientul sau rudele acestuia sunt trimise la instituțiile de specialitate corespunzătoare.
În cele din urmă, într-un consult genetic medical, diagnosticul este clarificat prin analiza genetică a tuturor informațiilor obținute, inclusiv (dacă este necesar) date privind legarea genelor sau rezultatele unui studiu asupra celulelor cultivate. Un genetician trebuie să fie un specialist înalt calificat în diverse domenii ale geneticii medicale.
Prognosticul pentru urmași
După clarificarea diagnosticului, se stabilește prognosticul pentru urmași. Un genetician formulează o problemă genetică, a cărei soluție se bazează fie pe calcule teoretice folosind metode de analiză genetică și statistici de variație, fie pe date empirice (tabele de risc empiric). Este clar că pregătirea obișnuită a unui medic generalist nu permite unui astfel de prognostic. Greșeala unui medic cu un prognostic incorect poate fi fatală pentru o familie: un copil grav bolnav se va naște din nou sau familia va refuza pe nedrept să aibă copii.
Dacă se utilizează diagnosticul prenatal, nu este necesară o soluție la problema genetică. În astfel de cazuri, nașterea unui copil cu boală nu este prezisă, dar boala este diagnosticată la făt.
Încheierea consilierii genetice medicale și consilierea părinților
Concluzia consilierii genetice medicale și sfatul părinților pot fi combinate. Concluzia geneticianului trebuie scrisă, pentru că membrii familiei se pot întoarce să se gândească la situație. Alături de aceasta, este necesar să se explice verbal semnificația riscului genetic într-o formă accesibilă și să se ajute familia să ia o decizie.
Etapele finale ale consilierii necesită cea mai mare atenție. Indiferent de modul în care metodele de calculare a riscului (empirice sau teoretice) sunt îmbunătățite, indiferent cât de complet sunt introduse realizările geneticii medicale în munca de consultații, consultația va fi ineficientă dacă pacienții înțeleg greșit explicația geneticianului. Ajută și contactul cu un medic de familie, în care soții au încredere, așa că coordonarea acțiunilor medicului de familie (curat) și geneticianului este foarte importantă. De exemplu, chiar și cu un diagnostic fetal stabilit în perioada prenatală, nu toate femeile decid să întrerupă sarcina. Cu boli cromozomiale severe (trisomia 13, 18, 21), 83% dintre femei întrerup sarcina, cu defecte ale tubului neural - 76%, cu sindromul Turner - 70%, cu alte forme de anomalii cromozomiale - 30%.
Pentru a atinge scopul consilierii, atunci când vorbiți cu pacienții, trebuie să luați în considerare nivelul lor de educație, statutul socio-economic al familiei, structura personalității și relațiile dintre soți. Mulți pacienți nu sunt pregătiți să perceapă informații despre bolile ereditare și modelele genetice. Unii tind să se simtă vinovați pentru nenorocirea petrecută și suferă de un complex de inferioritate, alții au destul de serios încredere în poveștile prietenilor, alții vin la consultație cu solicitări sau așteptări nerealiste, din cauza faptului că au fost informați incorect despre posibilitățile genetice. consultație (inclusiv uneori de către medicii curant). Este important de reținut că aproape toți soții consilieri doresc să aibă un copil (altfel nu ar solicita consiliere). Acest lucru crește semnificativ responsabilitatea profesională atât a medicului curant, cât și a geneticianului. Fiecare cuvânt inexact poate fi interpretat în direcția în care sunt înclinați soții. Dacă unui cuplu îi este foarte frică să aibă un copil bolnav și vrea să nască unul sănătos, atunci fiecare frază neglijentă a medicului despre pericol crește frica, deși de fapt riscul poate fi mic. Dimpotrivă, dorința de a avea un copil poate fi atât de puternică, încât chiar și cu mare risc, soții decid să aibă copii, pentru că medicul a spus că există o oarecare probabilitate de a avea un copil sănătos.
Comunicarea riscurilor trebuie adaptată în mod individual fiecărui caz. În unele cazuri, ar trebui să vorbim despre o șansă de 25% de a avea un copil bolnav, în altele - despre o șansă de 75% de a avea un copil sănătos. Cu toate acestea, trebuie întotdeauna să convingi pacientul
intră în distribuirea aleatorie a factorilor ereditari pentru a elimina sentimentul de vinovăţie pentru naşterea unui copil bolnav. Uneori, acest sentiment poate fi foarte puternic.
Este recomandabil să trimiteți soții la consultație medicală genetică nu mai devreme de 3-6 luni după stabilirea diagnosticului unei boli ereditare, deoarece în această perioadă are loc adaptarea la situația din familie și înainte de aceasta orice informație despre viitorii copii este slabă. primit.
Tactica geneticianului de a ajuta pacienții să ia decizii nu a fost pe deplin determinată. Desigur, depinde de situația specifică. Deși decizia este luată de pacienții înșiși, rolul medicului în luarea deciziilor în familie poate fi activ sau limitat la explicarea semnificației riscului. În opinia noastră, un genetician și un medic curant (în special un medic de familie) ar trebui să ajute cu sfaturi în luarea unei decizii, deoarece, având în vedere nivelul actual de cunoștințe în domeniul geneticii în rândul populației, este dificil pentru cei care consultă să facă un decizie adecvată pe cont propriu.
Problemele de consiliere medicală sunt mai ușor de rezolvat decât problemele sociale și etice. De exemplu, cu aceeași boală, cu aceeași probabilitate de a avea un copil bolnav, situații familiale diferite (securitate, relații între soți etc.) necesită abordări diferite în explicarea riscului. În orice caz, decizia de a avea copii rămâne în seama familiei.
Probleme organizatorice
Atunci când se organizează consultații medicale genetice ca unități structurale, este necesar să se bazeze pe sistemul de sănătate existent în țară și să se țină cont de gradul de dezvoltare a medicinei în ansamblu, inclusiv de nivelul de cunoștințe de genetică în rândul medicilor. Consultațiile funcționează ca o legătură în sistemul existent de îngrijire medicală către populație.
În majoritatea țărilor străine cu asistență medicală dezvoltată, sistemul de consultație este în 3 etape: în cazuri simple, prognosticul pentru urmași este determinat de medicul de familie; cazurile mai complexe sunt transmise unui genetician care lucrează într-un centru medical mare; consilierea în situaţii genetice complexe se realizează în consultaţii genetice speciale. Pentru a implementa acest sistem eficient în general, este necesar ca fiecare familie sau medic curant să aibă o bună înțelegere
genetica clinică și organizarea îngrijirilor medicale către populație trebuie să fie adecvată.
Consultațiile medicale genetice ca unități structurale de tratament și instituții preventive pot fi atât generale, cât și specializate.
Probands apelând la consultatie generala conform principiului nosologic, au o mare varietate de patologii. Întrucât munca de clarificare a diagnosticului în consultație ocupă un loc larg, profilul divers al bolilor probandilor obligă atât probandii, cât și rudele să fie examinate. În acest sens, este recomandabil să se creeze consultații genetice pe baza unor largi instituții multidisciplinare de tratament și de prevenire de subordonare republicană sau regională. În acest caz, pacientul și rudele acestuia pot primi sfaturi de la specialiști și, dacă este necesar, pot fi internați în spital. În plus, consultația ar trebui să poată trimite pentru examinări de specialitate (tomografie, studii de profil hormonal etc.) la alte instituții dacă spitalul în care funcționează consultația nu are astfel de capacități. Contactul strâns cu alte secții și subordonarea corectă a acestora este un principiu important al consultației generale de genetică medicală.
Consultatii medicale si genetice de specialitate poate fi organizat la mari spitale specializate, in care un genetician dobandeste experienta in consultanta pe boli ereditare de un singur profil. În cazuri dificile, consultațiile generale pot îndruma pacienții către consultații de specialitate.
Două consultații - generale și de specialitate - pot funcționa în paralel, dar independent.
Personalul de consultanță generală ar trebui să includă geneticieni, citogeneticieni și biochimisți-geneticieni. Un genetician care efectuează consultații cu populația trebuie să aibă o pregătire genetică cuprinzătoare, deoarece trebuie să rezolve o mare varietate de probleme genetice. Obiectul cercetării unui genetician este familia, iar probanda este doar persoana de plecare în acest studiu. Orice consultare necesită colectarea de informații despre rude și, uneori, examinarea acestora. Concluzia unui genetician despre un risc recurent al bolii este destinată direct familiei care a căutat ajutor, prin urmare sensul concluziei trebuie explicat într-o formă accesibilă.
(de multe ori mai mulți membri ai familiei). Toate acestea durează mult mai mult decât să vezi un pacient cu orice alt specialist. Examinarea inițială a probandului și a părinților săi, precum și colectarea unui istoric familial, necesită de la 1 la 1,5 ore O consultație repetată (raport scris, explicație într-o formă accesibilă, asistență în luarea deciziilor) durează în medie 30. minute. Astfel, un genetician nu poate vedea mai mult de 5 familii pe parcursul unei zile de lucru.
Dintre toate studiile speciale, cea mai mare nevoie apare de analize citogenetice (în medie, 1 studiu la 1 familie). Nevoia mare de utilizare a metodei citogenetice se datorează trimiterii spre consult genetic medical, în primul rând a pacienților cu patologie cromozomială, malformații congenitale și patologie obstetricală. În acest caz, de regulă, nu o persoană este examinată, ci 2 sau 3.
Studiile biochimice sunt necesare la aproximativ 10% dintre pacienții care solicită consultație. Acesta este un număr destul de mare. Cu toate acestea, cu o mare varietate de boli metabolice ereditare, utilizarea repetată a acelorași metode biochimice în consultație este foarte rară.
În orașele mari, este recomandabil să se creeze laboratoare biochimice specializate, cu capacități metodologice largi pentru examinarea pacienților cu diverse tulburări metabolice.
Astfel, consultația genetică ca unitate structurală este o verigă în serviciul de ambulatoriu, format din cabinet de genetician, o sală de procedură (prelevare de sânge) și un laborator pentru studii citogenetice și de screening biochimice. Studiile clinice, paraclinice, genetice moleculare, biochimice, imunologice și de altă natură se efectuează în laboratoare de specialitate și instituții medicale la care se anexează consultația. Astfel de consultații în spitale nu exclud organizarea de centre medicale genetice de înaltă specialitate, cu toate secțiile necesare.
Analiza apelului la consultația medicală genetică
Până acum, doar un număr mic de familii (abia mai mult de 10%) care au nevoie de sfatul unui genetician caută un astfel de ajutor de specialitate. În același timp, mai mult de 50% este direcționat
Deoarece conducătorul principal al ideii de consiliere genetică medicală este un medic generalist, trimiterea la o astfel de consultație depinde de cunoștințele și înțelegerea sarcinilor consultațiilor. Conștientizarea populației cu privire la problemele bolilor ereditare afectează și utilizarea consultațiilor medicale genetice. Totuși, valabilitatea cererilor depinde în totalitate de competența medicului.
Raportul dintre pacienții îndrumați de medici și cei care s-au autoreferit variază foarte mult. În diferite consultări, ponderea celor care au aplicat independent variază de la 10 la 80%. Depinde cui (medici sau populație) a fost îndreptată propaganda, ceea ce determină în mare măsură valabilitatea contestațiilor, adică. diagnostic corect si indicatii corecte pentru consultatie.
Distribuția celor care solicită consultanță între grupurile de boli ar trebui să corespundă cu frecvența relativă a acestor boli la populațiile umane. Cu toate acestea, analiza ratelor de trimitere bazată pe principii nosologice în consultările din diferite țări arată abateri de la distribuția așteptată teoretic.
Cel mai adesea, familiile cu copii cu boli cromozomiale, malformații congenitale și boli neuropsihiatrice solicită consultații.
Caracteristicile sociale ale pacienților din diferite consultații sunt aceleași. Cei mai mulți pacienți au studii universitare și sunt în stare de bine. Motivele solicitării consultației sunt dorința de a avea un copil sănătos (aproximativ 90% dintre respondenți) și dorința de a vindeca un copil bolnav (aproximativ 10% din cazuri). În 50% dintre familii există relații conflictuale între soți.
Eficacitatea consultațiilor medicale genetice
Scopul consilierii genetice în sensul populației generale este de a reduce povara eredității patologice, iar scopul unei consultații separate este de a ajuta familia să accepte
decizii corecte privind planificarea familială, tratamentul și prognoza stării de sănătate a pacientului. În consecință, criteriul de eficacitate al consilierii genetice medicale în sens larg este modificarea frecvenței genelor patologice, iar rezultatul unei consultări separate este o modificare a comportamentului soților care solicită consultație pe probleme de naștere.
Odată cu introducerea pe scară largă a consilierii genetice medicale, este posibil să se obțină o anumită reducere a incidenței bolilor ereditare, precum și o reducere a mortalității (în special în rândul copiilor). Calculele arată că din 100 de familii consultate, 3-5 nu se nasc cu copii bolnavi (fără consultație s-ar fi născut), în ciuda faptului că 25-30% dintre cei consultați nu urmează sfatul unui genetician. Dacă medicii curant (sau de familie) i-ar ajuta pe soții să urmeze astfel de recomandări, atunci eficiența consilierii genetice medicale ar fi și mai mare.
Efectele populației ale consilierii genetice medicale sunt exprimate în modificări ale frecvenței alelelor patologice. Acest indicator se va schimba puțin, deoarece contribuția principală la frecvența genelor în populații o au purtătorii heterozigoți, iar frecvența acestora va rămâne practic neschimbată ca urmare a consilierii. Dacă cei consultați urmează sfatul unui genetician, doar numărul purtătorilor homozigoți va scădea. Reducerea frecvenței bolilor dominante severe în populații ca urmare a consilierii genetice medicale nu va fi semnificativă, deoarece 80-90% dintre acestea sunt rezultatul unor noi mutații.
Sălile de consiliere genetică medicală ar trebui organizate în toate spitalele regionale și marile orașe. Sfera de aplicare a consilierii genetice medicale, desigur, depinde de nivelul de îngrijire medicală din țară.
Cu asistența medicală dezvoltată, nevoile reale de consiliere genetică medicală sunt destul de mari. De exemplu, toate familiile cu copii născuți cu patologii congenitale și ereditare (aproximativ 5%) necesită asistență medicală și genetică. În consecință, în Rusia, cu un număr de nașteri estimat la 1.500.000 pe an, vor exista 75.000 de astfel de familii de femei de peste 35 de ani care decid să nască un copil au nevoie de consiliere medicală și genetică. Peste 70.000 de femei de peste 35 de ani nasc în Rusia în fiecare an. Alte calcule pentru consultații privind formele precoce de boli cardiovasculare
bolile, cancerul, bolile nervoase, psihice și de altă natură arată că fiecare a 5-10-a familie are nevoie de consiliere medicală și genetică generală sau de specialitate.
DIAGNOSTIC PRENATAL
Întrebări generale
Termenul „diagnostic prenatal” se referă la totalitatea tuturor metodelor de examinare a stării embrionului sau fătului, care vizează identificarea malformațiilor congenitale, a bolilor ereditare și a oricăror alte forme (infecțioase, traumatice) de boli care se dezvoltă in utero. Scopul unor astfel de diagnostice este prevenirea nașterii copiilor cu boli congenitale și ereditare. Diagnosticul prenatal ca direcție științifică și practică a apărut în anii 70 ai secolului trecut și a progresat rapid, bazându-se pe succesele geneticii și disciplinelor clinice. Numărul procedurilor de diagnosticare prenatală se ridică în prezent la zeci de milioane pe an.
Diagnosticul prenatal al bolilor ereditare este un domeniu complex al medicinei, în dezvoltare rapidă, folosind ultrasunete, tehnici chirurgicale (biopsie corionică, amnio- și cordocenteză, biopsie mușchilor fetali și cutanate) și metode de laborator (citogenetice, biochimice, genetice moleculare).
Preocuparea familiei pentru sănătatea copilului nenăscut (și uneori îngrijorare nefondată) necesită nu numai o evaluare a factorilor de risc genetici și de mediu pentru rezultatele sarcinii (consultație medicală genetică), ci și utilizarea metodelor de diagnostic prenatal.
La organizarea și dezvoltarea unui sistem de diagnostic prenatal trebuie îndeplinite următoarele condiții.
Medicii, atunci când determină indicațiile pentru cercetare, trebuie să cunoască probabilitatea diagnosticelor fals pozitive și fals negative sau, cu alte cuvinte, limitările metodei.
Diagnosticul prenatal trebuie să includă două etape:
Prima etapă este identificarea și selecția femeilor (mai precis, familiile) cu un risc crescut de un rezultat genetic nefavorabil al sarcinii în timpul consilierii genetice medicale.
examinarea sau examinarea inițială a femeilor însărcinate, inclusiv utilizarea metodelor de screening de diagnostic; a doua etapă este clarificarea diagnosticului prenatal. Orice metode de clarificare a diagnosticului (invazive sau neinvazive, de laborator, costisitoare, intensive în muncă) sunt utilizate numai la femeile cu factori de risc.
Specialiștii în diagnosticare prenatală (obstetrician-ginecolog, genetician, genetician de laborator) trebuie să cunoască limitele de diagnostic ale metodei nu în general, ci în mod specific în laboratorul lor (tehnologia cu ultrasunete, posibilitatea prelevarii de probe de țesuturi și celule fetale etc.). Trebuie luat în considerare faptul că diagnosticele de laborator adecvate pot fi indisponibile sau limitate.
Specialiștii trebuie să respecte cu strictețe standardele pentru determinarea indicațiilor și efectuarea procedurilor și analizelor de laborator, să efectueze controlul continuu al calității muncii și, de asemenea, să aibă statistici privind rezultatele sarcinii și discrepanțe în diagnostice (monitorizare după avort sau după naștere).
Importanța respectării tuturor condițiilor de mai sus este asociată nu numai cu considerente medicale, ci și deontologice: toate aceste probleme devin agravate în familie în timpul așteptării unui copil.
Metode Diagnosticul prenatal este împărțit în indirect și direct.
Metode indirecte- examen obstetrico-ginecologic, serologic, precum si analiza markerilor embriospecifici. Markerii enumerați formează esența așa-numitelor metode de laborator de cernere.
Metode directe- examinarea neinvazivă sau invazivă a fătului. Cercetarea non-invazivă se limitează practic la ultrasunete, deși în cazuri rare se utilizează radiografia și altele. Metodele invazive includ biopsiile corionice și placento, amnio- și cordocenteza, biopsia de țesut fetal.
Pentru fiecare metodă există indicații și contraindicații, posibilități de rezolvare și complicații. Alegerea metodei și toate tacticile de diagnostic prenatal trebuie strict individualizate în funcție de situația specifică din familie și de starea gravidei.
Screeningul femeilor însărcinate pe baza determinării markerilor biochimici (metode de cernere)
Astfel de metode fac posibilă identificarea femeilor care au un risc crescut de a avea un copil cu o boală ereditară sau congenitală. Metodele trebuie să fie accesibile pentru utilizare pe scară largă și ieftine.
Desigur, consilierea medicală genetică a familiilor le testează pentru diagnosticul prenatal. Opțiunea optimă de cernere în scopul prevenirii patologiei ereditare prin diagnosticul prenatal ar fi consilierea genetică medicală cu analiza genealogică a tuturor familiilor care planifică nașterea. În acest caz, se pare că aproximativ 10% dintre femei ar avea nevoie de o examinare mai aprofundată. În timpul consilierii medicale genetice, femeile sunt trimise pentru diagnostic prenatal pentru următoarele indicații:
Vârsta de 35 de ani și peste (bărbați de 45 de ani și mai mult);
Prezența unei boli ereditare detectată prenatal în familie sau populație;
Antecedente obstetricale nefavorabile (avorturi spontane repetate sau nașterea unui copil cu malformații congenitale);
Diabet zaharat;
Epilepsie;
Infecții la o femeie însărcinată;
Terapie medicamentoasă;
Contacte cu factori teratogene.
Metodele de screening care determină necesitatea diagnosticului prenatal invaziv includ ultrasunetele fătului și determinarea substanțelor din serul sanguin al gravidei, numite markeri serici materni:
concentrații de AFP;
nivelul HCG;
Nivelul de estriol nelegat;
PAPP-A.
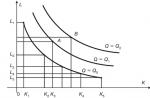
α -fetoproteine produce sacul vitelin și ficatul fetal. Această proteină este excretată prin urină în lichidul amniotic, de unde intră în sângele gravidei prin membrane și placentă. Conținutul său se modifică în timpul sarcinii. Fiecare laborator trebuie să stabilească standarde în exprimarea mediană a conținutului
proteine pentru fiecare săptămână de sarcină, deoarece concentrațiile de AFP fluctuează între reprezentanții diferitelor rase și în diferite zone geografice, iar distribuția concentrațiilor nu respectă legea distribuției normale. Abatere de la nivelul mediu (normal) al indicatorului (indicat în unități MOM - multipli de mediană) este estimată prin raportul dintre conținutul de AFP din sângele unei anumite femei și valoarea medie (mediană) a conținutului acestei proteine la multe femei aflate în același stadiu al sarcinii normale. Această metodă permite suspectarea unor defecte congenitale ale tubului neural și ale peretelui abdominal. Cu această patologie, concentrația de AFP în serul sanguin al unei femei însărcinate în al doilea trimestru este semnificativ mai mare decât în mod normal (Fig. 11.1). O creștere a nivelurilor de AFP este înregistrată și în gastroschizis, omfalocel și anomalii renale.
Deoarece anomaliile tubului neural apar de câteva ori mai frecvent decât media în unele populații, concentrațiile de AFP ar trebui determinate la toate femeile însărcinate din astfel de populații. O indicație pentru acest studiu este, de asemenea, un pedigree împovărat, i.e. prezența unui pacient cu o anomalie de tub neural în al treilea grad de relație de ambele părți ale soților.
Concentrația de AFP este redusă de la a 15-a până la a 18-a săptămână de sarcină în sângele femeilor care poartă un făt cu sindrom Down (Fig. 11.2) sau alte boli cromozomiale.

Orez. 11.1 Concentrația (de-a lungul axei x) a α-fetoproteinei (AFP) în serul sanguin al unei femei însărcinate atunci când poartă un făt normal și un făt cu un defect congenital de tub neural: 1 - neafectat; 2 - deschis spina bifida; 3 - anencefalie

Orez. 11.2. Concentrația (de-a lungul axei x) a α-fetoproteinei (AFP) în serul sanguin al unei gravide care poartă un făt cu sindrom Down: 1 - Sindrom Down; 2 - neafectat
Mecanismul acestei asocieri este neclar, dar existența ei este fără îndoială. O astfel de examinare a femeilor însărcinate poate identifica până la 20% din cazurile de sindrom Down.
Nu există contraindicații medicale pentru determinarea concentrației de AFP. O femeie cu un nivel de AFP modificat este trimisă pentru o examinare suplimentară. Dacă concentrația de proteine este crescută, atunci pentru a clarifica diagnosticul de anomalie a tubului neural, se efectuează o ecografie și se determină concentrația de AFP în lichidul amniotic. Dacă concentrația de proteine este redusă, atunci este prescris un studiu citogenetic al celulelor (amniocite sau limfocite) ale fătului.
Eficiența diagnosticului de screening al bolii Down poate fi crescută prin analizarea AFP prin determinarea nivelul seric de hCG viitoare mamă. În mod normal, nivelurile de hCG scad la valori scăzute după primul trimestru de sarcină. La 68% dintre femeile care poartă un făt cu o boală cromozomială, acest indicator rămâne ridicat până la naștere. Concentrația mediană de hCG în sindromul Down este crescută de 2 ori sau mai mult (Fig. 11.3). Rezultate fals pozitive sunt rareori obținute.
Introducere în Programul de determinare prin screening conținut de estriol neconjugatîn serul de sânge al unei femei însărcinate extinde și mai mult capacitățile de diagnostic ale metodei, cu toate acestea, acest lucru crește semnificativ numărul relativ de răspunsuri fals pozitive. Concentrația acestui hormon este semnificativ mai mică

Orez. 11.3. Concentrația (de-a lungul axei x) a gonadotropinei corionice umane (hCG) în serul sanguin al unei gravide care poartă un făt cu sindrom Down: 1 - neafectat; 2 - Sindromul Down

Orez. 11.4. Concentrația (de-a lungul axei x) a estriolului neconjugat în serul sanguin al unei gravide purtătoare de făt cu sindrom Down: 1 - sindrom Down; 2 - neafectat
când poartă un făt cu sindrom Down (fig. 11.4).
Cele mai mari capacități de diagnosticare sunt asigurate de combinarea celor trei teste descrise (Fig. 11.5).
În ultimii ani, a fost discutată în mod activ posibilitatea utilizării altor markeri serici materni (de exemplu, PAPP-A), modificări în care, de asemenea, se corelează strâns cu trisomiile la făt deja în primul trimestru.
Programele de calculator vă permit să comparați rezultatele și să utilizați indicatorii obținuți cu un grad suficient de fiabilitate. Modalități de creștere a eficienței screening-ului biochimic pot fi găsite în articolul cu același nume de T.K. Kashcheeva pe CD.

Orez. 11.5. O combinație a rezultatelor screening-ului diagnosticului biochimic al anomaliilor congenitale ale tubului neural și sindromul Down: de-a lungul axei x - vârsta gestațională; de-a lungul ordonatei - concentrația analitică; A - risc scăzut; B - risc ridicat; NE - estriol neconjugat
Deși nu este pusă la îndoială posibilitatea determinării prenatale neinvazive fiabile a patologiei sau sexului fătului din sângele periferic prin îmbogățirea preliminară a celulelor sau ADN-ului, din cauza costului ridicat, utilizarea acestor metode rămâne în limitele științifice. cercetare, vezi articolul de A.V. Lavrova „Celule fetale și ADN-ul fetal liber în sângele matern în diagnosticul prenatal neinvaziv” pe CD.
Metodele non-invazive includ ultrasunetele. Radiografia sau radiografia a fost folosită în urmă cu 20-30 de ani (și chiar și atunci nu foarte pe scară largă) în etapele inițiale ale diagnosticului prenatal. În ultimii ani, utilizarea RMN pentru imagistica fetală a devenit treptat posibilă. În ciuda rezoluției mari, valoarea metodei este redusă semnificativ din cauza vitezei reduse de formare a imaginii (secunde și zeci de secunde), care, datorită mobilității fătului, poate duce la rezultate incorecte.
Ecografia ne permite să identificăm atât malformațiile congenitale, cât și starea funcțională a fătului, placentei, cordonului ombilical și membranelor. Momentul examinărilor cu ultrasunete în Rusia este stabilit prin ordin al Ministerului Sănătății. Acestea sunt săptămânile 10-13, 20-22 și 30-32 de sarcină. Ecografia poate fi, de asemenea, utilizată pentru a detecta restricția de creștere embrionară sau fetală începând din a 6-a până la a 8-a săptămână de sarcină.
Ecografia poate fi folosită atât ca screening, cât și ca metodă de clarificare. În unele țări, ecografiile sunt efectuate tuturor femeilor însărcinate. Acest lucru face posibilă prevenirea nașterii a 2-3 copii cu malformații congenitale grave la 1000 de nou-născuți, ceea ce reprezintă aproximativ 30% din toți copiii cu o astfel de patologie. Pentru efectuarea unei ecografii repetate detaliate ca o procedură de diagnostic clarificatoare, se pot distinge următoarele indicații:
Detectarea anomaliilor (markerii patologiei) sau malformațiilor fătului în timpul screening-ului cu ultrasunete;
Inconcordanță între dimensiunea fătului și vârsta gestațională;
Nașterea unui copil anterior cu malformații congenitale;
Boli la femei (diabet zaharat, epilepsie, alcoolism etc.) care cresc riscul de a avea un copil cu malformatii congenitale;
Expunerea la un factor teratogen (radiații, substanțe chimice, infecții) în primele 10 săptămâni de sarcină;
Malformații congenitale la unul dintre soți (sau la rude de gradul 1-3 de rudenie pe linia ambilor soți).
O scurtă listă a malformațiilor congenitale diagnosticate ecografic în aproximativ 80-90% din cazuri este prezentată în tabel. 11.5. Gama de defecte recunoscute prin această metodă este destul de largă. Fiecare medic ar trebui să aibă aceste informații. Despre posibilitățile de diagnostic prenatal al malformațiilor cardiace congenitale puteți afla în articolul cu același nume de I.M. Volkova și colab. pe un CD.
Tabelul 11.5. Malformații congenitale diagnosticate cu ultrasunete

Sfârșitul tabelului 11.5

Metode invazive
Inițial, doar fetoscopia a fost clasificată drept metode invazive. Acum, folosind metode invazive, celulele și țesuturile embrionului, fătului și organelor provizorii sunt obținute în orice perioadă de gestație. Dezvoltarea metodelor de prelevare a materialului a fost stimulată de apariția unor metode mai avansate de diagnosticare de laborator a bolilor ereditare. Metodele invazive sunt îmbunătățite în mai multe direcții: colectarea mai timpurie a probelor pentru cercetare, o gamă mai largă de probe și metode de prelevare mai sigure pentru femeia însărcinată și făt.
Până în prezent, în practica mondială există suficientă experiență (milioane de oameni examinați) în utilizarea corionicului și placentobiopsiei, obținerea lichidului amniotic (amniocenteză), biopsia țesutului fetal și prelevarea de sânge fetal (cordocenteză).
corion-Şi placentobiopsie sunt folosite pentru a obține o cantitate mică de vilozități coriale sau bucăți de placentă în perioada de la a 7-a până la a 16-a săptămână de sarcină. Procedura se efectuează transabdominal sau transcervical sub ghidaj ecografic (Fig. 11.6, 11.7). Nu există nicio diferență fundamentală între indicațiile pentru utilizarea acestor două metode de biopsie. Eficacitatea procedurii depinde de metoda pe care specialistul o cunoaște mai bine. Deși eșantionarea vilozităților coriale este simplă din punct de vedere tehnic, sunt necesare suficientă experiență și îmbunătățiri tehnice continue. Rezultate bune sunt obstetricieni care efectuează cel puțin 200-400 de biopsii coriale pe an eșecurile sunt de 1%. Pe baza materialului mare (câteva milioane de cazuri), s-au tras concluzii cu privire la complicațiile după biopsia vilozităților coriale. După eșantionarea vilozităților coriale transcervicale, aproximativ 10-30% dintre femei experimentează ușoare

Orez. 11.6.Corionica transabdominală sau placentobiopsie

Orez. 11.7.Corionica transcervicală sau placentobiopsie
sângerare, foarte rar - infecție uterină după metoda transabdominală, 2,5% dintre femei pot fi expuse riscului de avort spontan;
Una dintre complicațiile biopsiei vilozităților coriale este avortul spontan (avortul spontan). Pierderea totală a fătului după biopsia corionică este în medie de 2,5-3%, aceste cifre includ și frecvența avorturilor spontane. Biopsia corială în sine induce aparent nu mai mult de 2% din cazurile de întrerupere a sarcinii.
După biopsia vilozităților coriale nu se observă tulburări ale placentei, creșterea fătului, apariția malformațiilor congenitale și o creștere a mortalității perinatale.
Unele centre au observat că biopsia precoce a vilozităților coriale (înainte de 8 săptămâni de sarcină) poate induce amputații congenitale transversale ale membrelor, așa-numitele defecte de reducere. În acest sens (din 1992), se recomandă efectuarea biopsiei corionice după săptămâna a 8-a de sarcină, iar după săptămâna a 11-a se face placentobiopsia.
Probele de corion (vilus) sunt supuse unor studii citogenetice, genetice moleculare și biochimice pentru a identifica patologiile ereditare. În timpul aspirației vilozităților coriale, celulele deciduei uterului pot pătrunde în material, ceea ce poate duce la erori de diagnostic. Se crede că, în 4% din cazuri, diagnosticul de laborator al biopsiilor vilozităților coriale dă rezultate fals pozitive (de exemplu, în 1,5% din teste, se observă mozaicismul cromozomial, care este mozaicismul corionului, nu al embrionului) și uneori ( deşi extrem de rar) – rezultate fals negative. Precizia testelor depinde în mare măsură de calificările geneticienului de laborator. Amniocenteza
Amniocenteza se efectuează prin peretele abdominal anterior (transabdominal) al unei femei sub ghidare ecografică (Fig. 11.8). Amniocenteza transcervicală este posibilă, dar rar utilizată. Se scot 3-30 ml de lichid din cavitatea amniotică.

Orez. 11.8. Probele de corion (vilus) sunt supuse unor studii citogenetice, genetice moleculare și biochimice pentru a identifica patologiile ereditare. În timpul aspirației vilozităților coriale, celulele deciduei uterului pot pătrunde în material, ceea ce poate duce la erori de diagnostic. Se crede că, în 4% din cazuri, diagnosticul de laborator al biopsiilor vilozităților coriale dă rezultate fals pozitive (de exemplu, în 1,5% din teste, se observă mozaicismul cromozomial, care este mozaicismul corionului, nu al embrionului) și uneori ( deşi extrem de rar) – rezultate fals negative. Precizia testelor depinde în mare măsură de calificările geneticienului de laborator.
Studiile biochimice și virologice propuse anterior ale lichidului amniotic nu sunt foarte informative pentru diagnosticul prenatal.
Dintre indicatorii biochimici ai fluidului, doar concentrația de AFP este semnificativă din punct de vedere diagnostic. Nivelul AFP crește semnificativ odată cu anomaliile tubului neural și cu defecte ale peretelui abdominal anterior.
Principalul material de diagnostic pentru amniocenteză sunt celulele. Ele trebuie cultivate (se petrec 2-4 săptămâni pentru asta) atât pentru studii citogenetice, cât și biochimice. Numai opțiunile de diagnostic genetic molecular care utilizează PCR nu necesită cultivare celulară.
Cordocenteza- puncţia intrauterină a vaselor cordonului ombilical pentru obţinerea sângelui fetal (Fig. 11.9). Momentul cordocentezei este 18-22 săptămâni de sarcină. Probele de sânge sunt utilizate pentru diagnosticarea citogenetică (limfocitele sunt cultivate), genetică moleculară și biochimică a bolilor ereditare.

Orez. 11.9. Cordocenteza
Cordocenteza este utilizată pentru a diagnostica boli cromozomiale, boli ereditare ale sângelui (hemoglobinopatii, coagulare).
lopatie, trombocitopenie), imunodeficiențe, stare hematologică în timpul sensibilizării rhesus, infecții intrauterine.
Potrivit unui studiu multicentric, incidența complicațiilor în timpul cordocentezei în total în 16 centre rusești de diagnostic prenatal nu este pre-
depășește 2%. Prima încercare de a obține material are succes în 80-97% din cazuri. Avantajul cordocentezei față de amniocenteză este că sângele este mai convenabil pentru testare decât celulele lichidului amniotic. Limfocitele sunt cultivate mai rapid (2-3 zile) și mai fiabil decât amniocitele. Pentru metodele moleculare de cariotipizare rapidă în diagnosticul prenatal, vezi CD-ul din articolul cu același nume de V.A. Timoshevsky și I.N. Lebedeva.
Biopsie de țesut fetal ca procedură de diagnosticare se efectuează în al doilea trimestru de gestație sub ghidaj ecografic.
Pentru a diagnostica boli ereditare severe ale pielii (ihtioză, epidermoliza), biopsie cutanată fetală cu examinarea patomorfologică (și uneori microscopică electronică) a materialului. Criteriile morfologice pentru bolile ereditare ale pielii fac posibilă stabilirea unui diagnostic precis sau respingerea cu încredere a acestuia.
A fost dezvoltată o metodă imunofluorescentă pentru a diagnostica distrofia musculară Duchenne în stadiul intrauterin. În acest scop ei produc biopsie musculară fetală. Biopsia este tratată cu anticorpi marcați monoclonali la proteina distrofină, care nu este sintetizată la pacienți. Tratamentul fluorescent adecvat evidențiază proteina. Când moșteniți o genă patologică, nu există luminiscență. Această tehnică este un exemplu de diagnosticare a unei boli ereditare la nivelul produsului genic primar. În cazul miopatiei Duchenne, această metodă oferă rezultate mai precise decât diagnosticul genetic molecular.
Concluzie
Un medic generalist trebuie să înțeleagă metodele de diagnostic prenatal, capacitățile și limitările acestora și indicațiile de trimitere pentru cercetare. Momentul specific de implementare a acesteia și alegerea metodei (și uneori a metodelor) sunt determinate de grupul (echipa) de diagnosticare prenatală (genetician, obstetrician-ginecolog și genetician de laborator), în funcție de starea de sănătate a gravidei, cursul a sarcinii și pregătirea psihologică a femeii pentru procedură. Domeniul de aplicare și posibilitățile de prevenire secundară a bolilor ereditare prin eliminarea embrionilor și a fetușilor după diagnosticul prenatal sunt rezumate în tabel. 11,6-11,8.
Tabelul 11.6.

Tabelul 11.7. Caracteristici comparative ale metodelor de diagnostic prenatal folosind tehnici de eșantionare transabdominală (pe baza materialelor de la Organizația Mondială a Sănătății)

Sfârșitul tabelului 11.7

Tabelul 11.8. Indicații pentru utilizarea diferitelor metode de diagnostic prenatal invaziv

DIAGNOSTIC PREIMPLANTARE
Datorită dezvoltării metodelor de tehnologii de reproducere asistată [fertilizarea in vitro, injectarea intracitoplasmatică a spermatozoizilor în ovocit (ICSI)], pe de o parte, și îmbunătățirea metodelor de diagnostic de laborator al bolilor ereditare, pe de altă parte, preimplantare. diagnosticul a apărut la sfârșitul anilor 90 ai secolului trecut. Material pentru
diagnosticele preimplantare sunt corpi polari sau blastomere individuale obținute cu ajutorul unui micromanipulator din blastociste.
Un astfel de diagnostic se referă la metode de prevenire primară a bolilor ereditare. Avantajul său este că ajută la evitarea avorturilor repetate după diagnosticul prenatal de rutină în familiile cu risc crescut de patologie ereditară.
Diagnosticul preimplantare este de succes în următoarele condiții:
Obținerea unui embrion în stadiul de dezvoltare preimplantare (până la 5-7 zile după fertilizare);
Disponibilitatea micrometodelor de diagnostic (analitice) la nivelul uneia sau mai multor celule;
Tehnica microchirurgicala (microbiopsie) pentru prelevarea unui numar minim de celule fara deteriorarea veziculei germinale;
Indicații medicale exacte din partea familiei pentru diagnostic.
Embrionii preimplantați pot fi obținuți prin lavaj uterin nechirurgical și fertilizare in vitro.
Prin utilizarea lavaj uterin este posibil să se obțină un embrion care nu s-a implantat încă în 90-130 de ore de la fertilizare. În acest moment, embrionul coboară din trompele uterine în uter. Această procedură este nedureroasă și sigură. Dispozitivele corespunzătoare (captatorul, ghidajul și cateterul) au fost deja testate.
Procedura nu afectează ciclurile ovariene ulterioare și nu interferează cu sarcinile viitoare.
După implantarea embrionului în uter, sarcina normală apare în 50% din cazuri. Fertilizarea in vitro și injectarea intracitoplasmatică a spermatozoizilor în ovocit
(ICSI) s-au dovedit bine în practica obstetricală. Aceste metode sunt folosite pentru a depăși diferite tipuri de infertilitate.
Procedura de microchirurgie pentru izolarea unei celule pentru diagnosticul de laborator se realizează cu ajutorul unui micromanipulator (Fig. 11.10). Din embrion în stadiul de 8-16 celule, se pot separa 1-2 celule. Uneori studiul se limitează la corpul polar secundar (poartă genomul oului). Embrionul este conservat
în condiții de înghețare adâncă (sau embrionul continuă să se dezvolte în condiții artificiale) în timp ce celula este analizată.
Replantarea după îngheț este posibilă în timpul oricărui alt ciclu ovarian.
Diagnosticarea la nivelul uneia sau mai multor celule este posibilă în prezent pentru multe boli. Se efectuează folosind PCR, anticorpi monoclonali și metode ultramicroanalitice. Au existat deja rapoarte de diagnostic de succes în stadiul preimplantare al sindromului Marfan, distrofie miotonică, coree Huntington, cancer de colon polipoză familială, fibroză chistică,

Gangliozidoza OM2 (boala Tay-Sachs), sindromul Lesch-Nyhan, talasemie, atrofie musculară spinală, distrofie musculară Duchenne, retard mintal cu cromozom X fragil, fenilcetonurie. Orez. 11.10.
Astăzi, diagnosticele preimplantare sunt disponibile pentru aproximativ 50 de forme nosologice de natură monogenă și cromozomială.
Se poate spera că în următorii ani capacitățile metodologice ale diagnosticului preimplantare se vor extinde atât în domeniul obținerii de material de diagnostic, cât și al metodelor analitice (cultivarea embrionilor preimplantare și a blastomerilor acestora, micromanipulare, crioconservare).
Diagnosticul preimplantare este un domeniu extrem de important în sistemul noilor tehnologii de reproducere, deoarece din motive încă neclare, frecvența aneuploidiei la embrionii umani, conform datelor cercetătorilor autohtoni, este foarte mare.
ridicat: 30-50% dintre embrionii anormali la evaluarea aneuploidiei pe cromozomii 13, 16, 18, 21, 22, X și Y. Mai multe informații despre diagnosticul preimplantare găsiți în articolul de A.V. Svetlakova și colab. „Provocări și perspective ale diagnosticului genetic preimplantare” pe CD.
DIAGNOSTIC PRECLINIC,
PROGRAME DE SCREENING SI TRATAMENT PREVENTIV
Idee cernere (cernire) născut în SUA la începutul secolului al XX-lea. (examinarea școlarilor, examinări preventive pentru depistarea tuberculozei, examinări regulate ale lucrătorilor etc.). Tehnicile enumerate au intrat cu încredere în practica asistenței medicale globale.
Screening-ul implică o examinare în masă și neselectivă, un focus preventiv și un diagnostic în două etape (cel puțin). Screening
(screening) poate fi definit ca identificarea bolilor nerecunoscute folosind teste efectuate rapid. Acest lucru asigură selecția persoanelor cu boală probabilă. Ele sunt reexaminate folosind metode de diagnostic clarificatoare, care permit fie respingerea diagnosticului asumat în prima etapă, fie confirmarea acestuia.
Ideea screening-ului în masă a nou-născuților pentru o boală ereditară a început să fie testată în anii 60 ai secolului XX. Până acum, prevederile de bază pentru diagnosticarea în masă a bolilor ereditare în stadiul preclinic au fost deja finalizate (criteriile de selectare a bolilor ereditare pentru screening și metode de diagnostic). Screening în masă a nou-născuților
pentru boli ereditare se efectuează dacă:
Fără un tratament preventiv în timp util, acestea reduc semnificativ vitalitatea, duc la dizabilitate și nevoia de îngrijire specială pentru pacient;
Disponibil pentru diagnostic biochimic sau genetic molecular precis în stadiul preclinic;
Au o frecvență de 1:10.000 și mai mare. Doar în unele țări, dacă există un grup de cercetare, screening-ul nou-născuților
Acestea sunt efectuate pentru bolile care apar cu o frecvență de 1: 20.000-1: 40.000. Metodele de diagnosticare pentru screening-ul în masă a nou-născuților trebuie să îndeplinească următoarele criterii.
Economic. Metodele ar trebui să fie simple din punct de vedere tehnic și ieftine pentru cercetarea în masă.
Semnificație diagnostică. Practic nu ar trebui să existe rezultate fals negative, iar raportul dintre pozitive adevărate și pozitive false ar trebui să fie de cel puțin 1:5. Aceasta poate fi numită sensibilitatea și specificitatea metodei.
Fiabilitate sau reproductibilitate. Rezultatele sondajului ar trebui reproduse în mod egal în munca diferiților cercetători.
Disponibilitatea materialului biologic. Metoda trebuie adaptată la analiza materialului biologic care se obține cu ușurință în cantități mici, bine conservat (cel puțin pentru câteva zile) și acceptabil pentru expediere la un laborator centralizat.
Scopul principal al programelor de screening în masă a nou-născuților pentru boli ereditare este depistarea precoce a bolii în stadiul preclinic (presimptomatic) și organizarea tratamentului. Programul include neapărat următoarele etape:
Preluarea materialului biologic pentru cercetare de la toți nou-născuții și livrarea materialului la laboratorul de diagnostic;
Diagnosticarea cernerii de laborator;
Clarificarea diagnosticului tuturor cazurilor cu rezultate pozitive în timpul screening-ului;
Tratamentul și examinarea medicală a pacienților cu monitorizarea progresului tratamentului;
Consiliere medicală și genetică a familiilor.
Astfel, programele de screening în masă pentru boli ereditare care pot fi tratate preventiv pot fi stabilite numai în cadrul asistenței medicale federale sau regionale (inclusiv orașului). Aceasta necesită organizarea unei verigi speciale în structura sănătății și costuri economice considerabile, care la scară națională sunt compensate de scăderea numărului de persoane cu dizabilități încă din copilărie. Numeroase studii efectuate în diferite țări au arătat că eficiența economică a programelor de screening (conservarea sănătății persoanelor tratate) oferă statului un beneficiu economic de 5-10 ori.
Primul program de screening pentru nou-născuți pentru fenilcetonurie a fost înființat în Statele Unite în urmă cu aproximativ 25 de ani. De-a lungul timpului, programe pentru mai mult de 10 boli metabolice moștenite au fost, de asemenea, testate în diferite țări. Ca urmare, au fost elaborate criteriile de mai sus pentru diagnosticarea în masă a bolilor ereditare. În cele din urmă, țările cu asistență medicală dezvoltată au început să efectueze screening în masă a nou-născuților doar pentru câteva boli, ale căror caracteristici sunt prezentate în tabel. 11.9. Trebuie remarcat faptul că aceste recomandări se aplică populațiilor caucaziene. Pentru alte rase și, uneori, populații, frecvența acestor boli poate fi mai mică și atunci nu va exista nicio indicație pentru diagnosticarea lor în masă.
Tabelul 11.9. Caracteristicile bolilor pentru care se efectuează screening-ul în masă a nou-născuților

Din 2006, Rusia efectuează screening-ul neonatal a cinci boli ereditare: sindrom suprarenogenital, galactozemie, hipertiroidism congenital, fibroză chistică, fenilcetonurie - cu scopul de a depista precoce, tratament în timp util, prevenire a dizabilității, dezvoltarea consecințelor clinice severe și reducerea acestora. a mortalitatii infantile.
Pentru efectuarea screening-ului neonatal, se prelevează probe de sânge din călcâiul unui nou-născut în a 4-a zi de viață (la sugarii la termen) și în a 7-a zi la prematuri, la 3 ore după hrănire. Probele de sânge sunt prelevate folosind formulare speciale de testare a filtrului, care sunt eliberate prin consultație medicală genetică
instituții de îngrijire medicală care oferă îngrijiri medicale femeilor în timpul nașterii. Rezultatele, problemele și perspectivele screening-ului neonatal pot fi găsite în articolul cu același nume al lui L.P. Nazarenko și colab. pe CD.
fenilcetonurie
În Rusia, în ultimele decenii, a fost introdus un program federal de screening, bazat pe o metodă cantitativă fluorometrică pentru determinarea fenilalaninei în sânge. Diferite țări folosesc metode diferite. Esența diagnosticării fenilcetonuriei este de a cuantifica concentrația de fenilalanină din sânge. Experiența a arătat că cazurile ratate de fenilcetonurie nu sunt erori în metodele de laborator, ci sunt o consecință a necinstei sau neglijenței în recoltarea sângelui în maternități.
În cazul unui rezultat pozitiv al screening-ului, copiii sunt supuși unui diagnostic biochimic de clarificare. Aceasta este o procedură mai complexă, uneori în mai multe etape. În primul rând, este necesar să se confirme hiperfenilalaninemia și, în al doilea rând, este necesar să se înțeleagă cauza acesteia. Poate fi cauzată de fenilcetonurie tipică (deficit de fenilalanin hidroxilază), forme variante sau atipice ale acestei boli, hiperfenilalaninemie ereditară (benignă) și alte forme de tulburări metabolice.
Dacă diagnosticul de fenilcetonurie este confirmat, copilul este transferat la o dietă artificială fără fenilalanină.
Tabelul 11.10 prezintă denumirile formulelor nutriționale pentru hrănirea copiilor cu fenilcetonurie.
Tabelul 11.10. Amestecuri nutriționale fără fenilalanină

Vitaminele și sărurile minerale sunt date sub formă de preparate farmacologice. În timp, dieta este extinsă. Copiii cu vârsta peste 1 an tolerează mai ușor fenilalanina alimentară. Tratamentul dietetic se efectuează sub monitorizarea biochimică regulată a concentrației de fenilalanină în sânge: de 2 ori pe săptămână în prima lună (de obicei aceasta este perioada de spitalizare), săptămânal până la vârsta de 6 luni, de 2 ori pe lună la vârsta de 6 luni - 1 an si lunar ulterior . Acest control ne permite să determinăm caracterul adecvat al terapiei.
Odată cu inițierea la timp a tratamentului cu o dietă fără fenilalanină în primele luni după naștere, copiii homozigoți pentru gena deficitului de fenilalanină hidroxilază nu prezintă semne clinice de întârziere a dezvoltării mentale sau fizice. De la 9-11 ani, dieta la astfel de pacienți poate fi extinsă semnificativ, dar ei rămân sub supravegherea unui genetician. Acest lucru este valabil mai ales pentru femeile cu fenilcetonurie, deoarece în timpul sarcinii, nivelurile crescute de fenilalanină și derivații săi din serul unei femei sunt toxice pentru un făt sănătos genetic. Acest lucru necesită măsuri speciale de prevenire.
Hipotiroidismul congenital
Termenul „hipotiroidism congenital” se referă la suma patologiilor ereditare și neereditare: agenezia glandei tiroide, ectopie a glandei tiroide, dishormonogeneza (boli ereditare), procese autoimune. Principalele manifestări clinice: întârziere mintală, întârziere severă a creșterii, umflarea pielii și cu dishormonogeneză - dezvoltarea gușii. Același program de screening în masă este acceptabil pentru toate formele de boală, deoarece markerii biochimici sunt o scădere a tiroxinei plasmatice și o creștere a hormonului de stimulare a tiroidei (TSH). Semnificația diagnostică a cernerii este pe deplin demonstrată la determinarea ambilor markeri, dar din motive economice aceștia se opresc adesea la determinarea TSH.
Sunt utilizate metode de diagnostic de screening radioimun și imunoenzimatic (imunofluorescent). Sensibilitatea și specificitatea lor sunt aproximativ aceleași. Metoda imunosorbantă legată de enzime este de preferată din motive tehnice. Tiroxina și TSH sunt determinate în probe de sânge
nou-născuți uscați pe hârtie de filtru specială (vezi mai sus).
Dacă rezultatul este pozitiv, diagnosticul trebuie confirmat de un endocrinolog într-un cadru clinic și rezultatul unei analize de laborator a serului sanguin pentru tiroxină, TSH și alți hormoni.
Terapia de substituție cu levotiroxină sodică (L-tiroxina ) trebuie începută la copiii cu un test de screening pozitiv înainte ca diagnosticul să fie confirmat definitiv. Eficacitatea terapiei este destul de mare, dar tratamentul început după a 2-a lună de viață este ineficient, deși până la această vârstă boala se manifestă clinic la doar 4% dintre pacienți. Acest lucru face ca diagnosticul precoce să fie deosebit de important.
Hiperplazia suprarenală congenitală
Această formă clinică combină 9 tulburări ereditare ale proceselor enzimatice în trei căi metabolice interconectate ale steroidogenezei. Cea mai frecventă deficiență este deficiența de 21-hidroxilază, pe baza căreia au fost dezvoltate metode de screening pentru nou-născuți. Aceste metode identifică un marker biochimic al bolii - o creștere a conținutului de 17-α-hidroxiprogesteron în sânge. Au fost dezvoltate metode de radioimunotest și imunoenzime care fac posibilă detectarea clară a nivelurilor crescute de 17-α-hidroxiprogesteron. Sensibilitatea ambelor metode este destul de mare, dar din motive tehnice este de preferat metoda imunoenzimatică.
Atunci când se pune un diagnostic pe baza tabloului clinic, este necesară confirmarea de laborator.
Tratamentul este terapia de substituție hormonală, care are de obicei succes.
Galactozemie
În Rusia, din 2006, s-a efectuat screening pentru galactozemie. Această boală este o consecință a mutațiilor la nivelul enzimelor implicate în metabolismul galactozei. Din cauza deficienței acestor enzime, în organism se acumulează metaboliți toxici (galactoză și galactoză-1-fosfat), care afectează negativ organele interne (ficat, creier, rinichi, intestine). În plus, galactozemia se caracterizează prin inhibarea activității leucocitelor, ceea ce duce cel mai adesea la sepsis. Boala se manifestă la 1-2 săptămâni de viață. Fără tratament, copiii nu trăiesc mai mult de șase luni.
Screeningul nou-născutului se efectuează în a 4-a zi la sugarii născuți la termen și în a 7-a zi la prematuri. Este important ca copilul să fie alăptat sau hrănit cu formule care conțin galactoză.
Există mai multe abordări pentru a detecta galactozemia. La noi, nivelul metaboliților și galactozei din serul nou-născuților este evaluat prin spectrometrie de masă în tandem. Dacă nivelul de galactoză este >7 mg% în serul nou-născutului, testul se repetă dacă nivelul este >10 mg%, se consideră pozitiv. În același timp, analiza enzimatică este efectuată folosind metoda fluorometrică. Principalul avantaj al analizei enzimatice este capacitatea de a detecta deficiența indiferent de natura nutriției. Cu toate acestea, această metodă ne permite să identificăm doar homozigoți pentru mutația galactoz-1-fosfat uridil transferazei (în gena GALT), în timp ce heterozigoții și homozigoții pentru mutațiile altor enzime (galactokinaza și UDP-galactoză-4-epimeraza) pot fi omise.
Principalul dezavantaj al screening-ului biochimic al nou-născuților pentru galactozemie este numărul destul de mare de rezultate fals pozitive. Acest lucru se datorează faptului că condițiile de obținere, transport și depozitare a materialului (temperatură, umiditate) pot duce la scăderea activității enzimatice.
Diagnosticul este confirmat prin metode genetice moleculare. Au fost deja găsite peste 180 de mutații diferite ale genei GALT, dar cele mai comune sunt Q188R și K285N. Împreună, ele reprezintă aproximativ 70% din cazurile formei clasice de galactozemie. De asemenea, a fost descrisă mutația N314D în aceeași genă, care duce la galactozemie Duarte. Acest tip de galactozemie are o evoluție relativ blândă nivelul enzimei scade ușor, ceea ce duce la un tablou clinic șters. Galactozemia Duarte poate fi detectată cel mai adesea doar prin screening.
Până în prezent, introducerea screening-ului nou-născutului pentru galactozemie este considerată o problemă controversată, deoarece această boală nu îndeplinește toate criteriile OMS pentru screening-ul în masă: boala este rară, se poate manifesta chiar înainte de obținerea rezultatelor screening-ului, iar tratamentul nu este întotdeauna efectuat. ameliorează complet toate simptomele. Prin urmare, recent s-a vorbit din ce în ce mai mult despre screening-ul selectiv pentru galactozemie, inclusiv studii metabolice împreună cu studii genetice moleculare în grupurile de risc. Acesta este modul în care fals pozitive pot fi excluse.
rezultatele screening-ului și determina tipul de galactozemie, care va crește semnificativ eficacitatea tratamentului.
Tratamentul galactozemiei presupune eliminarea galactozei din alimentație. Acest lucru vă permite să reduceți și să preveniți dezvoltarea complicațiilor de la organele interne. Cu toate acestea, inițierea timpurie a tratamentului nu afectează apariția consecințelor pe termen lung. Pacienții cu galactozemie prezintă adesea o întârziere a dezvoltării mintale și a vorbirii, dezvoltă tulburări endocrinologice și neurologice și anomalii ale organelor genitale. Puteți afla mai multe despre galactozemie în articolul lui E.Yu. Zakharova și colab. „Galctozemie tip I: manifestări clinice, diagnostic și tratament” pe CD.
Fibroza chistica
Screening-ul neonatal pentru fibroza chistică se bazează pe o creștere semnificativă a concentrației de tripsină imunoreactivă în sângele nou-născuților care suferă de această boală. Protocolul de screening pentru fibroza chistica include 4 etape.
Test primar pentru tripsina imunoreactivă. Dacă nivelul de tripsină imunoreactivă este mai mare sau egal cu 70 ng/ml, atunci se efectuează a doua etapă.
Un retest pentru tripsina imunoreactivă este efectuat în zilele 21-28. Dacă nivelul de tripsină imunoreactivă este mai mare sau egal cu 40 ng/ml, atunci treceți la a treia etapă.
Test de transpirație - determinarea clorurilor din transpirație folosind o metodă biochimică. Dacă conținutul de clorură este de 60-80 mmol/l (rezultat limită), atunci se efectuează a 4-a etapă. Dacă este mai mare de 80 mmol/l, atunci screening-ul pentru fibroza chistică este considerat pozitiv.
Diagnosticarea ADN (examinarea genetică moleculară se efectuează dacă testul de transpirație are rezultate îndoielnice sau la cererea părinților).
Confirmarea genetică moleculară este disponibilă numai în unele regiuni din Rusia, așa că etapa cheie a screening-ului este un test de transpirație, care se face de obicei de două ori.
Măsurile de tratament și reabilitare precoce, inclusiv terapia de substituție enzimatică, conduc la o îmbunătățire a stării nutriționale, ceea ce duce la o îmbunătățire a stării și la încetinirea proceselor ireversibile din sistemul bronhopulmonar și, prin urmare, determină o speranță de viață mai mare. Devreme
Identificarea pacienților cu fibroză chistică contribuie la prevenirea acestei boli prin diagnosticul prenatal.
Deci, manifestările clinice ale patologiei ereditare pot fi prevenite prin tratamentul preventiv al bolii în stadiul presimptomatic. Progresul medicinei moleculare și clinice ne permite să mergem mai departe pe calea copierii normale a stărilor genetice patologice. Metodele sunt deja dezvoltate tratament prenatal(vezi Tabelul 11.3) și există experiență în tratarea aciduriei metilmalonice în stadiul intrauterin cu doze mari de vitamina B 12.
Deficitul de carboxilază este tratat prenatal cu biotină. Tratamentul cu dexametazonă pentru deficitul congenital de 21-hidroxilază poate începe din a 9-a săptămână de sarcină dacă a fost efectuat diagnosticul prenatal. Pentru femeile cu fenilcetonurie și heterozigote pentru gena fenilcetonuriei, se recomandă o dietă cu conținut scăzut de fenilalanină în timpul sarcinii. Recent s-a dezvoltat ipoteza de prevenire a preconcepției.
Perioada unei astfel de prevenire include câteva luni înainte de concepție și etapele incipiente ale dezvoltării embrionului. Se presupune că pregătirea corpului unei femei (o dietă completă fortificată, terapie antioxidantă, corectarea imunității, lipsa stresului) înainte de concepție și în stadiile incipiente ale dezvoltării embrionului (până în săptămâna a 10-a) ajută la reducerea incidenței malformațiilor congenitale. de natură multifactorială. Acest lucru este arătat în mod clar în special pentru anomaliile tubului neural (diverse variante de spina bifida) și malformațiile cardiace congenitale. Frecvența renașterii unui copil cu acest defect este în medie de 4,6%, iar la femeile care au luat acid folic și vitamina C - 0,7%.
CUVINTE CHEIE ȘI CONCEPTE
Inginerie genetică și prevenție primară
Povara patologiei ereditare (consecințe medicale)
Diagnosticul prenatal de laborator
Consiliere genetică medicală
Metode de diagnostic prenatal
Screeningul metodelor de diagnostic prenatal
Prevenirea primară, secundară și terțiară a bolilor ereditare
Programe de screening de diagnostic pentru boli metabolice la nou-născuți
Tratament preventiv Teratanasia
Diagnosticul ecografic al malformațiilor congenitale Corecția fenotipică Funcțiile unui genetician
Lavrov A.V. Celulele fetale și ADN-ul fetal liber în sângele matern în diagnosticul prenatal non-invaziv // Genetica medicală. - 2009. - T. 8. - Nr. 7. - P. 3-8.
Diagnosticul prenatal al bolilor ereditare și congenitale / ed. E.K. Ailamazyan, V.S. Baranova. - M.: MEDpressinform, 2006. - 416 p.
Interesul pentru problema bolilor ereditare este în creștere pe măsură ce numărul patologiilor ereditare în rândul populației crește. Mai mult, această creștere se datorează nu atât creșterii absolute a numărului de boli ereditare, cât îmbunătățirii diagnosticului formelor necunoscute anterior. Devine din ce în ce mai clar că cunoașterea cauzelor și mecanismelor de dezvoltare a bolilor ereditare umane este cheia prevenirii acestora.
Una dintre modalitățile de prevenire a bolilor ereditare este prevenirea acțiunii factorilor de mediu care contribuie la manifestarea unei gene patologice.
Prevenire:(Diapozitivul 26)
- Consiliere genetică medicală în timpul sarcinii la vârsta de 35 de ani și peste în prezența bolilor ereditare în pedigree
- Excluderea căsătoriilor consanguine. Cu toate acestea, au fost descrise unele triburi indiene în care nu au apărut boli ereditare în căsătoriile consanguine timp de 14 generații. Se știe, de exemplu, că Charles Darwin și Abraham Lincoln s-au născut din căsătorii consanguine. Darwin însuși a fost căsătorit cu vărul său, iar cei trei fii născuți în această căsătorie erau absolut sănătoși și au devenit ulterior oameni de știință celebri. CA. Pușkin s-a născut din căsătoria lui S.L. Pușkin cu verișoara lui Nadejda Hannibal.
Consultatie genetica. Motivele pentru a solicita consiliere genetică pot fi foarte diferite. De exemplu, părinții îl pot contacta dacă le este frică să aibă un copil cu o boală determinată genetic. Studiile genetice pot prezice probabilitatea unor astfel de boli dacă, de exemplu:
- Părinții au o boală genetică în familia lor;
- Un cuplu căsătorit are deja un copil bolnav;
- Într-un cuplu căsătorit, soția a avut în mod repetat avorturi spontane;
- Cuplu vârstnic;
- Am rude cu boli genetice.
O condiție prealabilă pentru o consultare eficientă este, dacă este posibil, o analiză detaliată a genealogiei familiei cu privire la bolile ereditare.
Testul de heterozigozitate ne permite să tragem concluzii cu privire la defectele metabolice determinate genetic care apar la părinți într-o formă ștearsă, întrucât purtătorii heterozigoți ai trăsăturii sintetizează substanțe reglatoare în cantități mici.
Diagnosticul prenatal (prenatal).În acest diagnostic, din sacul amniotic sunt prelevați câțiva mililitri de lichid amniotic. Celulele fetale conținute în lichidul amniotic ne permit să tragem concluzii atât despre tulburările metabolice, cât și despre mutațiile cromozomiale și genetice.
Tratament:(Diapozitivul 27)
- Dietoterapia
- Terapia de substituție
- Eliminarea produselor metabolice toxice
- Efectul mediometori (asupra sintezei enzimatice)
- Excluderea anumitor medicamente (barbiturice, sulfonamide etc.)
- Tratament chirurgical
Astăzi se dezvoltă în mod activ o nouă metodă - terapia genică. Poate fi folosit pentru a vindeca o persoană cu o boală determinată genetic, sau cel puțin pentru a reduce severitatea bolii. Prin această metodă, genele defecte pot fi înlocuite cu unele „sănătoase” și boala poate fi oprită prin eliminarea cauzei (gena defectuoasă). Cu toate acestea, interferența direcționată cu informațiile genetice umane implică riscul de abuz prin manipularea celulelor germinale și, prin urmare, este contestată activ de mulți. În ciuda faptului că majoritatea cercetărilor privind inginerie genetică se află în stadiul de testare de laborator, dezvoltarea ulterioară a acestui domeniu ne permite să sperăm în utilizarea practică a metodei pentru tratarea pacienților în viitor.
Eugenie(din greacă ευγενες - „bun tip”, „pursânge”) - o formă de filozofie socială, doctrina sănătății ereditare a unei persoane, precum și modalități de a-și îmbunătăți proprietățile ereditare. Eugenia este, de asemenea, numele dat practicii sociale asociate cu această filozofie. În știința modernă, multe probleme ale eugeniei, în special lupta împotriva bolilor ereditare, sunt rezolvate în cadrul geneticii umane. Ideile de eugenie au fost discreditate deoarece au fost folosite pentru a justifica teorii antiumaniste (de exemplu, teoria rasială fascistă). Cercetătorii folosesc metode de genetică a populației și studiază frecvența și dinamica defectelor determinate genetic și genele responsabile pentru aceste defecte în populațiile umane. Scopurile eugeniei sunt:
- cercetări și consultări pe probleme de moștenire, adică transmiterea către descendenți a genelor care cauzează boli și, în consecință, prevenirea acestora;
- studiul modificărilor informațiilor ereditare umane sub influența factorilor de mediu manifestați în caracteristicile genetice;
- conservarea fondului genetic uman.
Conţinut
În timpul vieții, o persoană suferă de multe boli ușoare sau severe, dar în unele cazuri se naște cu ele. Bolile ereditare sau tulburările genetice apar la un copil din cauza unei mutații a unuia dintre cromozomii ADN, care duce la dezvoltarea bolii. Unele dintre ele poartă doar modificări externe, dar există o serie de patologii care amenință viața copilului.
Ce sunt bolile ereditare
Acestea sunt boli genetice sau anomalii cromozomiale, a căror dezvoltare este asociată cu o tulburare în aparatul ereditar al celulelor transmise prin celulele reproductive (gameți). Apariția unor astfel de patologii ereditare este asociată cu procesul de transmitere, implementare și stocare a informațiilor genetice. Din ce în ce mai mulți bărbați au probleme cu acest tip de anomalie, așa că șansele de a concepe un copil sănătos sunt din ce în ce mai mici. Medicina cercetează constant pentru a dezvolta o procedură de prevenire a nașterii copiilor cu dizabilități.
Motive
Bolile genetice de tip ereditar se formează prin mutarea informației genetice. Ele pot fi detectate imediat după nașterea unui copil sau după o lungă perioadă de timp în timpul dezvoltării îndelungate a patologiei. Există trei motive principale pentru dezvoltarea bolilor ereditare:
- anomalii cromozomiale;
- tulburări cromozomiale;
- mutații genetice.
Ultimul motiv este inclus în grupa de tip predispus ereditar, deoarece dezvoltarea și activarea lor sunt influențate și de factorii de mediu. Un exemplu izbitor de astfel de boli este hipertensiunea arterială sau diabetul zaharat. Pe lângă mutații, progresia lor este influențată de suprasolicitarea prelungită a sistemului nervos, alimentația deficitară, trauma mentală și obezitatea.
Simptome
Fiecare boală ereditară are propriile simptome specifice. În prezent, se cunosc peste 1.600 de patologii diferite care cauzează anomalii genetice și cromozomiale. Manifestările variază ca severitate și luminozitate. Pentru a preveni apariția simptomelor, este necesar să se identifice probabilitatea apariției lor în timp. Pentru aceasta sunt utilizate următoarele metode:
- Geamănă. Patologiile ereditare sunt diagnosticate prin studierea diferențelor și asemănărilor gemenilor pentru a determina influența caracteristicilor genetice și a mediului extern asupra dezvoltării bolilor.
- Genealogic. Probabilitatea de a dezvolta trăsături anormale sau normale este studiată folosind pedigree-ul unei persoane.
- citogenetic. Se studiază cromozomii oamenilor sănătoși și bolnavi.
- Biochimic. Metabolismul uman este monitorizat și sunt evidențiate caracteristicile acestui proces.
Pe lângă aceste metode, majoritatea fetelor sunt supuse unei examinări cu ultrasunete în timpul sarcinii. Ajută la determinarea, pe baza caracteristicilor fetale, a probabilității apariției malformațiilor congenitale (din primul trimestru), pentru a sugera prezența unui anumit număr de boli cromozomiale sau afecțiuni ereditare ale sistemului nervos la copilul nenăscut.
La copii
Marea majoritate a bolilor ereditare apar în copilărie. Fiecare dintre patologii are propriile simptome care sunt unice pentru fiecare boală. Există un număr mare de anomalii, așa că vor fi descrise mai detaliat mai jos. Datorită metodelor moderne de diagnostic, este posibil să se identifice abaterile în dezvoltarea unui copil și să se determine probabilitatea apariției bolilor ereditare chiar și în timpul transportului unui copil.
Clasificarea bolilor ereditare umane
Bolile genetice sunt grupate în funcție de apariția lor. Principalele tipuri de boli ereditare sunt:
- Genetic – rezultă din deteriorarea ADN-ului la nivel de genă.
- Predispoziție ereditară, boli autosomal recesive.
- Anomalii cromozomiale. Bolile apar din cauza apariției unui cromozom în plus sau a pierderii unuia dintre cromozomi sau a aberațiilor sau delețiilor acestora.

Lista bolilor ereditare umane
Știința cunoaște mai mult de 1.500 de boli care se încadrează în categoriile descrise mai sus. Unele dintre ele sunt extrem de rare, dar mulți oameni cunosc anumite tipuri. Cele mai cunoscute patologii includ următoarele:
- boala Albright;
- ihtioză;
- talasemie;
- sindromul Marfan;
- otoscleroza;
- mioplegie paroxistica;
- hemofilie;
- boala Fabry;
- distrofie musculară;
- sindromul Klinefelter;
- sindromul Down;
- sindromul Shereshevsky-Turner;
- sindromul plânsului pisicii;
- schizofrenie;
- luxație congenitală de șold;
- defecte cardiace;
- palato-despicătură și buză;
- sindactilie (fuziunea degetelor).
Care sunt cele mai periculoase?
Dintre patologiile enumerate mai sus, există acele boli care sunt considerate periculoase pentru viața umană. De regulă, această listă include acele anomalii care au polisomie sau trisomie în setul de cromozomi, când în loc de două sunt de la 3 la 5 sau mai multe. În unele cazuri, se detectează 1 cromozom în loc de 2. Toate astfel de anomalii sunt rezultatul unor anomalii în diviziunea celulară. Cu această patologie, un copil trăiește până la 2 ani dacă abaterile nu sunt foarte grave, atunci trăiește până la 14 ani; Cele mai periculoase afecțiuni sunt:
- boala Canavan;
- sindromul Edwards;
- hemofilie;
- sindromul Patau;
- amiotrofie musculară spinală.
sindromul Down
Boala este moștenită atunci când ambii sau unul dintre părinți au cromozomi defecte. Sindromul Down se dezvoltă din cauza cromozomilor trisomiei 21 (în loc de 2 există 3). Copiii cu această boală suferă de strabism, au urechi de formă anormală, o cută în gât, retard mental și probleme cardiace. Această anomalie cromozomială nu pune viața în pericol. Conform statisticilor, 1 din 800 se naște cu acest sindrom. Femeile care doresc să nască după 35 de ani, probabilitatea de a avea un copil cu Down crește (1 din 375 după 45 de ani, probabilitatea este de 1 din 30);

Acrocraniodisfalangie
Boala are un tip autozomal dominant de moștenire a anomaliei, cauza fiind o tulburare a cromozomului 10. Oamenii de știință numesc boala acrocraniodisfalangie sau sindrom Apert. Se caracterizează prin următoarele simptome:
- încălcări ale raportului dintre lungimea și lățimea craniului (brahicefalie);
- Hipertensiunea arterială (hipertensiune) se dezvoltă în interiorul craniului din cauza fuziunii suturilor coronare;
- sindactilie;
- retard mental datorat comprimării creierului de către craniu;
- frunte proeminentă.
Care sunt opțiunile de tratament pentru bolile ereditare?
Medicii lucrează în mod constant la problema anomaliilor genelor și cromozomilor, dar orice tratament în această etapă se rezumă la suprimarea simptomelor nu poate fi obținută. Terapia este selectată în funcție de patologie pentru a reduce severitatea simptomelor. Următoarele opțiuni de tratament sunt adesea utilizate:
- Creșterea cantității de coenzime primite, de exemplu, vitamine.
- Dietoterapia. Un punct important care ajută la scăderea unui număr de consecințe neplăcute ale anomaliilor ereditare. Dacă dieta este încălcată, se observă imediat o deteriorare bruscă a stării pacientului. De exemplu, cu fenilcetonurie, alimentele care conțin fenilalanină sunt complet excluse din dietă. Refuzul acestei măsuri poate duce la o idioție severă, așa că medicii se concentrează pe necesitatea terapiei dietetice.
- Consumul acelor substanțe care sunt absente în organism din cauza dezvoltării patologiei. De exemplu, pentru orotacidurie, este prescris acidul citidilic.
- În cazul tulburărilor metabolice, este necesar să se asigure curățarea în timp util a organismului de toxine. Boala Wilson-Konovalov (acumularea de cupru) este tratată cu d-penicilamină, iar hemoglobinopatia (acumularea de fier) este tratată cu desferal.
- Inhibitorii ajută la blocarea activității excesive a enzimelor.
- Este posibil să transplantați organe, secțiuni de țesut și celule care conțin informații genetice normale.