В современной науке гиперандрогения яичникового генеза представляет собой патологическое изменение в организме, при котором в гормональном фоне женщины происходят существенные сбои. Данную болезнь вызывает чрезмерная выработка мужских половых гормонов. В женском организме андрогены отыгрывают немаловажную роль, однако, если они производятся в слишком большом количестве, это приводит к болезни, лечение которой является обязательным. Данные гормоны вырабатывают надпочечники, адипоциты и яичники. Андрогены просто необходимы для полноценного полового созревания женщины. Именно они влияют на рост волос в области подмышек и гениталий, отвечают за регулирование работы почек и печени. Кроме того, мужские гормоны позволяют женской репродуктивной системе работать без сбоев. В организме взрослых женщин андрогены обеспечивают синтез эстрогенов, которые укрепляют костную ткань и поддерживают либидо на необходимом уровне.
Гиперандрогения и ее виды

Гиперандрогения — достаточно распространенное заболевание, которое становится причиной аменореи и бесплодия. Эту патологию вызывает изменение процессов секреции и метаболизма андрогенов. У 45-77 процентов пациенток заболевание вызывает нарушение цикла. В 60-75 процентах случаев патология приводит к эндокринному бесплодию, а в 20-30 процентах — к невынашиванию плода. Существуют такие виды заболевания:
- яичниковая гиперандрогения;
- надпочечниковая;
- центральная;
- смешанная;
- периферическая.
Центральная и периферическая разновидность болезни встречается достаточно редко. Первая из них вызвана поражением гипоталамуса и гипофиза, а вторая — наследственным фактором или сахарным диабетом.
Яичниковая гиперадрогения

Гиперандрогения, имеющая яичниковый генез это заболевание, которое нередко приводит к появлению синдрома поликистозных яичников и невынашиванию беременности. Характерным симптомом данного типа болезни является бесплодие, нерегулярность менструального цикла, вплоть до полного отсутствия менструации и гирсутизма. Главным источником повышенной выработки андрогенов в этом случае являются яичники. Многие женщины с таким заболеванием страдают от лишнего веса, гиперинсулинемии и инсулинорезистентности. Нормализовать состояние при этом нередко удается методом снижения массы тела, что, в свою очередь, приводит в порядок уровень мужских половых гормонов. У больных с такой патологией отмечается отсутствие овуляции, олигоменорея и потеря генеративной функции. Все это становится причиной первичного бесплодия. Даже если беременность наступила, чаще всего она заканчивается прерыванием и последующим вторичным бесплодием.
Важно! Если поставлен такой диагноз, как яичниковая гиперандрогения, результаты гормонального обследования будут указывать на превышенное количество в крови пациентки тестостерона, лютеинизирующего и фолликулостимулирующего гормона. На УЗИ такая патология проявляется в виде гиперплазии стромы яичников, увеличения их объема и наличия свыше десяти фолликулов, размер которых достигает пяти-десяти миллиметров. Фолликулы при этом заболевании располагаются в утолщенной капсуле.
Надпочечниковый генез и смешанная форма

Надпочечниковая гиперандрогения вызвана чрезмерным содержанием дегидроэпиандростерона и 17а-гидроксипрогестерона. Данная патология у тридцати процентов пациенток вызывает невынашивание плода. У женщин с надпочечниковой гиперандрогенией нередко наблюдаются признаки маскулинизации. Эта болезнь требует точнейшей диагностики, так как адреногенитальный синдром в большинстве случаев выражен слабо. Чаще всего патология связана с недостаточным содержанием альдостерона. Гормоны производятся в коре надпочечников и синтезируются глюкокортикоидами. Если такие ферменты отсутствуют, их замещают андрогены. Адреногенитальный синдром в основном является наследственным заболеванием, при котором менструация начинается намного позже, чем у других женщин; на теле и лице появляется обильная угревая сыпь и пигментация. Пациентки отличаются мужской фигурой и гипоплазией молочных желез. Если говорить о половых органах, особы с такой патологией имеют небольшие размеры матки и гипертрофированный клитор.
Смешанная форма считается самой неоднородной по количеству гормонов в крови и клиническим признакам. Среди пациенток с данным заболеванием такая разновидность патологии считается самой распространенной. Эта болезнь сопровождается увеличением в крови уровня дегидроэпиандростерона при умеренном увеличении ЛГ, незначительной гиперпролактинемии и явном увеличении количества 17-ОП и 17-КС. Клинические симптомы заболевания такие же, как и в случаях с надпочечниковой и яичниковой гиперандрогенией. На УЗИ эта форма проявляется в типичной поликистозности яичников и наличии мелких кист. Причиной смешанной формы чаще всего является пережитый сильный стресс и травма головы.
Симптомы гиперандрогении яичников

Повышенный уровень андрогенов чаще всего сопровождается такими признаками:
- Гирсутизм в виде обильного волосяного роста, характерного для мужчин. Волосяной покров появляется в зонах, таких как грудь, лицо, ягодицы, живот, а также в местах, которые находятся под влиянием мужских горомнов.
- Барифония, заключающаяся в снижении тембра голоса.
- Андрогенозависимая алопеция, проявляющаяся образованием залысин в области лба.
- Маскулинизация — изменение пропорций тела женщины. Это приводит к тому, что у пациентки бедра становятся слишком узкими, а плечи, наоборот, — широкими. Мускулатура развивается намного активнее, чем у здоровых женщин.
- Себорея в виде повышенной выработки секрета сальными железами кожи.
- Акне на лице и теле.
При повышенном содержании андрогенов в крови нередко происходят циклические сбои менструации. У некоторых пациенток месячные вовсе исчезают или идут через длительные периоды. Овуляция происходит очень редко, если вообще присутствует. Из-за того, что в крови слишком много половых гормонов мужского типа, яйцеклетка не способна выйти из созревшего фолликула. Это приводит к развитию бесплодия.
При данном заболевании баланс между мужскими и женскими гормонами нарушается, что становится основой для развития гиперэстрогенемии. Такая патология очень опасна повышением риска развития раковых клеток в шейке матки. Чрезмерный уровень андрогенов часто снижает чувствительность тканей к инсулину и приводит к нарушению обмена жира и углеводов в организме. Это нередко вызывает диабет, ожирение, склероз сосудов и сердечнососудистые болезни.
Методы диагностики

При обнаружении признаков, характерных для патологии, следует как можно быстрее посетить лечащего гинеколога. Опытный врач назначит тщательное обследование на основе жалоб женщины. Необходимо пройти обследование, чтобы исключить данную патологию и тем пациенткам, которые долго не могут зачать ребенка. В ходе диагностики назначаются гормональные исследования, чтобы определить, есть ли отклонения в количестве половых гормонов в крови. Кроме того, для определения гиперандрогении широко используется УЗИ и другие современные методы. Клинически сбои яичников и надпочечников в процессе выработки андрогенов проявляются нарушением гормонального фона. Если наблюдается слабовыраженная гиперандрогения яичникового генеза или другие формы заболевания, уровень мужских гормонов в крови может оставаться нормальным.
Нередко заболевание сопровождается изменением структуры яичников. В ходе лабораторного исследования определяется уровень основных гормонов, таких как пролактин, общий и свободный тестостерон, фолликулостимулирующий гормон, ДГЭА, андростендион.
Обратите внимание: У женщины гормональный фон имеет склонность меняться, поэтому, чтобы поставить точный диагноз, придется сделать пробу на количество гормонов трижды с 30-минутными промежутками. После этого три порции крови смешиваются, и определяется количество андрогенов.
Пациенток с подозрением на гиперандрогению обязательно отправляют на внутривлагалищное УЗИ, КТ или МРТ. Эти методы позволяют исключить или подтвердить наличие опухолевых образований, которые нередко появляются при данной гормональной патологии. После диагностики врачи подбирают оптимальный метод лечения. Если терапия выбрана правильно, а лечение произведено своевременно, пациентка имеет все шансы в будущем зачать и выносить ребенка. При обнаружении заболевания во время беременности обязательно назначаются специальные препараты, позволяющие снизить в крови содержание андрогенов.
Лечение при гиперандрогении

Важно! Прежде чем начать лечение от гиперандрогении, важно подтвердить диагноз лабораторным путем и инструментальными методами. Иногда использование только одного из способов не позволяет установить правильный диагноз.
Выбор лечения от яичниковой или надпочечниковой гиперандрогении зависит от разновидности и уровня развития болезни. Также на подбор оптимальной терапии влияет то, с какими симптомами и последствиями придется бороться. Если болезнь протекает с гормональным уровнем, который находится в пределах нормы, чаще всего назначаются оральные контрацептивы, в состав которых входят антиандрогены. Перед их приемом обязательно оценивается состояние пациентки и наличие у нее заболеваний, таких как патологии печени, сахарный диабет, тромбозы, эндометриоз. Использование контрацептивных гормональных препаратов запрещено при этих болезнях, а также во время вынашивания ребенка и грудного вскармливания.

Если женщина планирует беременность в ближайшее время, лечение от гиперандрогении требует совершенно другой схемы. В таких случаях часто назначается гормональная терапия, которая позволит добиться овуляции. В последнее время многие врачи применяют стимуляцию овуляции для устранения последствий повышенного содержания андрогенов. При правильно подобранных препаратах нередко удается полностью устранить болезнь и ее внешние признаки. Если на УЗИ обнаружена ановуляция, вызванная склеротическими процессами в капсуле яичника, требуется оперативное вмешательство, сочетающееся в гормональном лечении. На первых этапах важно наладить менструальный цикл женщины и по возможности добиться овуляции. Если беременность наступила — это не повод прекращать лечение. Дело в том, что повышенное содержание в крови андрогенов нередко приводит к самопроизвольным выкидышам, аномальному развитию плода или его замиранию на разных этапах беременности. Лечение беременных с гиперандрогенией заключается в приеме препаратов, которые помогают снизить содержание андрогенов, не нанеся при этом вред ребенку.
Обратите внимание: Лечение гиперандрогении яичникового и надпочечникового генеза должно производиться своевременно. В противном случае, женщина может столкнуться с другими серьезными патологиями и сбоями, включая образование злокачественных опухолей, рак матки, невосприимчивость инсулина, болезни сердца и сосудов.
К сожалению, на сегодняшний день многие женщины подвержены такой гормональной болезни. Ее профилактики, как таковой, нет. Однако снизить риск появления все же можно. Для этого рекомендуется следить за режимом питания и весом. Не стоит слишком быстро худеть, так как это способствует повышению количества мужских гормонов в крови. Стоит исключить прием стероидных препаратов. Как только обнаружены хотя бы некоторые признаки слишком высокого количества андрогенов, рекомендуется пройти лабораторное и инструментальное исследование.
Видео: Лечение и диагностика проблемы
Что такое Надпочечниковая гиперандрогения
Вирилизация надпочечникового генеза проявляется развитием адреногенитального синдрома (АГС) - в результате врожденной дисфункции коры надпочечников. Это генетически обусловленное заболевание, наследуемое по аутосомно-рецессивному типу. АГС объясняется неполноценностью ферментных систем в железе: у 80- 90% больных неполноценность проявляется дефицитом С21-гидроксилазы.
Патогенез (что происходит?) во время Надпочечниковой гиперандрогения
Основным патогенетическим механизмом АГС является врожденный дефицит фермента С21-гидроксилазы, участвующего в синтезе андрогенов в коре надпочечников. Образование С21-гидроксилазы обеспечивает ген, локализованный в коротком плече одной из 6-й пары хромосомы. Патология может не проявляться при наследовании одного патологического гена и манифестирует при наличии дефектных генов в обоих аутосомах 6-й пары. Частичная блокада синтеза стероидов при врожденном дефиците С21-гидроксилазы увеличивает синтез андрогенов.
До определенного возраста нерезко выраженный дефицит С21-гидроксилазы в надпочечниках компенсируется. При усилении функции надпочечников (эмоциональный стресс, начало половой жизни, беременность) нарушается синтез стероидов в сторону гиперандрогении, что в свою очередь тормозит выделение гонадотропинов и нарушает циклические изменения в яичниках.
При этом в яичниках возможны:
- подавление роста и созревания фолликулов на ранних стадиях фолликулогенеза, приводящее к аменорее;
- торможение роста, созревания фолликула и яйцеклетки, не способной овулировать, что проявляется ановуляцией и олигоменореей;
- овуляция с неполноценным желтым телом: несмотря на регулярные менструации, имеется недостаточность лютеиновой фазы цикла.
При всех этих вариантах гипофункции яичников возникает бесплодие. Частота невынашивания беременности при АГС достигает 26%.
Симптомы Надпочечниковой гиперандрогения
В зависимости от выраженности дефицита С21-гидроксилазы и соответственно гиперандрогении выделяют классическую форму АГС и легкие, или поздние (пубертатную и постпубертатную), формы АГС.
Классическая форма АГС сопровождается врожденной гиперплазией надпочечников. Такая вирилизация приводит к патологии наружных половых органов (ложный женский гермафродитизм) и неправильному определению пола при рождении. Детям с такой патологией проводят хирургическую коррекцию иола, дальнейшее лечение и наблюдение обеспечивает детский эндокринолог.
В пубертатном периоде основными жалобами больных являются гирсутизм, угревая сыпь, нерегулярные менструации. Менархе наступает в 15-16 лет, в дальнейшем менструации нерегулярные, есть тенденция к олигоменорее. В этом периоде более выражен гирсутизм: рост волос по белой линии живота, на верхней губе, внутренней поверхности бедер. Кожа жирная, пористая, с множественными акне, обширными пятнами гиперпигментации. В телосложении также заметно влияние андрогенов: нерезко выраженные мужские черты с широкими плечами и узким тазом, укорочение конечностей, невысокой рост. После появления гирсутизма молочные железы гипоплазированы.
У пациенток с иостпубертатной формой АГС нарушены менструальная и репродуктивная функции. Постпубертатная форма АГС манифестирует прерыванием беременности на раннем сроке. Выраженность нарушений репродуктивной функции зависит от степени дефицита С21-гидроксилазы: от снижения репродуктивной функции вследствие ановуляторных циклов до невынашивания беременности из-за формирования неполноценного желтого тела. Гирсутизм выражен незначительно: скудное оволосение белой линии живота, отдельные волоски над верхней губой. Телосложение женского типа, молочные железы достаточно развиты, метаболические нарушения нетипичны.
Диагностика Надпочечниковой гиперандрогения
При расспросе выявляют нарушения менструального цикла у сестер и родственниц пациентки по материнской и отцовской линии. При АГС рано и быстро развивается чрезмерное половое оволосение, поздно наступает менархе и в дальнейшем менструации нерегулярные.
Для АГС патогномоничны спортивное телосложение, гипертрихоз, угревая сыпь, умеренная гипоплазия молочных желез. АГС не сопровождается повышением массы тела в отличие от других эндокринных нарушений с гипертрихозом.
Основная роль в диагностике АГС принадлежит гормональным исследованиям. Для уточнения происхождения андрогенов проводят гормональные исследования до и после дексаметазоновой пробы. Снижение уровней 17-КС в моче, тестостерона и дегидроэпиандростерона в крови после приема препаратов, тормозящих выделение АКТГ, указывает на надпочечниковое происхождение андрогенов.
Диагностика постпубертатного АГС основана на:
- гипертрихозе и снижении репродуктивной функции у сестер пациентки по материнской и отцовской линии;
- позднем менархе (14-16 лет);
- гипертрихозе и нерегулярных менструациях с периода менархе;
- вирильных чертах морфотипа;
- повышении содержания 17-КС в моче, тестостерона и дегидроэпиандростерона в крови и снижение их уровня до нормы после приема дексаметазона.
Данные УЗИ яичников свидетельствуют об ановуляции: фолликулы различной зрелости не достигают преовуляторных размеров. Базальная температура с растянутой первой и укороченной второй фазой свидетельствует о недостаточности желтого тела, тип влагалищных мазков андрогенный.
Лечение Надпочечниковой гиперандрогения
Выбор лечебных препаратов у больных с АГС определяется целью терапии: нормализацией менструального цикла, стимуляцией овуляции, подавлением гипертрихоза.
С целью коррекции нарушений гормональной функции коры надпочечников используют глюкокортикостероидные препараты. Дозу дексаметазона определяют в соответствии с уровнем содержания 17-КС в моче, дегидроэпиандростерона и тестостерона в крови (на фоне лечения уровень этих гормонов не должен превышать верхнюю границу нормы). Эффективность лечения, кроме гормональных исследований, контролируют путем измерения базальной температуры и наблюдения за менструальным циклом. При неполноценной второй фазе менструального цикла необходима стимуляция овуляции с 5-го по 9-й день, на фоне которой часто наступает беременность. Во избежание самопроизвольного выкидыша терапию глюкокортикостероидами следует продолжить, ее длительность определяют индивидуально.
Если женщина не заинтересована в беременности, а основной жалобой являются гипертрихоз и гнойничковые высыпания на коже, рекомендуются препараты, содержащие эстрогены и антиандрогены. На гипертрихоз эффективно влияет диане, особенно в сочетании с андрокуром в первые 10-12 дней. Диане назначают с 5-го по 25-й день менструального цикла в течение 4-6 мес.
Антиандрогенный эффект дает верошпирон, в результате подавления образования дигидротестостерона из тестостерона в коже, волосяных фолликулах и сальных железах. Верошпирон назначают по 25 мг 2 раза в день. Применение верошпирона в течение 4-6 мес снижает на 80% уровень тестостерона, но снижения уровня кортикотропного и гонадотропных гормонов не отмечено.
Применение синтетических прогестинов также уменьшает гипертрихоз, но использование этих препаратов у женщин с АГС не должно быть длительным, так как подавление гонадотропинов нежелательно при угнетенной функции яичников.
К каким докторам следует обращаться если у Вас Надпочечниковая гиперандрогения
Гинеколог
Акции и специальные предложения
Медицинские новости
12, 13 и 14 октября, в России проходит масштабная социальная акция по бесплатной проверке свертываемости крови - «День МНО». Акция приурочена к Всемирному дню борьбы с тромбозами.
07.05.2019
Заболеваемость менингококковой инфекцией в РФ за 2018 г. (в сравнении с 2017 г.) выросла на 10 % (1). Один из распространенных способов профилактики инфекционных заболеваний - вакцинация. Современные конъюгированные вакцины направлены на предупреждение возникновения менингококковой инфекции и менингококкового менингита у детей (даже самого раннего возраста), подростков и взрослых.
25.04.2019
Грядут долгие выходные, и, многие россияне поедут отдыхать за город. Не лишним будет знать, как защитить себя от укусов клещей. Температурный режим в мае способствует активизации опасных насекомых...
Вирусы не только витают в воздухе, но и могут попадать на поручни, сидения и другие поверхности, при этом сохраняя свою активность. Поэтому в поездках или общественных местах желательно не только исключить общение с окружающими людьми, но и избегать...
Вернуть хорошее зрение и навсегда распрощаться с очками и контактными линзами - мечта многих людей. Сейчас её можно сделать реальностью быстро и безопасно. Новые возможности лазерной коррекции зрения открывает полностью бесконтактная методика Фемто-ЛАСИК.
Гиперандрогения у женщин – это повышенное содержание мужских половых гормонов (тестостерона). Он является предшественником . Превращение идет под влиянием фермента ароматазы. Вырабатывается тестостерон у слабого пола в надпочечниках, яичниках и жировой ткани. «Поломка» на любом из этих уровней может привести к разным видам гиперандрогении у женщин.
Основные типы гиперандрогении у женщин
На сегодняшний момент в зависимости от причин происхождения гиперандрогении выделяют ее две основные формы. Это истинная и другие. К истинной относятся яичниковая и надпочечниковая гиперандрогения. По происхождению они могут быть функциональными и опухолевыми.
Функциональные истинные гиперандрогении у женщин и причины их вызывающие:
- Яичниковая гиперандрогения. Связана с дефицитом фермента ароматазы, который обеспечивает превращение тестостерона в эстрогены. Как правило, это врожденный дефект. Часто встречается слабовыраженная гиперандрогения яичникового генеза – стертые формы (уровень тестостерона может быть в норме, могут отсутствовать УЗИ-признаки склерокистозных яичников).
- Надпочечниковая гиперандрогения. Связана с недостатком фермента, превращающего предшественников тестостерона. Симптомы гиперандрогении надпочечникового генеза: характеризуются значительными повышенными уровнями тестостерона и как проявление этого – гирсутизм;
К другим формам относятся:
- Транспортная. Ассоциируется с дефицитом глобулина, связывающего половые гормоны (ГСПГ). Этот глобулин связывает и препятствует его попаданию в клетку органа-мишени. Вырабатывается ГСПГ в печени, его уровни зависят от работы щитовидной железы и количества эстрогенов.
- Метаболическая гиперандрогения. Связана с нарушением углеводного и жирового обмена. В основе лежит инсулинорезистенстность;
- Гиперандрогения смешанного генеза. Сочетание различных форм и причин, вызывающих синдром гиперандрогении у женщин;
- Ятрогенная. Возникает в результате действия различных медикаментов.

Основные симптомы гиперандрогении
Органы-мишени для действия тестостерона: яичники, кожные покровы, сальные и потовые, а также молочные железы, волосы. Ведущими симптомами гиперандрогении у женщин являются следующие проявления:
- (созревание и выхода яйцеклетки), которое может провоцировать бесплодие и приводить к гиперэстрогении. Длительно существующая гиперэстрогения является риском в гормон зависимых органах (матка, яичники);
- Инсулинорезистентность (нечувствительность тканей к инсулину, вследствие чего клетка не усваивает глюкозу и остается «голодной»). Приводит к развитию сахарного диабета второго типа;
- Гирсутизм. Признаки гиперандрогении в данном случае: рост волос в андрогенных зонах (на бороде, груди, передней брюшной стенке, руках, ногах, спине);
- Кожные проявления (акне, себорея, андрогензависимая алопеция)
- Склерокистозные яичники: увеличены в объеме, с плотной белочной оболочкой, но множеством созревающих фолликулов, расположенных по периферии. Создается симптом «ожерелья».
Диагноз гиперандрогении ставится на основании не менее двух из вышеперечисленных симптомов.
Диагностика гиперандрогении у женщин
Лечение гиперандрогении у женщин зависит от правильной диагностики причины и вида этого синдрома. Диагностика складывается из следующих этапов:
- Жалоб на повышенный рост волос в атипичных для женщин местах, появление акне, бесплодие, нарушение менструального цикла, часто, ожирения;
- Анамнеза: проявления синдромов гиперандрогении совпадает с периодом полового созревания и репродуктивного возраста;
- Данных осмотра: ожирение, гирсутизм, вышеописанные кожные проявления;
- Данных гормонального обследования: повышенный уровень свободного тестостерона, адренокортикотропного гормона, дегидроэпистендинона, пролактина;
- Данных УЗИ: склерокистозные яичники, увеличение объёма яичников или их опухоли, опухоли надпочечников;
- Снижения уровня глобулина, связывающего половые гормоны;
- Повышения уровня инсулина и нарушения толерантности глюкозы.
Лечение гиперандрогении у женщин
Можно ли вылечить гиперандрогению? Истинная функциональная гиперандрогения не вылечивается поскольку связана с врожденными дефектами ферментов. Лечения проводят для устранения тех или иных симптомов гиперандрогении у женщин. После прекращения лечения симптомы гиперандрогении могут возобновляться.
Лечение гиперандрогении у женщин яичникового генеза заключается в применении антиандрогенных препаратов стероидного (Диана 35, Ципротерон, Левоноргестрел) и нестероидного (Флутамин)типов.
При лечении гиперандрогении надпочечникового генеза используется Дексаметазон.

Лечение гиперандрогении, связанного с метаболическими нарушениями состоит в , повышенной физической нагрузки и снижающих средств, например, Метформина.
Синдром гиперандрогении у женщин, связанный с повышением уровня пролактина требует назначения пролактин снижающих препаратов (Алактин, Бромкриптин).
Лечение гиперандрогении опухолевого генеза заключается в оперативном удалении этих образований на яичниках, надпочечниках, гипофизе.
Гиперандрогения у девочек в раннем возрасте, как правило, связана с надпочечниковым верильным синдромом опухолевого генеза, требующего оперативного лечения. Функциональная гиперандрогения у детей появляется в периоде полового созревания.
Гиперандрогения при беременности
Бесплодие не всегда является следствием гиперандрогении. Однако она вызывает нарушение продукции гормонов эстрогенов и . При синдроме гиперандрогении этот гормон снижен. с данным синдромом показана назначение препаратов естественного прогестерона, особенно в первом триместре, когда идет «становление» плаценты. Гиперандрогения при беременности является фактором риска по невынашиванию и недонашиванию, развитию метаболического синдрома у детей.
Гиперандрогения – это патологическое эндокринологическое состояние, которое проявляется повышением концентрации андрогенов в крови. К ним относят тестостерон, дигидротестостерон, андростендиол, андростендион и дегидроэпиандростендион. В организме женщины андрогены продуцируются в яичниках и надпочечниковых железах. Заболевание проявляется в первую очередь внешними изменениями тела и нарушением функции половых органов (эндокринологическим бесплодием).
Норма андрогенов у женщин зависит от возраста и физиологического состояния, поэтому концентрация тестостерона должна находиться в следующих пределах:
- 20-50 лет – 0,31-3,78;
- 50-55 лет – 0,42-4,51;
- при беременности – показатель повышен в 3-4 раза.
Индекс свободных андрогенов, норма у женщин
Свободные андрогены – это фракция гормонов, которые исполняют активную биологическую функцию в организме. К ним относят свободный и слабосвязанный тестостерон. Индекс свободных андрогенов (ИСА) – это соотношение общего количества тестостерона к его биологически активной фракции. Норма этого показателя зависит от фазы менструального цикла:
- фолликулярная фаза – 0,9-9,4%;
- овуляция – 1,4-17%;
- лютеиновая фаза – 1-11%;
- в период менопаузы – не более 7%.
Синдром гиперандрогении у женщин и мужчин
На форумах гиперандрогения часто описывается, как болезнь, которая появилась неизвестно откуда и ее причины неизвестны. Это не совсем так. Несмотря на отзывы, гиперандрогения является хорошо изученным заболеванием.
Повышенный показатель андрогенов не всегда является признаком развития заболевания. Физиологическая концентрация гормонов отличается в различные периоды развития и жизни женского организма. В период беременности, гиперандрогения является фактором, который необходим для нормального развития плода. Также в старшем периоде наблюдают высшие общие показатели этих биологических активных веществ, что обусловлено перестройкой организма в условиях менопаузы. В таких случаях нормой считается вариант, когда повышенное содержание гормонов не приносит дискомфорта пациентке.
Формы гиперандрогении
Различают различные формы диагноза гиперандрогении. Первичная гиперандрогения является врожденной и вызвана повышенной продукцией гормонов в организме с раннего детства. Вторичная – следствие нарушения основного механизма регуляции продукции – гипофизарного контроля, из-за заболеваний этого органа. Врожденная слабовыраженная гиперандрогения у девочек проявляется с раннего детства и часто сопровождает наследственные патологии или является следствием нарушения развития органов плода во время беременности. Приобретенная гиперандрогения возникает в старшем возрасте из-за сопутствующих патологий, нарушений эндокринной регуляции и воздействия внешних факторов среды.
Наиболее важной, если рассматривать патофизиологические аспекты, является классификация гиперандрогении за изменениями концентрации этих гормонов. Если у пациентки наблюдается выраженное повышение количества тестостерона, то речь идет об абсолютной гиперандрогении. Но существует другой клинический вариант, при котором общая концентрация гормонов не особо повышается, или даже остается в пределах нормы, но наблюдаются все симптомы, что характерны для патологии. В этом случае клиника вызвана увеличением биологически активной доли тестостерона. Этот вариант называется относительной гиперандрогенией.
Широта клинических симптомов, которые возникают при гиперандрогении, вызвана тем, что тестостерон играет очень важную роль в регуляции половой дифференциации человеческого организма. Его биологические функции следующие:
- развитие первичных и вторичных мужских половых признаков;
- выраженное анаболическое действие, что приводит к активации синтеза белков и развитию мышечной массы;
- повышение активности процессов метаболизма глюкозы.
При этом часто выделяют эффекты андрогенов до и после рождения. Поэтому, если у пациентки это состояние возникло еще в перинатальный период, то собственные половые органы у нее остаются слабо развитыми. Это состояние называют гермафродитизмом, и обычно оно требует хирургической коррекции в первые годы жизни.
Биохимические основы гиперандрогении
Важную роль в утилизации лишней части андрогенов играет печень. В гепатоцитах происходит процесс конъюгации большей части гормонов с белками с помощью специфических ферментов. Измененные формы андрогенов выводятся из организма через желчь и мочу. Меньшая часть тестостерона расщепляется через систему цитохрома Р450. Нарушение этих механизмов также может приводить к увеличению концентрации андрогенов в крови.
Рецепторы к тестостерону и другим андрогенам есть в наличии в большинстве тканей организма. Поскольку эти гормоны являются стероидами, то они способны проходить через клеточную мембрану и взаимодействовать со специфическими рецепторами. Последние запускают каскад реакций, которые проводят к активации синтеза белков и изменения метаболизма.
Изменения в яичниках при гиперандрогении
Одним из основных патофизиологических механизмов нарушений при гиперандрогении являются необратимые изменения в женских половых органах. Если синдром есть врожденным и гормональный дисбаланс проявляется еще до рождения ребенка, то происходит атрофия и гипоплазия яичников. Это автоматически приводит к снижению продукции женских половых гормонов и нарушению половой функции в будущем.
Если синдром гиперандрогении приобретен в более взрослом возрасте, то в яичниках происходят следующие варианты патофизиологических изменений:
- тормозится развитие и пролиферация фолликулов на ранних стадиях (они остаются на начальном уровне дифференциации);
- фолликулы практически полностью развиваются, но нарушается формирование яйцеклеток, из-за чего не происходит овуляция;
- фолликулы и яйцеклетки у женщины нормально развиваются, но остается неполноценным желтое тело, что приводит к недостаточности гормонального фона в лютеиновую фазу менструального цикла.
Клиника при этих вариантах несколько отличается друг от друга, но самое важное у них одно – недостаточная функция яичников приводит не только к нарушению нормального менструального цикла, но и к бесплодию.
Код по МКБ гиперандрогения (фото отсутствует)
У МКБ 10 гиперандрогения у женщин с отзывами и комментариями представлена в классе Е. Здесь собраны эндокринологические заболевания. При этом, зависимо от причины и формы, в МКБ 10 гиперандрогения у женщин с отзывами имеет различные коды:
Эта классификация позволяет достаточно четко разделить основные формы заболевания, а в дальнейшем выбрать наиболее эффективный метод терапии.
Гиперандрогении у женщин: причины
Причины гиперандрогении у женщин исключительно гормональные. Происходит нарушение их продукции или механизмов регуляции функции эндокринных желез. Поэтому все причины возникновения гиперандрогении у женщин можно поделить на три группы:
Врожденные дефекты ферментов, которые берут участие в метаболизме стеролов, что приводит к частичной блокаде синтеза стероидов и повышенной продукции тестостерона. Заболевания и состояния, которые сопровождаются гиперплазией коры надпочечниковых желез. Обычно они проявляются повышенным выделением адренокортикотропного гормона (АКТГ), который стимулирует продукцию андрогенов. Локальные нарушения функции яичников. При этом наблюдается изолированное повышения концентрации только андрогенов, или изменяется индекс ИСА, что свидетельствует о возрастании их вольной фракции. Соматические заболевания печени, которые приводят к нарушению механизмов выведения андрогенов с организма (гепатит, цирроз, целлюлярный рак, стеатогепатоз).
Надпочечниковая гиперандрогения. Симптомы андрогении
Симптомы и лечение андрогении у женщин тесно связаны. Повышение концентрации андрогенов в организме женщины влияет на многие системы и органы. Выраженность клинической симптоматики зависит от концентрации свободной фракции тестостерона в крови. Именно она проявляет биологическую активность, что и приводит к многочисленным признакам гиперандрогении.
Изменения со стороны кожи при гиперандрогении
Наиболее ранним признаком повышения концентрации тестостерона являются изменения со стороны кожи. В первую очередь у пациенток наблюдается при гиперандрогении акне – воспалительный процесс, который развивается в сумке волосяного фолликула и сальной железы. Наиболее часто эти угри появляются на коже лица, шеи, затылочной части головы, спины, плеч и грудей. Этиология этого процесса бактериальная (стафилококковая). При этом наблюдаются различные полиморфные элементы сыпи, наиболее характерным из которых является пустула с гноем. Через некоторое время она лопает, превращаясь в корочку. Иногда на их месте остаются синеватого оттенка рубцы.
Нарушается также нейроэндокринная регуляция сальных желез, что приводит к развитию себореи.
Изменяется также характер волосяного покрова кожи. Довольно часто наблюдают алопецию – выпадение волос по мужскому типу, что сопровождается значительным косметологическим дефектом. На туловище наблюдается обратный процесс – грудь, живот и спина покрываются новыми волосяными фолликулами.
Симптомы надпочечниковой гиперандрогении
Основные симптомы при гиперадрогении называются маскулинизацией. К ним обычно относят:
- снижение тональности голоса;
- развитие мужского типа отложения жира (преимущественно в абдоминальной области);
- появление волосистого покрова на лице, губах, подбородке;
- увеличение размеров мышц;
- уменьшение размера молочных желез.
Но главное – страдает функция яичников. Практически у всех пациентов наблюдаются различной тяжести нарушения менструальной функции. Циклы стают нерегулярными, задержки чередуются с олигоменореей, снижается либидо.
Возникают и другие симптомы гиперандрогении у женщин, причины которых связанные с нарушением функции яичников. Гиперандрогения является одной с основных причин гормонального бесплодия у женщин. К этому приводят кистозная деформация, неполная дифференциация фолликулов яичников, неполноценность желтого тела и структурные изменения яйцеклеток. Одновременно увеличивается частота развития патологий женских половых органов (в первую очередь эндометриоза и кист яичников). Со временем, без эффективного лечения, у пациентки настает период ановуляции.
Также часто наблюдаются симптомы гиперандрогении женщин, лечение которых должно быть немедленное в стационарных условиях. К ним относят кровоизлияния из половых органов, что иногда приводит к развитию анемии различной степени тяжести.
Признаки гиперандрогении у женщин и нарушение метаболизма
Андрогены имеют значительное влияние на течение метаболических процессов в организме. Поэтому при их избытке наблюдаются следующие признаки избытка андрогенов у женщин при гиперандрогении:
- Снижение толерантности к глюкозе. Андрогены снижают чувствительность клеток организма к инсулину, а также активируют процессы глюконеогенеза. Это приводит к возрастанию риска развития сахарного диабета.
- Усиленный атерогенез. Ряд исследований убедительно показали, что при гиперандрогении увеличивается риск развития сердечно-сосудистых событий (инфарктов, инсультов). Это вызвано тем, что повышенная концентрация тестостерона способствует увеличению количества холестерина в крови. При этом снижается защитная роль женских половых гормонов.
- артериального давления из-за нарушения баланса основных систем регуляции – ренин-ангиотензинной и адреналовой.
- Частое развитие астенических и депрессивных состояний. Это обусловлено серьезными гормональным дисбалансом и психологической реакцией женщины на внешние изменения тела.
Симптомы гиперандрогении у подростков
Гиперандрогения у детей и подростков имеет несколько отличий. Во-первых, если у ребенка был врожденный адреногенитальный синдром, то у него возможен псевдогермафродитизм. Также у таких девушек отмечено увеличение размеров половых органов – особенно клитора и половых губ.
Наиболее часто симптомы гиперандрогении у ребенка дебютирует с жирной себореи. Она начинается с того, что жировые железы кожи (преимущественно головы и шеи) начинают усиленно продуцировать свой секрет. Поэтому покровы у ребенка стают блестящими из-за чрезмерного их выделения. Также часто настает закупорка протоков желез, что способствует присоединению бактериальной инфекции и развитию локального воспаления.
Высокая концентрация андрогенов также влияет на конституцию тела девушек. Для них характерен быстрой рост тела, набор мышечной массы, значительное увеличение окружности плеч. При этом бедра остаются относительно небольшими.
Симптомы гиперандрогении у мужчин
Повышение концентрации андрогенов также имеет отрицательное влияние и на организм мужчин. Преимущественно он возникает при синдроме Иценко-Кушинга, новообразованиях яичек, раке предстательной железы, употреблении анаболических препаратов для роста мышечной массы и адреногенитальном синдроме. При этом наблюдаются следующие симптомы гиперандрогении у мужчин:
- раннее половое созревание;
- быстрый рост в подростковом возрасте;
- деформация опорно-двигательного аппарата;
- раннее появление вторичных половых признаков;
- гиперсексуальность;
- непропорциональные размеры половых органов;
- раннее облысение;
- эмоциональная лабильность, склонность к агрессивности;
- акне.
Физиологическая гиперандрогения у мужчин является физиологической в подростковом возрасте, но к 20-летнему возрасту уровень тестостерона снижается, что свидетельствует о завершении полового созревания.
Диагностика гиперандрогении
Очень важно при наличии подозрении на гиперандрогению своевременно обратится к врачу. Самостоятельно бегать на анализы не очень эффективно, поскольку далеко не все знают, при гиперандрогении у женщины какие гормоны сдавать.
Диагностика гиперандрогении у женщин начинается со сбора анамнеза. Врачу необходимо выяснить хронологию появления симптомов и динамику их развития. Также обязательно расспрашивают о наличии данной патологии у ближайших родственников пациентки и обо всех перенесенных заболеваниях. После этого обязательно проводят тщательный осмотр. Обращают внимание на наличие вторичных половых признаков, степень их выраженности, состояние волосистого покрова, чистоту кожи, тип конституции, уровень развития мышечной массы, возможные изменения со стороны других органов.
Особое внимание обращают на полноценность функционирование половой системы. Сбирают сведения о регулярности менструаций, наличии каких либо отклонений в их течении, при необходимости гинеколог делает осмотр. Кроме того врачу необходимо знать, какие медикаменты принимала пациентка в течение последнего года. При подозрении на генетическую патологию обязательно назначают консультацию генетика.
Лабораторная диагностика гиперандрогении у женщин
Следующий шаг диагностики гиперандрогении – проведение комплекса лабораторных исследований, которые дают сведение о функциональном состоянии организма в целом и эндокринной системы. Пациенткам назначают рутинные исследования – общий анализ крови, мочи, основные биохимические показатели (креатинин, мочевина, сахар крови, печеночные ферменты, билирубин, липидограмма, общий белок и его фракции, индикаторы системы свертывания крови). Особое внимание уделяется концентрации глюкозы, поэтому при ее повышении проводят также исследование глюкозилированного гемоглобина и гликемического профиля.
Следующий шаг – анализ на гормоны гиперандрогении:
- Общий тестостерон в крови и индекс свободных андрогенов (ИСА).
- Основные гормоны надпочечных желез – кортизол, альдостерон.
- Женские половые гормоны – эстрогендиол, 17-ОН-прогестерон, лютеинизирующий и адренокортикотропный гормон (АКТГ).
- При необходимости также проводят малую и большую дексаметазоновую пробы, которые позволяют отличить патологии надпочечников и гипофиза.
Исследование концентраций гормонов позволяет установить, на каком уровне возникло нарушение эндокринной регуляции. При подозрении на гиперандрогению сдать анализы можно в специализированных эндокринологических центрах или приватных лабораториях.
При необходимости также проводятся генетические исследование: забор биологического материала с дальнейшим поиском дефектных генов.
Инструментальная диагностика гиперандрогении
Результаты лабораторной диагностики позволяют установить диагноз синдрома гиперандрогении, но не дают дополнительной информации о возможной причине. Поэтому пациенткам необходимо также пройти ряд инструментальных исследований, чтобы подтвердить или выключить патологии, которые спровоцировали симптоматику заболевания.
Обследование гиперандрогении включает ультразвуковую диагностику органов брюшной полости, почек, надпочечных желез, матки и яичников. Этот простой и доступный метод дает ключевую информацию о состоянии этих органов.
Для выключения добро- и злокачественных новообразований проводят компьютерную томографию (КТ) гипофиза, гипоталамуса и надпочечных желез. При выявлении подозрительной гиперплазии тканей, необходимо провести также биопсию органа с последующим цитологическим анализом, во время которого изучаются морфологические особенности тканей. За этими результатами принимается решение о хирургической или консервативной методике лечения.
За показаниями дополнительно проводят мониторинг основных функциональных систем организма. С этой целью снимают ЭКГ, назначают рентгенографию органов грудной клетки, направляют пациентку на ультразвуковое исследование сердца и крупных артерий, реовазографию.
Лечение
Причины, симптомы, лечение гиперандрогении у женщин тесно связаны. Современная терапия гиперандрогении объединяет гормональные препараты, которые позволяют нормализировать эндокринологический фон в организме, оперативные вмешательства, направленные на коррекцию внешних признаков маскулинизации, а также изменение способа жизни, что помогает улучшить самооценку, снизить риск осложнений и развития других патологий. Отдельный аспект – психологическая поддержка пациентов, которая позволяет им лучше адаптироваться к болезни и продолжать полноценную жизнь.
Общие мероприятия терапии
Лечение гиперандрогении у женщин начинается с коррекции способа жизни. В условиях изменения метаболизма, пациенты склонны к набору лишней массы. Поэтому всем больным с гиперандрогенией советуют регулярно делать умеренные физические упражнения либо заниматься любимым видом спорта. Также очень полезно отказаться от своих вредных привычек – злоупотребления алкоголя и курения, что значительно снижает риск развития патологий сердечнососудистой системы.
В условиях изменения метаболизма, пациенты склонны к набору лишней массы. Поэтому всем больным с гиперандрогенией советуют регулярно делать умеренные физические упражнения либо заниматься любимым видом спорта. Также очень полезно отказаться от своих вредных привычек – злоупотребления алкоголя и курения, что значительно снижает риск развития патологий сердечнососудистой системы.
Поскольку при гиперандрогении происходит увеличение концентрации глюкозы в крови из-за нарушения инсулинотолерантности тканей, очень важен аспект здорового питания. Поэтому часто врачи консультируются с диетологами, чтобы подобрать оптимальный рацион продуктов для пациента.
Медикаментозная терапия при гиперандрогении
То как лечить гиперандрогению медикаментозно? Цель медикаментозной терапии – коррекция гормонального дисбаланса организма. Поэтому препараты, которые используются для лечения, выбираются исходя из данных лабораторного исследования. Особенность терапии, что в большинстве случаев она долговременная и может продолжаться всю жизнь пациентки. Врачу следует убедительно пояснить, что отказ от приема лекарств после первого улучшения состояния, гарантированно приведет к рецидивированию синдрома гиперандрогении.
Прогестероны и эстрогены при гиперандрогении
Клинические рекомендации гиперандрогении советуют назначать заместительную терапию. Наиболее часто используются гормональные препараты (ЭКО по длинному протоколу), которые содержат эстроген и прогестерон. Их производят в форме кремов, пластырей, таблеток и капсул. Трансдермальное применение имеет одно существенное преимущество – молекулы препарата не проходят метаболизм в печени, что снижает токсическое их влияние. Однако, у пероральных форм показатель биодоступности гораздо выше, что позволяет быстро поднять уровень гормона в крови к необходимому показателю.
Среди препаратов эстрогена наиболее часто назначаются «Прогинова», «Эстрожель», «Меностар», «Эстрамон». С прогестероновых медикаментозных средств – «Утрожестан», «Гинпрогест», «Прогинорм», «Пролютекс». Однако, эти препараты нельзя использовать при тяжелых нарушениях функции печени, гормоночувствительных опухолях, порфирии, высоком риске кровоизлияний и недавних геморрагических инсультах.
Антиандрогены
Антиандрогены являются синтетическими нестероидными антагонистами тестостерона. Большинство препаратов способны связывать рецепторы гормонов, и этим предупреждать возникновение биологических их эффектов. Наиболее часто используют для профилактики развития дальнейшего развития гормоночувствительных опухолей, но также для долговременной терапии при гиперандрогении.
Основным препаратом этой медикаментозной группы является «Флутамид». Однако, его запрещено назначать при хронических патологиях печени с серьезными нарушениями ее функции. Также нельзя использовать препарат в детском возрасте из-за возможных побочных эффектов.
Глюкокортикоиды
Активное использование также нашли «Метипред» при гиперандрогении и «Преднизолон» - стероидные глюкортикоиды. Их назначают при наличии симптоматики недостаточности функции надпочечных желез, которая иногда наблюдается при этой патологии. Однако, при этом следует учитывать, что эти медикаменты могут привести к численным побочным эффектам (гиперкортицизму). «Дексаметазон» при гиперандрогении часто является препаратом начальной терапии, особенно при надпочечниковой форме болезни.
Антагонисты минералокортикоидов
При адреногенитальном синдроме, а также при некоторых других формах врожденной гиперандрогении происходит повышение секреции альдостерона, что сопровождается повышением артериального давления и электролитным дисбалансов в организме. В таких случаях назначают синтетические антагонисты этих рецепторов – «Эплеренон», «Спиронолактон», «Верошпирон» при гиперандрогении, отзывы об эффективности которых положительные.
Симптоматическая терапия сопутствующих патологий
Особое значение имеет сахаропонижающая терапия, поскольку у многих пациенток наблюдается повышение концентрации глюкозы в крови. Если диеты и изменения способа жизни для них недостаточно, то назначаются следующие группы медикаментов:
- бигуаниды («Метформин», «Диаформин»);
- препараты сульфанилмочевины («Диабетон», «Амарил»);
- тиазолидиндионы («Пиоглитазон», «Росиглитазон»);
- ингибиторы альфа-клюкозидазы («Акарбоза»).
При развитии артериальной гипертензии используются преимущественно ингибиторы АПФ («Периндоприл», «Рамиприл», «Эналаприл») и блокаторы ренин-ангиотензина («Вальсартан»). При наличии печеночной патологии назначаются гепатопротекторы, чтобы снизить нагрузку на этот орган. Отзывы о лечении гиперандрогении при правильно подобранной симптоматической терапии – исключительно положительные.
Важность психологической помощи
Клинические рекомендации лечения надпочечниковой гиперандрогении развитых стран обязательно имеют в себе пункт о своевременном оказании психологической помощи больным. Поэтому ведущие клиники назначают индивидуальные или групповые сеансы психотерапии для пациентов. Это обусловлено тем, что внешние изменения тела, гормональный дисбаланс и бесплодие увеличивают риск развития депрессии. Нежелание пациентки бороться со своей болезнью также отрицательно влияет на успешность других методов лечения. Поэтому необходимо оказать всевозможную поддержку и сочувствие не только со стороны медицинского персонала, но и со стороны близких и родственников. Это, если верить отзывам лечения гиперандрогении у женщин – наиболее важный компонент успешной терапии.
Лечение гиперандрогении народными средствами
Лечение народными способами гиперандрогении у женщин, реально ли?
Гиперадрогения сопровождается серьезным нарушением гормонального баланса в организме. К сожалению, лечение народными способами гиперандрогении не способно эффективно снизить уровень тестостерона в крови. Их можно использовать только с целью профилактики и снижения нежелательных эффектов андрогенов. Никакое лечение травами гиперандрогении не заменит гормональной терапии.
К сожалению, многие пациентки тратят большое количество времени на народное лечение гиперандрогении, и обращаются к врачу в момент, когда произошли серьезные изменения в их организме.
Роль диеты в лечении гиперандрогении у женщин
Наиболее важную роль играет при гиперандрогении диета. Она назначается всем пациенткам, чтобы уменьшить риск развития нарушений метаболизма. Диета при гиперандрогении у женщин является малокалорийной со сниженным содержанием углеводов. Это способствует снижению прироста глюкозы. При этом отдается предпочтение продуктам, которые содержат много клетчатки (преимущественно фрукты и овощи).
При составлении диеты учитывают не только степень выраженности гипергликемии и других метаболических нарушений, но также и актуальный вес пациентки. Врач-диетолог высчитывает базовую потребность организма в энергии и отдельных нутриентов. Также важно равномерно распределить необходимое количество еды в течение дня, чтобы избежать резкой нагрузки. С этой целью весь рацион питания при гиперандрогении делится на 5-6 приемов пищи. Также необходимо учитывать физическую активность пациентки. Если она занимается спортом или имеет великую нагрузку в течение дня, то это должно быть компенсировано достаточным количеством энергетических запасов, которые поступают с пищевыми продуктами.
Важную роль имеет самоконтроль пациентки. Она должна приучиться, самостоятельно следить за собственным рационом питания и знать, какие именно продукты и блюда ей можно, а какие нельзя. Это способствует максимально большому положительному эффекту от придерживаемой диеты.
Запрещенные и разрешенные продукты для диеты у женщин
Из рациона выключают в первую очередь продукты, которые изготовлены на основе муки. Серьезно ограничивают употребление белого хлеба (особенно свежей выпечки), сдобы, булочек, печенья (кроме диабетического), торты и сладости. Необходимо также уменьшить количества консервов (мясных или рыбных), копченых продуктов, жирные виды мяса. С овощей выключают картофель и любые блюда, с его высоким содержанием.
Также пациенткам запрещают продукты с высоким содержанием жиров. Их опасность для организма в том, что они активно окисляются в кетоновые тела, которые составляют серьезную опасность для центральной нервной системы. В норме, организм должен справляться с регуляцией этого процесса и утилизацией жиров, однако, в условиях нарушения метаболических процессов это стает для него слишком сложным заданием.
Из каш пациенткам советуют отдавать преимущество гречке. При этом, ее можно использовать как ингредиент других блюд, как и готовить в молоке или воде. Гречка – уникальный продукт, который минимально влияет на метаболизм углеводов. Поэтому она включается во все диеты, составленные профессиональными диетологами. Из круп также можно употреблять кукурузную, перловую и овсяную каши. Однако их количество должно быть тщательным образом контролировано.
Молочные продукты разрешено употреблять также далеко не все. Необходимо удержаться от домашнего молока, сметаны, сливочного масла, майонеза, йогуртов и кефиров с высоким содержанием жиров.
Роль фруктов в диете при гиперандрогении
Фрукты, как продукты с высоким содержанием клетчатки, играют ключевую роль в рационе питания пациенток с гиперандрогенией. Они не только являются источником многих витаминов, но также и Калия, который чрезвычайно важен для корректной работы сердечнососудистой системы. Также они нормализируют функцию пищеварительной системы, улучшая процессы моторики и всасывания полезных веществ.
Практически все известные фрукты не содержат глюкозы или крахмала в чистом виде, они накопляют углеводы в форме фруктозы и сахарозы. Это позволяет этим продуктам практически не иметь отрицательного влияния на организм.
Однако, далеко не все продукты являются одинаково полезными. Поэтому пациенткам с гиперандрогенией необходимо исключить из своего рациона бананы, виноград, финики, инжир и землянику. Остальные фрукты можно употреблять без ограничений.
Гиперандрогения яичников генеза
Гиперандрогения генеза яичников – наиболее частая форма повышения концентрации андрогенов в крови у женщин. Она возникает как следствие врожденных или приобретенных патологий яичников – ключевого органа эндокринной секреции.
Синдром поликистозных яичников (СПКЯ)
Основным заболеванием, которое приводит к гиперандрогении, является поликистоз яичников. За данными статистики, он наблюдается до 20 % женщин репродуктивного возраста. Однако, далеко не всегда яичниковая гиперандрогения СПКЯ проявляется клинически. Патогенез это патологии связан со снижением чувствительности периферических тканей к инсулину, что приводит к его гиперсекреции в поджелудочной железе и гиперстимуляции специфических рецепторов в яичниках. Как результат – повышается секреция андрогенов и эстрогенов, хотя существует и вариант изолированного повышения концентрации тестостерона (при наличии недостаточности некоторых ферментов в тканях железы).
Гиперандрогения яичникового генеза СПКЯ помимо нарушений менструации и симптомов маскулинизации, также сопровождается ожирением по центральному типу, появлением пятен пигментации на коже, хроническими болями внизу живота и развитием сопутствующих патологий женской половой системы. При этом также наблюдаются изменения со стороны системы свертывания крови, что повышает риск образования тромбов в периферических сосудах, особенно на фоне хронического воспаления.
Метод терапии – преимущественно консервативный, особенно у пациенток молодого возраста.
Новообразования яичников
Вторая причина, которая часто стает причиной слабовыраженной гиперандрогении яичникового генеза – развитие гормоноактивных новообразований яичников. При этом наблюдается огромная неконтролируемая продукция андрогенов. Клинические симптомы проявляются внезапно, и активно прогрессируют в течение краткого промежутка времени.
Такой гормоноактивный вариант опухолей встречается довольно редко. Наилучшим способом его визуализации является ультразвуковое исследование и компьютерная томография. Обнаружение данного новообразования также требует биопсии с цитологическим анализом, а также тщательного скрининга всего организма. По этим результатам и принимается решение о дальнейшей тактике ведения пациентки. Обычно лечение этой патологии ведется в условиях специализированного стационара больницы.

Гиперандрогения надпочечников
Надпочечниковая гиперандрогения у женщин наиболее часто является приобретенным заболеванием. Оно возникает из-за гиперплазии или развития доброкачественной опухоли коры железы. Эти два состояния приводят к усиленной продукции гормонов не только андрогенов, но и других форм стероидных гормонов.
Клиническая картина при этом имеет тенденцию к постепенному нарастанию. Наиболее часто ее выявляют у пациенток старше 40 лет. Иногда клиника дополняется болевыми ощущениями в области нижней части спины. Также она сопровождается колебаниями артериального давления.
Лечение опухолей надпочечных желез проводят в специализированных стационарах. Обязательно пациентку направляют на биопсию новообразования с цитологическим его анализом, чтобы исключить злокачественный процесс. Преимущественно опухоль удаляют разом с надпочечником, а далее назначают пожизненную гормональную терапию.
Врожденная форма гиперандрогении надпочечников
Врожденная форма гиперандрогении надпочечного генеза проявляется обычно уже в раннем детстве. Причина возникновения патологии – дефицит фермента С21-гидроксилазы, которая играет ключевую роль в процессах химических преобразований стероидных гормонов. Дефицит этого соединения приводит к усиленной продукции андрогенов.
Эта форма гиперандрогении надпочечников является наследственной. Дефектный ген локализируется в 6 паре хромосом человека. При этом заболевание является рецессивным, поэтому для его клинической манифестации необходимо, чтобы оба родители ребенка были носителями этой аномалии.
Также различают несколько форм синдрома гиперандрогении надпочечникового генеза. При классическом варианте наблюдают выраженные признаки адреногенитального синдрома с гирсутизмом, маскулинизацией, псевдогермафродитизма и метаболическими нарушениями. Дебют этой формы обычно припадает на начало подросткового периода, когда он преимущественно и диагностируется.
Постпубертатная форма адреногенитального синдрома выявляется случайно. Обычно уровень андрогенов у пациенток при ней недостаточно высок для развития маскулинизации. Однако, у них часто наблюдают прерывания беременности на ранних строках, что обычно и служит поводом для обращения к врачу.
Смешанная гиперандрогения
Гиперандрогения смешанного генеза обусловлена нарушением продукции тестостерона и в яичниках, и в надпочечных железах. Она возникает из-за врожденного дефицита фермента 3-бета-гидроксистероиддегидрогеназы, который берет участие в метаболизме стероидных гормонов. Поэтому возникает повышенное накопление дегидроэпиандростерона – слабого предшественника тестостерона.
Усиленная продукция этого гормона приводит к развитию типичной картины гирсутизма и маскулинизации. Первые симптомы обычно возникают в подростковый период жизни.
Одновременно с этим смешанная гиперандрогения сопровождается повышенной продукцией предшественников и других стероидных гормонов – глюко- и минералокортикоидов. Поэтому возникают существенные метаболические изменения по типу синдрома Иценко-Кушинга, симптоматической артериальной гипертензии и электролитного дисбаланса.
Терапия смешанной гиперандрогении исключительно консервативная. Пациенткам назначают дексаметазон, пероральные контрацептивы и антагонисты альдостерона, чтобы нормализировать гормональный фон. При этом лечение может быть пожизненным.
Гиперандрогения и беременность
Гиперандрогения и беременность – часто не совместимые состояния. Как известно, во время этого заболевания (независимо от начальной причины) возникает серьезные нарушения со стороны эндокринной и половых систем женщины. Ключевой симптом – нерегулярность или отсутствие менструаций, также наблюдается неполноценность дозревания и развития половых клеток в яичниках. Эти два фактора провоцируют гормональное бесплодие у пациентки. Ситуацию усугубляет тот факт, что часто нет симптоматики гирсутизма и маскулинизации, поэтому женщины даже не подозревают наличие у себя этой патологии.
Можно ли забеременеть при гиперандрогении? Это возможно, если нарушение гормонального фона произошли недавно или была своевременно проведена необходимая заместительная терапия. Поэтому возникает следующий вопрос – как правильно вести такую пациентку, и какие осложнения возможны в период беременности для нее и плода.
Проблемы беременности при гиперандрогении
За данными многочисленных исследований существуют опасные недели беременности при гиперандрогении. Наибольшее число спонтанных абортов зафиксировано в первый триместр, когда таким образом завершались около 60% всех наблюдаемых беременностей. Причина такой ситуации заключается в том, что дисбаланс гормонов влияет на развитие эндометрия матки и неполноценное формирование плаценты, из-за чего плод одерживает недостаточное количество нутриентов и крови для собственного роста.
Второй критический период наступает на 12-14 неделях. Именно тогда происходит завершение формирования ключевых систем организма ребенка. И если у него есть серьезные нарушения, который делают его в будущем не жизнеспособным, организм матери сам провоцирует выкидыш.
Истмико-цервикальная недостаточность
У женщин при беременности гиперандрогения во втором-третьем триместре провоцирует развитие истмико-цервикальной недостаточности. При этом состоянии наблюдается снижение тонуса гладких мышц шейки матки, что приводит к ее увеличению в просвете и появлению постоянного проходимого канала с влагалищем.
Опасность истмико-цервикальной недостаточности в том, что увеличивается риск преждевременных родов, поскольку мышечная масса матки стает неспособной удерживать плод. При наличии у пациентки хронической инфекции внешних половых органов или выделительной системы, также возникает возможность развития бактериального, грибкового или вирусного процесса в матке или плаценте.
Первые признаки этого состояния обычно появляются после 16 недели гестации, когда начинают функционировать надпочечники плода, что приводит к повышению уровня стероидных гормонов (и андрогенов). Очень важно пациенткам в этом периоде наблюдаться у своего гинеколога, поскольку симптоматика у истмико-цервикальной недостаточности в большинстве случаев отсутствует. И единственным способом выявить эту патологию является гинекологический осмотр.
Ведение беременности при гиперандрогении
О гиперандрогении беременности форумы часто дают не правдивую информацию, особенно если речь идет о народных рецептах или травах. Поэтому ориентироваться нужно только на квалифицированного врача-гинеколога.
Поскольку гиперандрогения и беременность идут часто вместе, то начинать лечение стоит еще наперед. Все пациентки с подозрением на это состояние должны быть тщательным образом обследованы (особенно внимание обращают на концентрацию гормонов в крови).
Медикаментозная терапия должна длиться весь период беременности. Она включает в себя тщательно подобранные дозы дексометазона, которые за механизмом обратной связи должны ингибировать синтез андрогенов в надпочечниках. При необходимости также назначают прогестероны или эстрогены для полноценной коррекции гормонального баланса. Антагонисты андрогенов в период беременности категорически запрещены, поскольку имеют токсическое воздействие на плод.

Также гиперандрогения во время беременности требует постоянного контроля со стороны врачей. Поэтому во втором-третьем триместре многим пациенткам советуют лечь в специализированное отделение.
Истмико-цервикальная недостаточность требует хирургического вмешательства. Беременным проводят малотравматическую операцию с наложением шва на шейку матки. Эта манипуляция позволяет полностью ликвидировать угрозу выкидыша или инфицирования полости матки.
Гиперандрогения у подростков
Гиперандрогения у подростков часто дебютирует неожиданно. Этот период жизни организма сопровождается серьезными гормональными перестроениями, изменениями функционирования многих эндокринных желез. И если у ребенка есть врожденный дефицит некоторых ферментов надпочечников или яичников, то происходит нарушение метаболизма стероидов и повышенная продукция андрогенов.
Гиперандрогения у девочек подростков часто начинается с симптоматики перестроения организма. У них появляются широкие плечи, при этом окружность бедер практически не увеличивается. Одновременно нарастает мышечная масса. Волосяной покров начинает расти за мужским типом. У пациенток наблюдаются проблемы с кожей – практически у всех обнаруживается жировая себорея и акне. Присоединяются и нарушения половой системы (задержка первой менструации и ее дальнейшая нерегулярность).
Особенно важно выявлять такие изменения как можно быстрее, когда есть возможность с помощью гормональной терапии нивелировать все симптомы гиперандрогении. Кроме того, такие пациентки часто страдают депрессией из-за своего внешнего вида, поэтому им особо важна психологическая поддержка.
Для цитирования:
Пищулин А.А., Карпова Е.А. Овариальная гиперандрогения и метаболический синдром // РМЖ. 2001. №2. С. 93
Эндокринологический научный центр РАМН, Москва
С индром овариальной гиперандрогении неопухолевого генеза или гиперандрогенная дисфункция яичников, называемый ранее синдромом Штейна - Левенталя, в настоящее время, согласно классификации ВОЗ, больше известен в мировой литературе, как синдром поликистозных яичников (СПЯ).
Клиническая картина СПЯ проявляется хроническим ановуляторным состоянием яичников или выраженной гипофункцией желтого тела, что приводит к двустороннему увеличению размеров яичников с утолщением и склерозом белочной оболочки. Эти изменения проявляются нарушением менструальной функции - опсоменореей, аменореей, однако не исключается и развитие метроррагии. Нарушения фолликулогенеза приводят к развитию ановуляторного первичного или вторичного бесплодия.
Одним из основных диагностических критериев СПЯ является гиперандрогенемия - повышение уровня андрогенных стероидов в крови (таких как тестостерон, андростендион), что приводит к развитию гирсутизма и других андрогензависимых дермопатий.
Ожирение или избыточная масса тела часто сопутствуют СПЯ. Определение индекса массы тела (ИМТ) позволяет выявить степень ожирения. Измерение показателей объема талии (ОТ) и бедер (ОБ) и их соотношение указывает на тип ожирения (прогностически неблагоприятным является абдоминальный тип ожирения, при котором ОТ/ОБ > 0,85).
Кроме основных симптомов заболевания, клиническая картина во многом определяется общими обменными нарушениями, такими как дислипидемия, нарушение углеводного обмена, повышенным риском развития гиперпластических и опухолевых процессов со стороны гениталий. Дислипидемия заключается в повышении уровня триглицеридов, холестерина, липопротеидов низкой плотности, липопротеидов очень низкой плотности и снижении липопротеидов высокой плотности. Эти нарушения ведут к риску раннего развития атеросклеротических изменений сосудов, гипертонической болезни и ишемической болезни сердца.
Нарушения углеводного обмена заключаются в развитии комплекса инсулинорезистентность-гиперинсулинемия, что в последнее время является основным направлением в изучении патогенетических звеньев развития СПЯ.
В 60-х годах патогенез СПЯ связывали с первичным ферментативным дефектом овариальной 19-гидроксилазы и/или 3b-дегидрогеназы, объединяя эти нарушения в понятие первичного поликистоза яичников. Однако в работах последующих лет было показано, что ароматазная активность клеток гранулезы является ФСГ зависимой функцией.
Выявленный при СПЯ повышенный уровень лютенизирующего гормона (ЛГ), отсутствие его овуляторного пика, нормальный или сниженный уровень фолликулостимулирующего гормона (ФСГ) при нарушенном соотношении ЛГ/ФСГ (2,5-3) предполагал первичное нарушение гонадотропной регуляции стероидогенеза в овариальной ткани с развитием вторичного поликистоза яичников.
До середины 80-х годов считалось (теория S.S.C. Yen) , что пусковым механизмом в патогенезе СПЯ является избыточный синтез андрогенов надпочечниками в период адренархе в результате измененной чувствительности надпочечников к АКТГ или чрезмерной стимуляции сетчатой зоны коры надпочечников не АКТГ-подобным фактором или под влиянием b-эндорфинов , нейротрансмиттеров, например, дофамина . При достижении критической массы тела (особенно при превышении ее нормы) увеличивается периферическая конверсия андрогенов в эстрогены, прежде всего в печени и жировой ткани . Повышение уровня эстрогенов, в первую очередь эстрона, приводит к гиперсенсибилизации гонадотрофов по отношению к люлиберину (ГнРГ). Одновременно под действием эстрона увеличивается продукция гипоталамусом ГнРГ, повышается амплитуда и частота импульсов его секреции, в результате чего увеличивается продукция аденогипофизом ЛГ, нарушается соотношение ЛГ/ФСГ, возникает относительная недостаточность ФСГ . Усиление влияния ЛГ на яичники способствует повышению продукции андрогенов текальными клетками и их гиперплазии. Относительно низкий уровень ФСГ приводит к снижению активности ФСГ-зависимой ароматазы, и клетки гранулезы теряют способность ароматазировать андрогены в эстрогены. Гиперандрогения препятствует нормальному росту фолликулов и способствует формированию их кистозной атрезии. Отсутствие роста и созревания фолликулов еще более ингибирует секрецию ФСГ. Возросший пул андрогенов в периферических тканях конвертируется в эстрон. Замыкается порочный круг.
Таким образом результатом нарушения центральных и периферических механизмов регуляции стероидогенеза является развитие у больных с СПЯ функциональной овариальной гиперандрогении.
Патогенез СПЯ по S.S.C. Yen представлен на схеме 1:
Схема 1.
В начале 80-х годов ряд авторов предложили новую теорию патогенеза синдрома поликистозных яичников, отличную от теории S.S.C. Yen . Было обнаружено, что СПЯ связан с гиперинсулинемией, и этому синдрому свойственны как нарушение репродуктивной функции, так и метаболических процессов.
На наличие взаимосвязи между гиперинсулинемией и гиперандрогенией указывали еще в 1921 году Achard and Thieris . Они описали гиперандрогению у женщины, страдавшей ожирением и сахарным диабетом 2-го типа и назвали это состояние “диабет бородатых женщин”.
В дальнейшем Д. Барген обнаружил, что у женщин с СПЯ и гиперандрогенией отмечалась базальная и глюкозостимулированная гиперинсулинемия по сравнению с контрольной группой женщин одинакового веса, что предполагало наличие инсулинорезистентности. Выявилась прямая зависимость между уровнями инсулина и андрогенов, и было высказано предположение, что причиной гиперандрогении может быть гиперинсулинемия.
В 1988 году G. Reaven впервые высказал предположение о том, что ИР и компенсаторная гиперинсулинемия (ГИ) играют основную роль в развитии синдрома метаболических нарушений. Он назвал его “синдромом Х” . В настоящее время наиболее часто употребляют термин “метаболический синдром” или “синдром инсулинорезистентности” .
Гипотезы патогенеза гиперинсулинемии и гиперандрогении
Механизм возникновения гиперандрогении и гиперинсулинемии окончательно не изучен. Теоретически возможны три варианта взаимодействия: гиперандрогения (ГА) вызывает ГИ; ГИ приводит к ГА: имеется какой-то третий фактор, ответственный за оба феномена .
1. Предположение о том, что ГА вызывает ГИ основано на следующих фактах. У женщин, которые принимают оральные контрацептивы, содержащие прогестины с “андрогенными свойствами”, выявляется нарушение толерантности к глюкозе. Длительное назначение тестостерона транссексуалам сопровождается возникновением ИР . Показано, что андрогены влияют на состав мышечной ткани, увеличивая количество мышечных волокон второго типа, менее чувствительных к инсулину по сравнению с волокнами первого типа .
2. Большинство факторов свидетельствуют в пользу того, что ГИ приводит к ГА. Было показано, что ИР сохраняется у пациенток, подвергшихся субтотальному или тотальному удалению яичников, а также у женщин, длительно применявших агонисты-ГнРГ, когда отмечалась выраженная супрессия уровня андрогенов . Назначение диазоксида - препарата, подавляющего выделение инсулина поджелудочной железой, вызвало снижение уровня тестостерона (Т) и повышение уровня сексстероидсвязывающего глобулина (СССГ) у пациенток с СПЯ, ожирением и гиперинсулинемией. Внутривенное введение инсулина женщинам с СПЯ приводило к повышению уровня циркулирующих андростендиона и Т. Мероприятия, направленные на повышение чувствительности к инсулину (снижение веса, голодание и низкокалорийная диета), сопровождались понижением уровня андрогенов . Есть данные, что инсулин напрямую может подавлять продукцию СССГ печенью, а в условиях гиперинсулинемии этот эффект усиливается. При этом полагают, что инсулин, а не половые гормоны, является основным регулятором синтеза СССГ. Понижение уровня СССГ приводит к возрастанию концентрации свободного и, следовательно, биологически активного Т (в норме 98% Т находится в связанном состоянии) .
Гипотеза, связывающая ГА с гиперинсулинемией, не дает ответа на вопрос, каким образом яичник сохраняет чувствительность к инсулину при инсулинорезистентном состоянии организма. Было предложено несколько возможных объяснений. Так как инсулин обладает множеством функций, можно предположить селективный дефект некоторых из них. Может наблюдаться органоспецифичность чувствительности к инсулину. Но более вероятно предположение о том, что инсулин действует на яичник не только через рецепторы инсулина, но также через рецепторы инсулиноподобных факторов роста (ИФР) .
Инсулиновые рецепторы и рецепторы ИФР-1 были идентифицированы в яичниках человека (в стромальной ткани яичников здоровых женщин, женщин с СПЯ, в фолликулярной ткани и клетках гранулезы) . Инсулин может связываться с рецепторами ИФР-1, хотя с меньшим сродством, чем с собственными рецепторами. Однако при ГИ, а также в ситуации, когда рецепторы инсулина блокированы или имеется их дефицит, можно ожидать, что инсулин будет связываться с рецепторами ИФР-1 в большей степени .
Возможно, механизмы стимуляции инсулином/ИФР-1 стероидогенеза в яичнике могут быть разделены на неспецифические и специфические. Неспецифические заключаются в классическом действии инсулина на метаболизм глюкозы, аминокислот и синтез ДНК. В результате повышается жизнеспособность клетки и, следовательно, усиливается синтез гормонов . Специфические механизмы включают прямое действие инсулина/ИФР-1 на стероидогенные ферменты, синергизм между инсулином и ЛГ/ФСГ и влияние на количество рецепторов к ЛГ .
Инсулин/ИФР-1, действуя синергично с ФСГ, стимулируют ароматазную активность в культуре клеток гранулезы и тем самым увеличивают синтез эстрадиола. Кроме того, они приводят к повышению концентрации рецепторов ЛГ, усиливая ЛГ-зависимый синтез андростендиона тека- и стромальными клетками.
Возрастающая концентрация андрогенов в яичнике под действием инсулина/ИФР-1 вызывает атрезию фолликулов, что приводит к постепенной элиминации эстроген- и прогестеронпродуцирующих клеток гранулезы, с последующей гиперплазией текальных клеток и лютеинизацией межуточной ткани яичника, которые являются местом продукции андрогенов. Этим объясняется тот факт, что стимуляция яичникового стероидогенеза инсулином проявляется преимущественно в виде гиперандрогении.
Было высказано предположение, что инсулин/ИФР-1 могут стимулировать как ЛГ-зависимую активность цитохрома Р450с17a в яичниках, так и АКТГ-зависимую активность Р450с17a в надпочечниках. Этим, по-видимому, объясняется частое сочетание яичниковой и надпочечниковой форм гиперандрогении у пациенток с СПЯ.
Возможна также взаимосвязь с теорией S.S.C. Yen об участии надпочечникового стероидогенеза в патогенезе СПЯ (схема 2).

Схема 2. Действие инсулина при синдроме поликистозных яичников
V. Insler (1993), проведя исследование уровней инсулина, ИФР-1, гормона роста и их корреляции с уровнями гонадотропинов и андрогенов у женщин с СПЯ, предложил две модели развития данного синдрома. У пациенток с ожирением ГИ вызывает избыточную продукцию андрогенов через рецепторы ИФР-1, которые, действуя в синергизме с ЛГ, вызывают повышение активности цитохрома Р450с17a, основного контролирующего фермента в синтезе андрогенов. У пациенток с нормальной массой тела относительное повышение концентрации гормона роста стимулирует избыточную продукцию ИФР-1. С этого момента синергизм с ЛГ приводит к гиперпродукции андрогенов по тому механизму, что и у пациенток с ожирением. Повышение уровня андрогенов вызывает изменение функции гипоталамических центров, приводя к нарушению секреции гонадотропинов и типичным для СПЯ изменениям (схема 3).
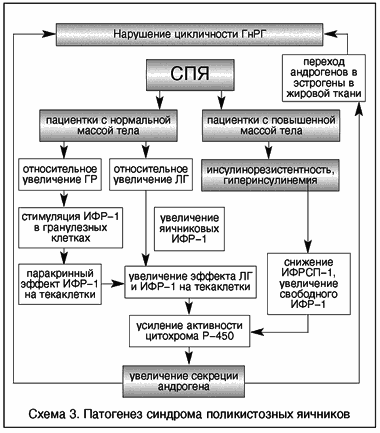
Схема 3. Патогенез синдрома поликистозных яичников
3. Однако имеется ряд хорошо известных состояний ИР, которые не связаны с ГА, например, простое ожирение и СД 2 типа . Для объяснения, почему не у всех пациенток с ожирением и ГИ развивается гиперандрогения и СПЯ, выдвинута гипотеза о существовании генетической предрасположенности к стимулирующему действию инсулина на синтез андрогенов в яичнике . Очевидно, существует ген или группа генов, которые делают яичники женщины с СПЯ более чувствительными к стимуляции инсулином продукции андрогенов .Молекулярные механизмы, приводящие к развитию инсулинорезистентности, до конца не изучены. Однако последние достижения в области молекулярной биологии позволили определить структуру гена, кодирующего рецептор к инсулину у женщин с овариальной гиперандрогенией.
Moller и Flier изучали последовательность аминокислот в структуре ДНК-цепей у больных с овариальной гиперандрогенией. Они обнаружили замещение триптофана на серозин в кодоне 1200. Исследователи предположили, что такое изменение нарушает процесс активации тирозин-киназной системы в рецепторе к инсулину. Низкая активность инсулиновых рецепторов приводит к развитию ИР и компенсаторной ГИ.
Yoshimasa et al. описали другой вариант точечной мутации у больной с гиперандрогенией, инсулинорезистентностью и черным акантозом. Они обнаружили замещение серина на аргинин в тетрамерной структуре инсулинового рецептора. Данная мутация в активном локусе приводила к невозможности соединения a- и b-субъединиц, в результате чего функционально активный рецептор не синтезировался. Приведенные исследования - лишь первые попытки выявления специфической генетической этиологии стромального текоматоза яичников.
Позднее Dunaif A. отмечает, что при синдроме поликистозных яичников ИР может быть обусловлена нарушением аутофосфорилирования b-субъединиц инсулинового рецептора (иР), цитоплазматическая часть которых обладает тирозинкиназной активностью. При этом повышается инсулиннезависимое фосфорилирование остатков серина (СПЯ-ser) с подавлением активности тирозинкиназы (вторичный передатчик сигнала, определяющий чувствительность инсулина к одноименным рецепторам). Данный дефект характерен только для СПЯ-зависимой ИР, при других инсулинорезистентных состояниях (ожирение, ИНСД) эти изменения не выявляются .
Нельзя исключить, что при СПЯ-ser существует некий серинфосфорилирующий фактор. Так, например, выделяют ингибитор серин/треонинфосфатазы, который, по-видимому, и нарушает фосфорилирование иР при СПЯ-ser. Данное соединение схоже с недавно выделенным мембранным гликопротеидом РС-1 (ингибитор тирозинкиназы инсулинового рецептора), но последний не увеличивает инсулиннезависимое фосфорилирование серина иР.
Подобными свойствами обладает и фактор некроза опухоли-a (ФНО-a): фосфорилирование остатков серина IRS-1 (один из вторичных передатчиков сигнала иР) под влиянием ФНО-a влечет за собой подавление тирозинкиназной активности иР.
Moller et al. обнаружили, что фосфорилирование серина Р450с17 человека, ключевого фермента, регулирующего биосинтез надпочечниковых и овариальных андрогенов, повышает 17,20-лиазную активность. Модулирование энзимной активности стероидогенеза за счет фосфорилирования серина было описано для 17b-гидроксистероиддегидрогеназы. Если предположить, что один и тот же фактор (энзим) фосфорилирует серин инсулинового рецептора, вызывая ИР, и серин Р450с17, вызывая гиперандрогению, то тогда можно объяснить взаимосвязь СПЯ и ИР. В экспериментах in vitro было показано, что протеинкиназа А (серин/треонинкиназа) катализирует фосфорилирование серина инсулиновых рецепторов (схема 4).

Схема 4. Ген инсулинорезистентности при СПЯ
Роль лептина при СПЯВ последнее время проводился ряд исследований, посвященных биологической роли лептина, результаты которых обнадеживают. Являясь протеиновым гормоном, лептин влияет на пищевое поведение и оказывает пермиссивное действие в отношении инициации полового созревания у животных. Роль данного гормона в регуляции метаболизма и репродуктивной функции у человека, к сожалению, окончательно не выяснена. По этой причине данные об уровне лептина при овариальной гиперандрогении в сочетании с инсулинорезистентностью и представления о его роли в развитии этих изменений весьма противоречивы.
В последнее время проводился ряд исследований, посвященных биологической роли лептина, результаты которых обнадеживают. Являясь протеиновым гормоном, лептин влияет на пищевое поведение и оказывает пермиссивное действие в отношении инициации полового созревания у животных. Роль данного гормона в регуляции метаболизма и репродуктивной функции у человека, к сожалению, окончательно не выяснена. По этой причине данные об уровне лептина при овариальной гиперандрогении в сочетании с инсулинорезистентностью и представления о его роли в развитии этих изменений весьма противоречивы.Так, согласно результатам исследования, проведенного Brzechffa et al. (1996), значительная часть женщин в популяции с СПЯ имеет уровень лептина выше, чем ожидалось с учетом их ИМТ, свободного тестостерона, чувствительности к инсулину. С другой стороны, последние работы в этой области не показали существенных различий уровней лептина в исследуемых группах при СПЯ и в группах контроля. Кроме того, было установлено, что на содержание лептина не оказывают влияние базальный уровень инсулина, содержание гонадотропинов и половых стероидов. Однако Zachow и Magffin (1997), принимая во внимание данные о наличии мРНК рецепторов лептина в овариальной ткани, продемонстрировали прямое действие указанного гормона на стероидогенез клеток гранулезы крыс in vitro. При этом было показано дозозависимое подавляющее действие лептина на ИФР-1, потенцированное увеличением ФСГ-стимулированного синтеза Е 2 клетками гранулезы. Эти данные подтверждают гипотезу о том, что повышение уровня лептина у лиц с ожирением может противодействовать созреванию доминантного фолликула и овуляции. Весьма интересными являются данные Spicer и Franciso (1997), свидетельствующие о том, что лептин в нарастающих концентрациях (10-300 нг/мл) ингибирует инсулинзависимую продукцию Е 2 и прогестерона в культуре клеток гранулезы. Этот эффект обусловлен наличием специфических сайтов связывания для лептина. По аналогии с этим можно предположить, что высокий уровень лептина может снижать чувствительность у других тканей-мишеней к действию эндогенного инсулина, приводя к развитию ИР при ожирении.
Диагноз
Диагностика синдрома овариальной гиперандрогении при типичной клинической картине не представляет трудностей. Прежде всего это нарушение менструальной функции по типу олиго-, опсо- или аменореи, ановуляция и обусловленное ею первичное или вторичное бесплодие, гирсутизм, угревая сыпь, у 40% больных имеется ожирение различной степени выраженности. При гинекологическом осмотре выявляется двухстороннее увеличение размеров яичников, нередко на фоне гипопластичной матки.
Важное место в диагностике СПЯ занимают гормональные методы исследования , направленные на выявление гиперандрогении, ее источника и определение уровня гонадотропных гормонов: ЛГ и ФСГ. У больных с СПЯ часто встречается преобладание уровня ЛГ над ФСГ, соотношение их нарушено и увеличено (больше 2,5-3). Уровень пролактина нормальный, хотя у 30% больных наблюдается его некоторое повышение.
Уровень экскреции с мочой суммарных 17-КС при СПЯ колеблется в широких пределах и мало информативен. Определение фракций 17-КС (ДГА, 11-окисленных кетостероидов, андростерона, этиохоланолона) также не обеспечивает выявление локализации источника гиперандрогении . Подтверждением овариального источника гиперандрогении является повышение уровня андростендиона (А) и тестостерона (Т) крови и повышение соотношения А/Т. Надпочечниковый генез гиперандрогении подтверждается при повышении уровня дегидроэпиандростерона (ДГА) и его сульфата (ДГА-С) и 17-оксипрогестерона (17-ОН-Р) в крови. Для уточнения локализации источника гиперандрогении предложены различные функциональные тесты, наибольшее распространение из которых получили проба с дексаметазоном, синактеном-депо.
С учетом открытия новых патогенетических звеньев в развитии СПЯ для оценки состояния углеводного обмена необходимо проводить стандартный глюкозо-толерантный тест (75 мл глюкозы per os) с определением уровня глюкозы и иммуно-реактивного инсулина (ИРИ). Свидетельством в пользу инсулинорезистентности являются также ИМТ более 25 и ОТ/ОБ больше 0,85, а также дислипидемия.
Лечение
В основе современного подхода к патогенетическому лечению СПЯ лежит принцип восстановления нарушенной функции яичников
, то есть устранение ановуляции, что в свою очередь приводит к снижению гиперандрогении и восстановлению фоликулогенеза. Однако изучение особенностей этиопатогенеза овариальной гиперандрогении приводит к заключению, что выбор методов адекватного лечения СПЯ оказывается непростой задачей.
Комбинированные оральные контрацептивы - наиболее часто используемая при СПЯ группа препаратов. Механизм действия заключается в подавлении повышенного ЛГ, нормализации соотношения ЛГ/ФСГ, повышении синтеза печенью СССГ. После отмены достигается “ребаунд-эффект”, заключающийся в нормализации гипоталамо-гипофизарной функции, снижении гиперпродукции андрогенов овариальной тканью, нормализации фолликулогенеза и восстановлении овуляции.
Лечение проводится по стандартной схеме: по 1 таблетке в день с 5 по 25 день цикла в течение 3-6 месяцев. При необходимости курсы повторяют. Однако известно, что длительный прием эстроген-гестагенных контрацептивов может привести к гиперинсулинемии, усугубляя тем самым основное патогенетическое звено СПЯ.
Некоторые контрацептивы имеют в своем составе гестагенные компоненты производные 19-норстероидов (норэтистерон, левоноргестрел), обладающих в разной степени андрогенными эффектами, в связи с чем назначение препаратов, содержащих эти компоненты, у больных с гирсутизмом ограничено. Более целесообразно при симптомах гиперандрогении использовать оральные контрацептивы с гестагеном без андрогенного действия.
Возможно применение гестагенных препаратов, лишенных андрогенных свойств в виде монотерапии, особенно при гиперплазии эндометрия. Дидрогестерон назначают по 1 таблетке (10 мг) 2 раза в день с 14-16 по 25 день цикла продолжительностью от 3 до 6 курсов.
Наиболее эффективным средством стимуляции овуляции при СПЯ является антиэстрогенный препарат кломифенцитрат . Основными эффектами антиэстрогенов являются снижение гиперсенсибилизации гипофиза к действию ГнРГ, снижение продукции ЛГ, индукция овуляторного выброса ЛГ, стимуляция овуляции. Препарат назначается по 50 мг, 100 мг в сутки с 5 по 9 день цикла до достижения овуляции по тестам функциональной диагностики, но не более 3-х курсов подряд. В последнее время появились публикации о влиянии кломифенцитрата на систему инсулин-инсулиноподобный фактор роста. В них указывалось, что к 5 дню проводимой стимуляции овуляции кломифеном (150 мг/сут) определялось прогрессивное снижение (максимально на 30%) уровня ИФР-1. Однако в ряде других аналогичных исследований достоверного снижения базального уровня инсулина в ответ на введение кломифена не было обнаружено.
Появление препаратов с антиандрогенными свойствами значительно расширило терапевтические возможности при СПЯ. Наиболее широко применяется препарат Диане-35, содержащий 35 мг этинилэстрадиола и 2 мг ципротерона ацетата. Кроме действия, характерного для оральных контрацептивов, препарат блокирует действие андрогенов на уровне клеток-мишеней, в частности, волосяных фолликулов. Последнее приводит к уменьшению гирсутизма. Препарат применяют по стандартной схеме, как оральный контрацептив курсами по 6 и более циклов. Однако нужно отметить наличие отрицательного эффекта этих препаратов на липидный и углеводный обмены, проявляющегося в повышении уровня холестерина, липопротеидов низкой плотности, а также в увеличении гиперинсулинемии, что требует постоянного динамического контроля за этими показателями у пациенток с СПЯ. Антиандрогенными свойствами обладают также спиронолактон, который широко применяется в лечении андрогензависимых дермопатий.
Одним из основных направлений в современной терапии овариальной гиперандрогении является поиск и применение препаратов и средств, направленных на устранение инсулинорезистентности и компенсаторной гиперинсулинемии.
Прежде всего это мероприятия, обеспечивающие снижение избыточной массы тела: низкокалорийная диета (в пределах 1500-2200 ккал/сут) с ограничением жиров и легко усваиваемых углеводов, ограничение потребления соли до 3-5 г в сутки, занятия умеренной физической нагрузкой, нормализация режима труда и отдыха. Возможно применение препаратов, способствующих снижению ИМТ, например, орлистата, селективно угнетающего желудочно-кишечные липазы (“блокатор жира”) или сибутрамина, блокирующего обратный захват норадреналина и серотонина в синапсах гипоталамического центра “насыщения”. Увеличенный расход энергии (термогенез) также обусловлен синергическим взаимодействием между усиленной функцией норадреналина и серотонина в центральной нервной системе. Это выражается в селективной активации центрального симпатического воздействия на бурую жировую ткань за счет непрямой активации b 3 -адренорецепторов.
Следующим этапом является применение препаратов, улучшающих нарушенную чувствительность тканей к действию инсулина. В литературе имеются данные о снижении гиперандрогении и восстановлении менструальной и овуляторной функции при назначении препаратов ряда бигуанидов (метформин /Сиофор®/, “Берлин-Хеми”). Они потенцируют действие инсулина на рецепторном и пострецепторном уровне и значительно улучшают чувствительность тканей к данному гормону. В некоторых исследованиях показано значительное снижение уровня инсулина натощак и через 2 часа после нагрузки 75 г глюкозы у женщин с СПЯ, применявших метформин. Это снижение коррелировало со снижением уровня андрогенов. Необходимо отметить также, что применение бигуанидов, нормализующих углеводные нарушения, нередко приводит к снижению ИМТ у пациенток с ожирением и положительно влияет на липидный обмен.
В мировой литературе сообщаются результаты применения препаратов, относящихся к классу тиазолидиндионов. Исследования показали, что на фоне лечения троглитазоном (200-400 мг/сут) улучшается чувствительность к инсулину у женщин с СПЯ, снижается уровень андрогенов. Однако выявленное цитотоксическое, гепатотоксическое действие этой группы препаратов ограничивает возможность их широкого применения. Ведется поиск новых препаратов, избирательно влияющих на чувствительность к инсулину.
Несмотря на значительный арсенал различных средств, применяемых для лечения овариальной гиперандрогении, терапия данной патологии должна быть комплексной и последовательной, учитывающей ведущее патогенетическое звено на данном этапе лечения.
Лечение женщин с СПЯ должно быть направлено не только на коррекцию выявленных симптомов этого заболевания, но и на профилактику возможных будущих осложнений. Очень важным является подавление избыточной секреции андрогенов и индуцирование стабильности ежемесячных менструальных кровотечений, что радежно достигается при применении препаратов с антиандрогенными свойствами (Диане-35).
В случае неэффективности консервативной терапии через год можно ставить вопрос об оперативном лечении - лапароскопии с клиновидной резекцией яичников или их лазерной вапоризацией . Эффективность хирургического лечения высокая (до 90-95% восстановления овуляции), а предварительная патогенетическая терапия повышает стабильность достигнутого результата.
Литература:1. Овсянникова Т.В., Демидова И.Ю., Глазкова О.И. Проблемы репродукции, 1998; 6: 5-8.
2. Гинзбург М.М., Козупица Г.С. Проблемы эндокринологии, 1997; 6: 40-2.
3. Старкова Н.Т. Клиническая эндокринология. Руководство для врачей, 1991; 399.
4. Givens J.R., Wiedeme E. B-endorphine and B-lipotropin levels in hirsute women: correlation with body weight. J Clin Endocr Metabol. 1980; 50: 975-81.
5. Aleem F.A., McIntosh T. Elevated plasma levels of f-endorph in a group of women with polycystic ovarian desease. Fertil and Steril. 1984; 42: 686-9.
6. Дедов И.И., Сунцов Ю.И., Кудрякова С.В. Проблемы эндокринологии. 1998; 6: 45-8.
7. Francis S., Greenspan, Forshman P.H. Basic and clinical endocrinology. 1987.
8. Акмаев И.К. Проблемы эндокринологии. 1990; 12-8.
9. Barbieri R.L., Hornstein M.D. Hyperinsulinemia and ovarian hyperandrogenism: cause and effect. Endocrinol Metab Clin North Am. 1988; 17: 685-97.
10. Barbieri R.L., Macris A., Ryan K.J. Insulin stimulates androgen accumulation in incubation of human ovarian stroma and theca. Obstet Gynecol. 1984; 64: 73-80.
11. Barbieri R.L., Ryan K.J. Hyperandrogenism, insulin resistence, acantosis nigricans: a common endocrinopathy with unique pathophysiologic features. Am J Obstet Gynecol. 1983; 147: 90-103.
12. Barbieri R.L., Smith S., Ryan K.J. The role of Hyperinsulinemia in the pathogenesis of ovarian Hyperandrogenism. Fertil and Steril. 1988; 50: 197-210.
13. Stuart C.A., Prince M.J., Peters E.J. Obstet Gynecol. 1987; 69: 921-3.
14. Yen S.S.C. Chronic anovuletion causet by peripheral endocrine disorders. In: Yen S.S.C., Jaffe R.B. Reproductive endocrinology: physiology, pathophysiology, and clinical managment. Philadelphia: Saunders W.B. 1986; 462-87.
15. Moller D.E., Flier J.S. Detection of an alteration in the insulin-reseptor gene in a patient with insulin resistance, acantosis nigricans and polycystic ovarian syndrome. N Engl J Med. 1988; 319: 1526-32.
16. Burgen G.A., Givens J.R. Insulin resistance and hyperandrogenism: clinical syndromes and possible mechanisms. Hemisphera Pablishing CO, Washington, DC. 1988; 293-317.
17. Speroff L., Glass R. H. Clinical gynecologic. Endocrinology and Infertiliti 5 th ed. 1994.
18. Yoshimasa Y., Seino S., et al. Insulin resistance diabetes due to a point mutacion that privents insulin proreceptor processing./ Science. 1988; 240: 784-9.
19. Dunaif A. Endocrin. Rev., 18(6): 1997; 12: 774-800.
Этинилэстрадиол + ципротерона ацетат
Диане-35 (торговое название)
(Shering AG)