Выполнено экспериментальное исследование на 15 собаках с целью изучения влияния мексикора на фоне временного портокавального шунтирования на выраженность ишемического повреждения ткани печени после пережатия печеночно-двенадцатиперстной связки. Животные разделены на две группы. Первую группу составили 12 животных, которым проводилась противоишемическая защита. Во второй группе из трех собак коррекция ишемии не проводилась. Установлено, что в группе без противоишеми-ческой защиты развитие цитолитического, холестатического и гепатодепрессивного синдромов было резко выражено. В экспериментальной группе с коррекцией ишемии биохимические показатели подвер-гались значительно меньшим изменениям с нормализацией их к седьмым суткам наблюдения. Результа-ты исследования свидетельствуют о том, что применение противоишемической защиты снижает тяжесть поражения печени вследствие кислородного голодания, предотвращает развитие ишемических измене-ний в органе и обеспечивает защитный и лечебный эффекты.
противоишемическая защита.
ишемия печени
мексикор®
1. Андрейман Л.А., Меерсон Л.Г., Бренце А.А. Острая ишемия печени в эксперименте // Острая ишемия органов и меры борьбы с постишемическими расстройствами. - М., 1983. - С. 132-134.
2. Голиков А.П., Давыдов Б.В., Руднев Д.В. и соавт. Влияние мексикора на окислительный стресс при остром инфаркте миокарда // Кардиология. - 2005. - № 7. - С. 21-26.
3. Израелашвили М.Ш. Временное выключение афферентных сосудов одной половины печени // Хирургия. - 1983. - С. 50-53.
4. Меньщикова Е.Б., Зенков Н.К. Антиоксиданты и ингибиторы радикальных окислительных процессов // Успехи совр. биологии. - 1993. - Т. 113. - Вып. 4. - С. 442-455.
5. Новиков В.Е., Катунина Н.П. Фармакология и биохимия гипоксии // Обзоры по клинической фармакологии и лекарственной терапии. - 2002. - Т. 1. - С. 73-87.
6. Оковитый С.В. Клиническая фармакология антигипоксантов (часть II) // ФАРМиндекс-Практик. - 2004. - № 7. - С. 48-63.
7. Шнейвайс В.Б., Левин Г.С. Роль свободнорадикального окисления в патогенезе острого некроза печени при висцерально-ишемическом шоке // Патол. физиология и эксперим. терапия. - 1996. - № 2. - С. 39-43.
8. Halliwell B. Antioxidants in human health and disease / B. Halliwell // Ann. Rev. Nutr.- 1996. - Vol. 16. - P. 33-50.
9. Rosser B.G., Gores G.J. Liver cell necrosis: cellular mechanisms and clinical implications // Gastroenterology. - 1995. - Vol. 108. - P. 252-275.
Введение
В настоящее время одной из важнейших в хирургии печени является проблема гемостаза. Массивное кровотечение, стоящее в ряду наиболее опасных осложнений, нередко приводит к летальному исходу. Предотвратить это можно применением наиболее оптимального и эффективного способа - пережатием печеночно-двенадцатиперстной связки (ПДС) . Но при этом могут развиться портальная гипертензия, гипоксия и ишемия печени, дестабилизироваться гемодинамика , что после 15-минутного (и более) воздействия приводит к необратимым морфофункциональным изменениям в печени вплоть до появления в ее ткани некротических участков .
Для улучшения микроциркуляции в печени и с целью позитивного воздействия на ткани органа можно применять препараты антиоксидантной направленности , которые, влияя на диффузию и утилизацию кислорода, способствуют улучшению анаэробного и аэробного энергообмена, уменьшают тканевую гипоксию и энергодефицит, повышают оксигенацию тканей и стимулируют репаративно-регенеративные процессы . Одним из перспективныхпрепаратов этой группы является мексикор , применение которого при ишемии печени может благоприятствовать улучшению клинических результатов.
В связи с этим целью данной работы являлась оценка эффективности лечебного и профилактического воздействия мексикора в эксперименте на выраженность ишемического поражения печени в условиях длительной ишемии печени (30 минут).
Материалы и методы исследования
Для профилактики и лечения ишемии и гемодинамических изменений, возникающих при резекции печени, в условиях временного ее выключения из кровообращения и купирования реперфузионных расстройств за 2 часа до операции животному (собаке) внутривенно струйно, вводили мексикор в виде 5 % раствора в дозе 10 мг/кг веса. После этого под внутривенным гексеналовым наркозом (0,03 г/кг) выполняли лапаротомию. Затем интраоперационно, перед пережатием ПДС для разгрузки портальной системы накладывали временный экстракорпоральный портокавальный шунт между одной из тонкокишечных вен (вена портального бассейна) и подкожной веной на передней конечности животного (система верхней полой вены). Перед работой шунт заполняли 5 % раствором глюкозы с гепарином, который вводили из расчета 120 Ед/кг веса животного. Затем производили инфильтрацию печеночно-двенадцатиперстной связки 10 мл 0,25 % раствора новокаина и пережимали ее эластичным зажимом на 30 минут. После устранения блокады печеночно-двенадцатиперстной связки наложенный шунт снимали, канюлируемые вены перевязывали. Раны на передней брюшной стенке и передней конечности животного ушивали наглухо. В послеоперационном периоде мексикорвводили 1 раз в сутки в 8 00 на протяжении 7 дней.
Исследование выполнено на 15 беспородных собаках с контрольным забором крови из бедренной вены для биохимических исследований у всех животных. 12 животным проводилась противоишемическая защита, 3 собаки составили группу без коррекции ишемии. Наблюдение проводилось до 7-х суток включительно, из опыта животные выводились для взятия морфологического материала. Биохимические исследования (определение АЛТ, АСТ, ЛДГ, билирубина, щелочной фосфатазы, фибриногена, ПТИ, общего белка) проводились по общепринятым методикам.
Статистическая обработка результатов исследования проводилась путем вычисления средних арифметических (М) и средних ошибок средних (m). Достоверными считали различия при вероятности ошибки менее 5 % (p<0,05).
Результаты исследования и их обсуждение
При биохимических исследованиях сыворотки крови экспериментальных животных было выявлено, что без коррекции ишемии печени развивались цитолитический и, в меньшей степени, холестатический игепатодепрессивный синдромы.
30-минутная реперфузия характеризовалась увеличением активностиАЛТ, АСТ, ЛДГ с достижением максимальных значений на 3-и сутки после операции (табл. 1), причем их возвращения к исходным величинам до окончания эксперимента не отмечалось. Коррекция ишемии печени по предложенному нами способу уменьшала активность трансаминаз после оперативного вмешательства при всех сроках наблюдения. Так, 30-минутный промежуток реперфузии характеризовался уменьшением значений АЛТ, АСТ и ЛДГ по сравнению с соответствующими без противоишемической защиты с применением мексикора. Наиболее выраженные изменения трансаминаз были отмечены на третьи сутки эксперимента, однако к концу 7-х суток эти показатели нормализовались.
Таблица 1
Динамика изменения показателей цитолитического синдрома (M±m)
|
условия опыта |
время после ишемии (суток) |
||||
|
контроль |
|||||
|
мексикор |
|||||
|
мексикор |
|||||
|
3,25±0,26 *1, 4 |
2,10±0,29 *1, 4 |
3,19±0,21 *1, 4 |
|||
|
мексикор |
1,12±0,14 *1, 5 |
0,92±0,06 *1, 5 |
1,74±0,12 *1, 5 |
||
|
2,81±0,09 *1, 4, 6 |
1,54±0,07 *1, 4, 6 |
2,72±0,18 *1, 4, 6 |
|||
|
мексикор |
0,76±0,13 *1, 5, 7 |
0,47±0,08 *1, 5, 7 |
1,39±0,06 *1, 5, 7 |
Примечание: единицы измерения АЛТ, АСТ, ЛДГ - ммоль/(ч·л); здесь и далее: * достоверность различий по сравнению со значениями колонок 1 - 9 соответствует уровню значимости p<0,05; n-количество животных в группе.
Сравнение результатов экспериментов в группах с введением мексикора и без него, выявило, что сроки повышений и понижений активности ферментов совпадали, но амплитуда изменений на фоне введения антиоксидантного препарата была значительно меньше.
После применения нами противоишемической защиты, в противоположность данным, полученным при 30-минутной ишемии без введения мексикора и портокавального шунтирования (табл. 2), наблюдалось незначительное повышение значений билирубина и щелочной фосфатазы лишьв течение первых трех суток послеоперационного периода с нормализацией их к седьмым суткам.
Таблица 2
Изменение показателей холестатического синдрома в динамике (M±m)
|
условия опыта |
время после |
билирубин |
щелочная фосфатаза; n=15 |
|
|
контроль |
||||
|
мексикор |
||||
|
мексикор |
||||
|
25,11±1,64 *1, 4 |
3,02±0,24 *1, 4 |
|||
|
мексикор |
14,72±0,87 *1, 5 |
2,81±0,21 *1, 5 |
||
|
20,24±0,73 *1, 4, 6 |
2,61±0,14 *1, 4, 6 |
|||
|
мексикор |
13,45±0,63 *1, 5, 7 |
2,49±0,16 *1, 5, 7 |
Примечание: единицы измерения: билирубин-мкмоль/л; щелочная фосфатаза-ммоль/(ч·л).
Без проведения противоишемических мероприятий проявлялись резко выраженные признаки гепатодепрессивного синдрома (табл. 3), что характеризовалось значительным ростом таких показателей, как фибриноген, ПТИ, общий белок, которые и на момент окончания эксперимента к своим исходным значениям не возвращались. Введение мексикора на фоне временного экстракорпорального портокавального шунтирования при 30-минутном выключении печени из кровотока сопровождалось незначительным снижением ПТИ, общего белка и фибриногена с полнымвосстановлением этих показателей к 7 суткам.
Таблица 3
Динамика изменения показателей гепатодепрессивного синдрома (M±m)
|
условия опыта |
время после ишемии |
фибриноген |
|||
|
контроль |
|||||
|
мексикор |
|||||
|
мексикор |
|||||
|
3,09±0,15 *1, 4 |
62,7±1,47 *1, 4 |
60,4±1,12 *1, 4 |
|||
|
мексикор |
3,73±0,14 *1, 5 |
79,8±1,73 *1, 5 |
68,3±1,16 *1, 5 |
||
|
3,41±0,14 *1, 4, 6 |
75,8±2,05 *1, 4, 6 |
67,8±1,09 *1, 4, 6 |
|||
|
мексикор |
3,85±0,13 *1, 5, 7 |
81,6±2,01 *1, 5, 7 |
69,8±2,09 *1, 5, 7 |
Примечание: единицы измерения: фибриноген-мг/л; ПТИ- %; общий белок- г/л.
Морфологические исследования образцов ткани печени, полученных у животных, без коррекция ишемии, выявили нарушение архитектоники печеночной паренхимы с дискомплексацией балок гепатоцитов, расширением синусоидов и набуханием цитоплазмы гепатоцитов. Отмечалось появление большого количества лейкоцитов между печеночными дольками и балками на фоне резкого снижения количества ШИК- позитивных веществ в гепатоцитах вплоть до их отсутствия. Для всех участков долек была характерна картина с резко выраженной зернистой и вакуольной дистрофией гепатоцитов в сочетании с липоидозом, отмечались обширные участки коагуляционного некроза паренхимы.
На фоне антиоксидантной терапии с временным экстракорпоральным шунтирование -гистоархитектоника печеночной паренхимы была сохранена при отсутствии нарушений в балочной структуре. Синусоиды хорошо структурированы, умеренно расширены, полнокровие центральных вен выражено умеренно, преимущественно в центролобулярных участках. У гепатоцитов границы были четкими, цитоплазма однородной, мелкозернистой, ядра - изоморфные с сохраненной структурой.
Таким образом, можно отметить, что внутривенное введение мексикора с наложением временного экстракорпорального портокавального шунта при 30-минутной ишемии печени способствует нормализации биохимических процессов, препятствуя развитию гепатонегативных синдромов и нарушению структуры печеночной паренхимы. Противоишемическая защита с применением предложенной нами схемы предотвращает развитие ишемических изменений в органе, что значительно снижает тяжесть возможного поражения печени вследствие кислородного голодания и обеспечивает не только защитный, но и лечебный эффект, делая возможным его использование с лечебной и профилактической целью.
Рецензенты:Затолокин В.Д., д.м.н., профессор, профессор кафедры оперативной хирургии и топографической анатомии с курсом госпитальной хирургии медицинского института государственного университета, г. Орел.
Яковлева Т.П., д.м.н., зав. кафедрой охраны труда, факультета охраны труда и окружающей среды Российского государственного социального университета, г. Москва.
Библиографическая ссылка
Перьков А.А., Ямпольский Л.М. КОРРЕКЦИЯ ИШЕМИЧЕСКОГО ПОРАЖЕНИЯ ПЕЧЕНИ С ПРИМЕНЕНИЕМ МЕКСИКОРА // Современные проблемы науки и образования. – 2014. – № 2.;URL: http://science-education.ru/ru/article/view?id=12528 (дата обращения: 22.02.2020). Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
Тесная связь между сердечной и печеночной дисфункциями изучается врачами разных специальностей на протяжении более чем двух столетий. Тем не менее сложность и особенности этой ассоциации и сейчас вызывают активный интерес ученых, а результаты относительно немногочисленных исследований нередко очень противоречивы, что может объясняться несколькими причинами.
Например, этиология сердечной недостаточности (СН) со временем изменилась. Если раньше СН главным образом была связана с ревматической клапанной болезнью, то сейчас в основном с ишемической кардиомиопатией. Кроме того, исходы СН резко улучшились вследствие эффективности фармакотерапии и широкого проведения трансплантации сердца. Поэтому кардиальный цирроз печени (ЦП), который ранее рассматривался как парадигма ассоциации печени и СН, в настоящее время встречается редко.
В связи с тем что СН является системным хроническим заболеванием, при ее наличии поражается множество органов, включая печень и почки. Особенности сосудистой системы печени и ее высокая метаболическая активность делают ее высоко уязвимой к нарушениям системной гемодинамики и инициируют многие молекулярные и гемодинамические изменения.
Печеночная дисфункция (ПД) часто встречается у пациентов с СН (по данным разных авторов, в 15-65% случаев) и тесно коррелирует с гемодинамическими параметрами.
В настоящее время систематизацию сочетанной патологии сердца и печени проводят в зависимости от первичной локализации патологического процесса (табл. 1) .
В данном обзоре мы сфокусируемся на основной патологии печени, обусловленной заболеваниями сердечно-сосудистой системы, в первую очередь на застойной гепатопатии (ЗГ) и кардиогенном ишемическом гепатите, а также патологии сердца, сформировавшейся на фоне заболеваний печени (цирротическая кардиомиопатия).
Застойная кардиальная гепатопатия
ЗГ («застойная печень») включает в себя спектр клинических, биохимических, гистологических и гемодинамических нарушений, связанных с хроническим повреждением печени вследствие правожелудочковой/правопредсердной СН или любой другой причины повышения центрального венозного давления, включая бивентрикулярную СН вследствие ишемической болезни сердца или кардиомиопатии, тяжелую легочную гипертензию или легочное сердце, констриктивный перикардит, а также вальвулопатии, такие как митральный стеноз и трикуспидальная регургитация. Это состояние было впервые подробно описано выдающимся гепатологом Шейлой Шерлок в 1951 году.
Основными механизмами формирования ЗГ являются переполнение кровью центральных вен и центральной части печеночных долек, развитие в них локальной гипоксии, приводящей к возникновению дистрофических и атрофических изменений, а впоследствии – к некрозу гепатоцитов, синтезу коллагена и развитию фиброза. При этом давление в воротной вене не превышает давления в нижней и верхней полых венах, вследствие чего портокавальные анастомозы развиваются крайне редко. Тяжесть и характеристики повреждения печени зависят от вовлеченных сосудов, выраженности венозного застоя и снижения перфузии. Первое описание «мускатной печени» было сделано Kiernan и Mallory, которые показали центральный застой и очаговый некроз печени, связанные с нарушенной циркуляцией крови в печени.
Клинические проявления ЗГ зависят от скорости нарастания СН: если венозный застой в печени развивается быстро, то в клинике будут доминировать жалобы на острые боли в правом подреберье, связанные с растяжением капсулы печени, нередко симулирующие острую хирургическую патологию. Если СН развивается медленно, в течение нескольких месяцев или лет, то ее проявления будут доминировать и маскировать симптоматику ЗГ. Последний вариант встречается значительно чаще, поэтому в подавляющем большинстве случаев ЗГ протекает малосимптомно или асимптомно. В таких случаях пациенты предъявляют жалобы на одышку, ортопноэ и кардиалгии, практически не обращая внимания на тяжесть в правом подреберье и изменение цвета кожных покровов, поскольку желтуха и болевой синдром малоинтенсивны. Объективные признаки ЗГ (увеличенная, плотная и болезненная при пальпации печень с твердым и гладким краем) определяются на фоне расширения яремных вен, появления гепатоюгулярного рефлюкса и симптомов СН.
Отличительной чертой ЗГ является то, что выраженность ее симптоматики варьирует в зависимости от состояния центральной гемодинамики и эффективности лечения основной причины СН. Адекватная терапия СН приводит к быстрому уменьшению размеров печени и нивелированию клинических признаков ЗГ. Еще одна характерная особенность ЗГ состоит в отсутствии признаков портальной гипертензии (варикозное расширение вен пищевода и желудка, «caput medusaе») и так называемых малых признаков цирроза (пальмарная эритема, телеангиэктазии, «лакированный» язык). При тяжелом или рефрактерном течении СН явления ЗГ прогрессируют, и постепенно развивается кардиальный ЦП, сопровождающийся появлением асцита и спленомегалии. Печень становится плотной, ее край – острым, а размеры остаются постоянными и не зависят от эффективности лечения СН.
В большинстве случаев при легкой СН уровни сывороточных трансаминаз (АлАт, АсАт) и билирубина не превышают нормальных показателей, однако при тяжелой СН активность маркеров цитолитического и холестатического синдромов, а также уровень билирубина обычно возрастают. Примерно у 30% пациентов с ЗГ уровень трансаминаз превышает норму в 2-3 раза. Значительное снижение фракции выброса (ФВ) обычно сопровождается существенным повышением уровня сывороточных трансаминаз вследствие вторичной ишемии печени. У части больных отмечается холестатический компонент, отражающийся в повышении уровня γ-глютамилтрансферазы (ГГТ) и щелочной фосфатазы, являющихся независимыми факторами венозного застоя и снижения перфузии.
В частности, повышение уровня ГГТ не только ассоциируется с более тяжелым классом СН, более низкой ФВ и повышением уровня натрийуретического гормона В-типа, но и является независимым предиктором смерти и трансплантации сердца. Гипербилирубинемия для ЗГ не характерна, однако при тяжелой СН может отмечаться небольшое повышение уровня общего и непрямого билирубина, что рассматривается как неблагоприятный прогностический признак. При развитии кардиального цирроза появляется диспротеинемия (снижение концентрации общего белка и альбумина, повышение уровня α 2 – и γ-глобулинов), в 75% случаев увеличивается протромбиновое время. Характерными признаками асцита, развивающегося вследствие ЗГ и кардиального цирроза, являются высокое содержание белка в асцитической жидкости (>2,5 г/дл) и увеличение значения сывороточно-асцитического градиента альбумина (>1,1 г/дл). У многих больных, особенно с тяжелой СН, повышается уровень мочевой кислоты, что в настоящее время рассматривается как маркер воспаления, метаболических расстройств, оксидативного стресса, эндотелиальной дисфункции и, возможно, миокардиального повреждения. Гиперурикемия может быть следствием снижения ренальной перфузии и экскреции уратов, она хорошо коррелирует с более высоким давлением в легочной артерии и правом желудочке, а также с клиническими признаками застойной СН.
Для подтверждения диагноза ЗГ необходимо исключение других причин повреждения печени, в частности исключение наличия вирусного гепатита В и С при помощи иммуноферментного анализа или полимеразной цепной реакции, а также алкогольной болезни печени, неалкогольной жировой болезни печени / неалкогольного стеатогепатита и медикаментозного повреждения печени. Следует помнить, что многие медикаменты, применяющиеся для лечения кардиоваскулярной патологии, метаболизируются в печени и могут неблагоприятно воздействовать на нее (табл. 2).

Всем больным проводят эхокардиографию и ультразвуковое исследование с допплерографией сосудов печени, при котором хорошо выявляется венозный застой (расширенные печеночные вены, сливающиеся в расширенную нижнюю полую вену), как правило, при отсутствии портальной гипертензии (диаметр портальной вены <13 мм), а также отек стенки желчного пузыря (при развитии кардиального цирроза). Кроме того, допплерография сосудов печени позволяет исключить альтернативные диагнозы, такие как синдром Бадда-Киари.
В тяжелых диагностических случаях для верификации ЗГ проводят лапароскопию, при которой визуализируется увеличенная печень с закругленным краем и утолщенной капсулой, а поверхность печени имеет характерный вид «мускатного ореха» с наличием темно-красных и коричнево-желтых участков.
Рутинная биопсия печени не показана, в основном она проводится у кандидатов на трансплантацию сердца при наличии асцита для исключения ЦП. Гистологически ЗГ характеризуется венозным застоем в области синусоид, полнокровием центральных отделов дольки, расширением пространств Диссе, атрофией и некрозом центрилобулярной зоны. Характерным признаком ЗГ является отсутствие патологических изменений на периферии дольки, поскольку венозный застой не достигает этой зоны, а приток артериальной крови из печеночной артерии защищает гепатоциты от повреждения и приводит к их гипертрофии. Также характерной особенностью ЗГ является обратимость венозного полнокровия, а иногда и фиброза при условии адекватного лечения СН.
Краеугольным камнем лечения ЗГ является эффективное этиотропное и патогенетическое лечение сопутствующей кардиоваскулярной патологии и легочно-сердечной недостаточности, что сопровождается быстрой регрессией клинических и биохимических проявлений ЗГ, что было впервые описано Jolliffe и соавт. еще в начале 1930-х годов. При назначении ингибиторов АПФ, являющихся препаратами первой линии лечения СН, следует помнить, что они почти все (за исключением лизиноприла), подвергаются метаболизации в печени, а при наличии ЗГ и ПД могут иметь место замедленная трансформация пролекарства в активное вещество и инактивация активного препарата, что требует частого мониторирования дозировки. Это также касается и ингибиторов рецепторов ангиотензина II, за исключением валсартана и ирбесартана, а также большинства неселективных и селективных β-адреноблокаторов. Петлевые диуретики (фуросемид, торасемид) в большинстве случаев эффективно уменьшают венозный застой в печени, способствуя уменьшению и исчезновению асцита и желтухи. Тем не менее эти препараты при ЗГ надо применять с осторожностью во избежание дегидратации, гипотензии и ишемии печени, включая некроз 3-й зоны печеночной дольки. При необходимости применения дигоксина его также нужно назначать осторожно и в низкой дозе, поскольку у больных с ЗГ вероятность проявления его токсических эффектов усиливается.
Антикоагулянты также следует применять крайне осторожно, поскольку у больных с ЗГ повышено протромбиновое время и нередко отмечается повышенная чувствительность к варфарину. При необходимости назначения амиодарона, несмотря на то что он подвергается интенсивной печеночной метаболизации, снижение дозы, как правило, не требуется. Статины сами по себе могут вызывать гипертрансаминаземию, однако они противопоказаны только при повышении уровня АсАт и АлАт более чем в 3 раза.
В рефрактерных случаях применяют лапароцентез, однако следует помнить, что он сопровождается потерей белка и способен ухудшить нутритивный статус больных СН, который и без того нарушен. Проведение трансюгулярного внутрипеченочного шунтирования или перитонеально-сосудистого шунтирования у таких больных противопоказано, поскольку всегда приводит к утяжелению класса СН.
Пациенты, рефрактерные к медикаментозному лечению, являются кандидатами на трансплантацию сердца или имплантацию вспомогательного устройства в левый желудочек (ЛЖ).
Назначение гепатопротекторов больным ЗГ может быть целесообразным только при выраженном цитолитическом синдроме и развитии кардиального ЦП.
Сама по себе ЗГ крайне редко прогрессирует в классическую печеночную недостаточность и является непосредственной причиной смерти. В подавляющем большинстве случаев летальный исход наступает вследствие основной кардиоваскулярной патологии.
В ряде случаев у больных ЗГ может быть целесообразным назначение гепатопротекторов.
Гепатопротекторы, влияющие на структуру и функцию клеток гепатоцитов, являются основой патогенетической терапии при патологии печени. Действие гепатопротекторов направлено на восстановление гомеостаза в печени, повышение ее устойчивости к действию патогенных факторов, нормализацию функциональной активности и стимуляцию в печени процессов регенерации. На фармацевтическом рынке в настоящее время присутствует большое количество средств, представляемых как гепатопротекторы, и бытует мнение, что любое из них априори эффективно и безопасно. На самом деле клиническая эффективность многих известных и давно применяющихся гепатопротекторов не доказана. Более того, некоторые из них являются потенциально вредными и способны оказывать гепатотоксический эффект. Особенно это касается гепатопротекторов растительного происхождения и многочисленных широко рекламируемых пищевых добавок.
В отношении многих гепатопротекторов проведены лишь единичные рандомизированные клинические исследования (либо их нет вовсе), причем в этих исследованиях обнаружено отсутствие или слабое влияние таких препаратов на важные параметры (исчезновение виремии, гистологическая картина и выживаемость), несмотря на некоторое снижение активности ферментов печени и улучшение субъективных показателей. Доказанной в различной степени эффективностью обладают такие гепатопротекторы, как урсодезоксихолевая кислота (УДХК), эссенциальные фосфолипиды, препараты аминокислот (адеметионин, орнитина аспартат). Препараты силимарина следует рассматривать как гепатопротекторы с предполагаемой, но недоказанной эффективностью, которые могут применяться при определенных состояниях. Другие растительные гепатопротекторы пока нельзя рекомендовать для широкого применения при хронических заболеваниях печени, поскольку их эффективность не доказана и требует дальнейшего изучения в тщательно спланированных рандомизированных исследованиях.
В терапии заболеваний печени из препаратов, имеющих доказательную базу эффективности и безопасности, большое значение имеет УДХК – гидрофильная нетоксичная третичная желчная кислота, образующаяся под действием бактериальных ферментов из 7-кето-литохолевой кислоты, которая поступает в печень из тонкой кишки.
Механизмы действия УДХК многообразны и пока окончательно не изучены. Накопленные на сегодняшний день экспериментальные и клинические данные свидетельствуют о том, что УДХК оказывает гепатопротекторный, антихолестатический, иммуномодулирующий, гипохолестеринемический, литолитический и антиапоптический эффекты. УДХК применяют при острых и хронических гепатитах различной этиологии, неалкогольном стеатогепатите, первичном билиарном циррозе, гепатопатии беременных, заболеваниях печени, сопровождающихся или вызванных холестазом.
С учетом темы, которая рассматривается в этой статье, интересны данные, свидетельствующие о положительном влиянии УДХК на соотношение сывороточных маркеров фиброгенеза и фибролиза. Так, в исследовании Holoman (2000) на фоне применения УДХК снижалась сывороточная концентрация N-терминального пептида коллагена 3 типа и матриксных металлопротеиназ и одновременно повышался уровень их тканевых ингибиторов. Длительный прием УДХК в дозе 12-15 мг/кг/сут на протяжении 6-12 мес сопровождался достоверным улучшением гистологической картины и биохимических печеночных показателей.
Таким образом, решение о выборе гепатопротектора следует принимать, основываясь на тех же принципах, что и при подборе кардиологических препаратов, то есть на принципах доказательной медицины.
Кардиогенный ишемический гепатит
Кардиогенный ишемический гепатит (КАГ), или «шоковая печень», – гипоксическое повреждение печени, развивающееся при неадекватной ее перфузии и приводящее к некрозу гепатоцитов центрилобулярной зоны. Формирование КАГ возможно только при сочетании нескольких патологических факторов (значительная гипоперфузия, нарушение функционирования сосудистых коллатералей, неспособность печени увеличить потребление кислорода), поскольку особенности кровоснабжения печени изначально препятствуют развитию ее ишемического повреждения. Комбинация указанных факторов имеет место при острой СН, преимущественно правожелудочковой, индуцированной острым инфарктом миокарда, острыми нарушениями ритма, тромбоэмболией легочной артерии, острым легочным сердцем, а также при кровопотере, расслаивающей аневризме аорты, синдроме длительного сдавливания, септическом или ожоговом шоке, тепловом ударе, отравлении углекислым газом и др. Частота развития КАГ у реанимационных больных колеблется от 11 до 22%. В 70% случаев основной причиной КАГ является кардиоваскулярная патология, в 30% – острая дыхательная недостаточность, сепсис и другие более редкие состояния.
Диагноз КАГ базируется на трех основных критериях: 1) быстром развитии патологии печени на фоне типичных проявлений кардиогенного или циркуляторного шока; 2) значительном (>20 норм), но быстро обратимом повышении уровня сывороточных трансаминаз; 3) отсутствии других возможных причин повреждения печени. Клинически КАГ манифестирует появлением выраженной одышки, боли в правом подреберье, увеличением печени в размерах. В редких случаях могут отмечаться желтуха, олигурия, признаки печеночной энцефалопатии, вплоть до печеночной комы. Характерные изменения функциональных проб печени появляются через 12-24 ч после острого сердечно-сосудистого события и проявляются резким (в 20 раз и более) повышением уровней АсАт, АлАт и лактатдегидрогеназы, реже – гипербилирубинемией и коагулопатией (удлинение протромбинового времени, снижение уровня фибриногена, тромбоцитопения). При устранении действия провоцирующего фактора показатели возвращаются к норме в течение 5-10 дней.
Основной стратегией лечения КАГ является восстановление адекватной перфузии печени путем проведения противошоковых мероприятий, обязательного введения средств, обладающих положительным инотропным эффектом, таких как дофамин. При развитии печеночной энцефалопатии применяют L-аргинин, L-орнитин-L-аспартат, антибиотики. Прогноз при КАГ определяется кардиоваскулярным статусом пациента, поскольку смертность при этом заболевании обусловливается основным заболеванием.
Цирротическая кардиомиопатия
Под термином «цирротическая кардиомиопатия» (ЦК) принято понимать снижение сократительной функции сердца, которая отмечается у части больных с ЦП. Первоначальные исследования в начале 1950-х годов зафиксировали существование при циррозе гипердинамического типа гемодинамики, что проявляется в увеличении сердечного выброса и снижении системного сосудистого сопротивления. H.J. Kowalski первым сообщил, что пациенты с циррозом Лаэннека имели аномальную сердечно-сосудистую функцию и удлинение интервала QT. Ранние гистологические исследования продемонстрировали гипертрофию миокарда и его ультраструктурные изменения, включая отек кардиомиоцитов, фиброз, экссудацию, ядерную вакуолизацию и необычную пигментацию.
Размер левого предсердия и ЛЖ у пациентов с ЦП нормальный или несколько увеличен, что связано с гемодинамической дисфункцией. Многие пациенты с ЦП отмечают одышку, задержку жидкости и ограничение физической активности.
Основными механизмами развития ЦК являются хронический алкоголизм и гипердинамический тип гемодинамики. Вследствие злоупотребления алкоголем ухудшается синтез сократительных белков и формирование связи сердечных белков с токсичным ацетальдегидом, что способствует ухудшению сердечной функции. При гипердинамическом типе гемодинамики сердце постоянно перегружено из-за повышенных сердечного выброса и объема циркулирующей крови, что также приводит к нарушению его сократительной функции. Другими потенциальными механизмами ухудшения сердечной функции при ЦП являются повышенная продукция таких кардиодепрессивных субстанций, как эндотоксины, эндотелины, цитокины и желчные кислоты, а также нарушение регуляторной функции β-рецепторов, функционирования мембранных калиевых и кальциевых каналов, активация каннабиоидной системы.
Физические упражнения, фармакологический стресс и терапевтические мероприятия способны повлиять на изменение давления в полостях сердца. В частности, у больных ЦП конечно-диастолическое давление увеличивается, а ФВ во время физической нагрузки падает, что указывает на аномальный желудочковый ответ на повышение желудочкового давления наполнения. Аэробные физические нагрузки и максимальная частота сердечных сокращений у большинства пациентов с циррозом должны быть меньшими по сравнению с таковыми у пациентов без цирроза. Аномальная диастолическая функция ЛЖ, вызванная снижением его релаксации, отражается в нарушении наполнения желудочков. Трансмитральный кровоток изменяется, при этом повышается вклад предсердий в позднюю фазу наполнения ЛЖ. Патофизиологической основой диастолической дисфункции при ЦП является повышенная жесткость стенки миокарда, скорее всего, из-за сочетания небольшой гипертрофии миокарда, фиброза и субэндотелиального отека.
Основным электрокардиографическим изменением при ЦП является удлинение интервала QT, скорректированного по частоте сердечных сокращений, что отмечается примерно у каждого второго пациента с ЦП и не зависит от его этиологии. У больных алкогольным ЦП удлинение интервала QT связано с повышением риска внезапной сердечной смерти. Удлинение интервала QT при циррозе также ассоциируется с наличием кардиальной автономной дисфункции, в первую очередь со снижением барорецепторной чувствительности, и частично обратимо после трансплантации печени.
Специфического лечения ЛЖ-дисфункции, связанной с ЦП, в настоящее время не существует. Поэтому терапия проводится по общим правилам путем ограничения соли, приема диуретиков и снижения постнагрузки. Назначение сердечных гликозидов не способствует существенному улучшению сократительной функции сердца при ЦК, в связи с чем они не рассматриваются как значимые препараты для ее лечения. Следует проявлять особую осторожность во время и после стрессовых событий, в первую очередь хирургических операций, включая трансюгулярное внутрипеченочное шунтирование и трансплантацию печени. Влияние удлиненного интервала QT на смертность больных ЦП является предметом будущих исследований. Принципиально новые методы лечения ЦК, такие как антицитокиновая терапия, также представляют большой интерес.
В заключение отметим, что вопросы, обсуждаемые в данной статье, имеют важное клинические значение как для гастроэнтерологов, так и для кардиологов. В частности, гастроэнтерологи, консультирующие больных с «необъяснимым» повышением трансаминаз или так называемыми идиопатическими ЦП, всегда должны помнить о потенциальной роли СН, даже латентно протекающей, и назначать соответствующее кардиологическое обследование. В свою очередь, кардиологи, наблюдающие пациентов с СН, у которых имеется сопутствующая ПД, должны рассматривать последних как группу повышенного риска и лечить более агрессивно. Надеемся, что дальнейшие исследования и более активное выявление ПД при СН поможет улучшить общее понимание патологического процесса, а также результаты лечения и клинические исходы при этом заболевании.
Список литературы находится в редакции
Сердечная недостаточность (СН) в большинстве случаев связана с нарушением функции сердечной мышцы. При СН снижается уровень обеспечения организма метаболическими потребностями.
Сердечную недостаточность можно разделить на:
- Систолическую;
- Диастолическую.
Для систолической СН характерно нарушение сократительной способности сердца. А для диастолической характерен сбой релаксационной способности мышцы сердца и дисбаланс в наполняемости желудочков.
- Органические нарушения;
- Функциональные нарушения;
- Врожденные дефекты;
- Приобретенные заболевания и т. д.
Симптомы СН
Физически СН проявляется в снижении трудоспособности и переносимости физических нагрузок. Это демонстрируется появлением одышки при сердечной недостаточностии быстрой усталости. Все эти симптомы связаны с количественным уменьшением сердечного выброса или задержкой жидкости в организме.
Как правило, правожелудочковая СН характеризуется целым списком расстройств печени. Тяжелые застои в печени практически всегда протекают бессимптомно и выявляются только при лабораторных и клинических исследованиях. К основным патологиям развития печеночной дисфункции относится:
- Пассивный венозный застой (из-за увеличения давления вследствии наполнения);
- Нарушение циркуляции крови и снижение сердечного выброса.
Осложнения СН
При увеличении ЦВД (центрального венозного давления), как следствие, может вырасти уровень ферментов печени и прямого и непрямого сывороточного билирубина.
Ухудшение перфузии, полученное резким снижением сердечного выброса, способно закончится гепатоцеллюлярным некрозом с повышенным сывороточным аминотрансферазным показателем. “Шоковая печень” или кардиогенный ишемический гепатит, является результатом ярко выраженной гипотонии у больных страдающих СН.
Кардиальный цирроз или фиброз может стать итогом долготекущей гемодинамической дисфункции, что чревато функциональным расстройством печени, сопровождающимся коагуляционными проблемами, а так же, ухудшение усвояемости некоторых сердечно-сосудистых препаратов и сделать их нежелательно токсичными, снижению выработки альбумина.
Определить точную дозировку данных препартов, к сожалению, сложно.
Если рассмотреть данную проблему с позиции патофизиологии и гистологии, то мы увидим, что, проблемы с печенью, связанные с венозным застоем, характерны для пациентов с правосторонним типом СН, смежным с повышенным давлением в правом желудочке. и не важно, чем вызвана правосторонняя СН. Любой случай может стать отправной точкой печеночного застоя.
Факторы возникновения застоя в печени
К таким причинам можно отнести:
- Констриктивный перикардит;
- Легочная гипертензия тяжелой степени;
- Стеноз митрального клапана;
- Недостаточность трехстворчатого клапана;
- Легочное сердце;
- Кардиомиопатия;
- Последствия операции Фонтена, при легочной атрезии и синдроме гипоплазии левых сердечных отделов;
- Трикуспидальная регургитация (в 100% случаев). Возникает из-за правожелудочкового давления на вены и синусойды печени.
При приближенном изучении структуры застойной печени наблюдается ее общее увеличение. Окрас такой печени приобретает фиолетовый или красноватый оттенок. При этом она снабжена полнокровными печеночными венами. На разрезе четко видны зоны некроза и кровоизлияний в 3-ей зоне и неповрежденных или изредка стеатозных участков в 1 и 2 зонах.
Микроскопическое исследование венозной печеночной гипертензии показывает нам полнокровные центральные вены с синусойдным застоем и гемморагиями. Безразличие и бездействие в данном вопросе приводит к кардиальному фиброзу и циррозу печени по кардиальному типу.
Глубокая системная гипотензия при инфаркте миокарда, усугубление СН и легочная эмболия часто становятся вескими причинами для развития острого ишемического гепатита. Такие состояния как: синдром обструктивного апноэ во время сна, дыхательная недостаточность, повышенная метаболическая потребность являются сигналом ишемического гепатита.
Гепатит и СН
 Применение термина “гепатит” в данном случае, не совсем корректно, так как воспалительных состояний, которые дает инфекционный гепатит
, мы не наблюдаем.
Применение термина “гепатит” в данном случае, не совсем корректно, так как воспалительных состояний, которые дает инфекционный гепатит
, мы не наблюдаем.
развитие хронической гипоксии в печени сопровождается специфическими защитными процессами. Этот процесс характеризуется увеличением добычи кислорода клетками печени из мимо (через печень) протекающей крови. Но есть условия при которых данный защитный механизм не действует. Это сохраняющаяся неадекватная перфузия органов мишеней, тканевая гипоксия и острая гипоксия. В случае повреждения гепатоцитов происходит резкое повышение: АЛТ, АСТ, ЛДГ, протромбинового времени в сыворотке крови. Так же возможно наступление функциональной почечной недостаточности.
Временное развитие кардиогенного ишемического гепатита варьируется от 1-го дня до 3-ёх. Нормализация же заболевания наступает начиная с пятого по десятый день с момента первого эпизода заболевания.
 Клинические проявления у пациентов с левосторонней СН представлены:
Клинические проявления у пациентов с левосторонней СН представлены:
- Одышкой;
- Ортопноэ;
- Пароксизмальными ночными одышками;
- Кашлем;
- Быстрым наступлением усталости.
Для правосторонней СН характерны:
- Переферические отеки;
- Асцит;
- Гепатомегалия;
- Тупые растягивающие боли в верхнем правом квадранте живота (редко).
Гепатомегалия присуща правосторонней хронической СН. Но случается, что гепатомегалия развивается и при острой СН.
Для асцита отводится только 25% часть от общего числа болеющих. Что касается желтухи, то она, в основном, отсутствует. Бывает пресистолическая пульсация печени
Протекает ишемический гепатит, в процентном большинстве случаев, доброкачественно.
Диагностика
Диагностируется непреднамеренно при выявлении ферментативного повышения после системной гипотензии. Но системная гипотензия приводит не только к повышению ферментов печени. Так же после подобных эпизодов увеличивается креатенин, может появиться тошнота, рвота, нарушение пищевого поведения, болевые симптомы в правом верхнем абдоминальном квадранте, олигурия, желтуха, тремор, печеночная энцефалопатия.
МОРФОЛОГИЯ, ПАТОЛОГИЯ
УДК 616.342-008.1
ПАТОГЕНЕЗ ИШЕМИИ-РЕПЕРФУЗИИ ПЕЧЕНИ
(обзор литературы)
И.Ф. Ярошенко, Т.Ю. Каланчина
Кафедра патологической физиологии ВолГМУ
Для радикального лечения тяжелых поражений печени в мировой практике все шире используются трансплантация печени , частичная резекция печени . При хирургических операциях возможно временное пережатие гепатодуоденальной связки с проходящими в ней кровеносными сосудами . Во всех этих случаях происходит ишемизация печени той или иной длительности. Нарушение кровоснабжения печени происходит также при шоках различной этиологии, в том числе геморрагическом, ожоговом и др. . Через различные интервалы времени кровоснабжение печени восстанавливается за счет реперфузии. Однако ишемия-реперфузия (ИР) приводит к тяжелым осложнениям: отторжению трансплантата, воспалительным процессам и даже некротическому поражению гепатоцитов, решая в конечном итоге судьбу пораженного органа.
Ишемия печени и последующая реперфузия моделировались у различных животных (крыс, кроликов, свиней) и изучались у человека в процессе хирургического вмешательства. Способы и продолжительность ишемии и реперфузии были различными. Так, V.V. Zinchuk et al. (2003) у кроликов перевязывали в течение 30 мин печеночную артерию, при этом реперфузионный период продолжался 120 мин; P. Liu et al. (2000) ишемизировали левую и среднюю доли печени в течение 30 мин с последующей реперфузией в течение 4 ч; A. Morisue et al.
(2003) у крыс породы Вистар вызывали ишемию печени в течение 30 мин с последующей реперфузией; M.Y. Seo и S.M. Lee (2002) у крыс моделировали ишемию в течение 60 мин и реперфузию в течение 5 ч; H. Yuzawa et al. (2005) пережимали печеночную артерию и портальную вену свиньи на 45 мин с последующей реперфузией; R.S. Koti et al. (2005) подвергали крыс 45 мин лобарной ишемии печени с последующей 2-часовой реперфузией; J.C. Yang et al.
(2004) вызывали у крыс в течение 30 мин окклюзию печеночной артерии с последующей 2- и 6-часовой реперфузией; M. Ohmori et al. (2005) проводили окклюзию печеночной артерии и портальной вены в течение 60 мин с последующей реперфузией; A. Hirakawa et al. (2003) вызывали 30 и 120 мин ишемию
печени с последующей 6-часовой реперфузией; С. Хю^ й а1. (2000) пережимали афферентные сосуды печени крысы на 20, 40, 60, 90 мин. Восстановление кровотока происходило после удаления клеммы; Я.8. Кой й а1. (2005) подвергали крыс 45-минутной долевой ишемии печени с последующей 2-часовой реперфузией; О. Erdogan е! а1. (2001) применяли 30- и 45-минутную ишемию печени у крыс с последующей 60-минутной реперфузией; Я. ЬаШеп е! а1. (2003) проводили окклюзию портальной вены и печеночной артерии в течение 30 мин с последующей реперфузией; Б. 01акошШ18 е! а1. (2003) воспроизводили 60-минутную тотальную ишемию печени и 120 минутную реперфузию.
К. Yamagami е! а1. (2002) изучали механизмы нарушения при ИР, используя тепловую ишемию. Все крысы подвергались воздействию 42 °С в течение 30 мин с последующей реперфузией. А. Khandoga е! а1. (2003) изучали нарушения при тепловой ИР у мышей.
При пережатии афферентных сосудов печени на 20, 40, 60, 90 мин восстановление кровотока происходило после удаления зажима. При этом в синусоидальных эндотелиальных клетках происходили ультраструктурные изменения. После 20 или 40 мин ишемии увеличивалась фенестрация эндотелиальных клеток, которые становились ячеистоподобными. Однако реперфузия через 120 мин приводила к восстановлению структуры клеток. После 60 или 90 мин ишемии эндотелиальные клетки разрушались, и перикарион имел тенденцию к десквамации. Ре-перфузия через 120 мин не приводила к восстановлению клеток, а вызывала усиление поражения и необратимые изменения. Печеночные синусоиды были заполнены большим количеством кровяных клеток и пузырьков, происходящих из гепатоцитов. Отмечался отек митохондрий, гепатоцеллюлярные пузырьки . Наблюдались выраженные циркуляторные нарушения .
Следствием поражения гепатоцитов является нарушение функции митохондрий. Такие исследования были проведены при изучении тепловой ишемии у крыс. Тепловая ишемия воспроизводилась под об-
щей анестезиеи животных при погружении их в водяную баню с температурой 42 °С на 15 мин с последующей реперфузией в течение 60 мин. Авторы регистрировали нарушение целостности мембран митохондрий и потерю их способности продуцировать энергию.
Маркерами поражения печени при ИР являются освобождающиеся в кровь при разрушении гепато-цитов аланин трансаминаза, аспартат трансаминаза, гиалуроновая кислота, глютатион S-трансфераза , у-глютамил транспептидаза, псевдохолинесте-раза, а-глютатион-8-трансфераза, редуцирующий и оксигенирующий глютатион, прокальцитонин, ИЛ-6.
Патогенез поражения при ИР печени является мультифакторным процессом . Он включает: 1) нарушение гомеостаза кальция; 2) генерацию реактивных кислородных и нитрогенных субстанций; 3) нарушения микроциркуляции; 4) активацию купфе-ровских клеток .
Поражение печени при ИР состоит из двух фаз: внутриклеточной и внеклеточной. Са2-зависимые реакции играют важную роль в качестве пускового фактора в первой фазе, в то время как в поздней фазе преобладающую роль играет генерация биологически активных веществ .
В течение раннего периода реперфузии увеличивается содержание свободных радикалов кислорода и цитокинов, генерация которых происходит в куп-феровских клетках . Генерация супероксидного анион-радикала происходит через 6 и 24 ч после реперфузии . Это приводит к экспрессии индуцибельных форм синтазы оксид азота через активацию ядерной транскрипции фактора kappa B в гепатоцитах и купферовских клетках. Реактивные кислородные субстанции при ИР печени генерируются при участии ксантин оксидазы. Свободные кислородные радикалы удаляются антиоксидантными ферментами, такими как супероксиддисмутаза (СОД), каталаза, глютатион пероксидаза. Доказано, что увеличение свободных радикалов в печени приводит к повышению содержания в крови аланин ами-нотрансферазы, аспартат аминотрансферазы, малоновый диальдегид (МДА), увеличению воспалительных инфильтратов в синусоидах, ядерной фрагментации, сморщиванию клеток и массы хроматина с образованием апоптозных тел в апоптозных клетках . Показано, что нарушение защиты печени против оксидативного стресса связано с потерей глютатион-синтезирующей способности печени. Через 4 и 6 ч от начала реперфузии увеличивается продукция оксид азота.
В процесс повреждения клеток при ИР печени вовлечено большое количество цитокинов. Цитоки-ны при ИР печени продуцируют купферовские клетки. Они же продуцируют хемокины, т. е. цитокины с хемоаттрактантными свойствами, важные для таки-сиа нейтрофилов и частичного поражения гепатоци-тов . Продукция ИЛ-бета купферовскими клетками увеличивается через 6, 48-72 ч после реперфузии . Большую роль в привлечении и активации нейтрофилов при ИР печени играет протеин-1, яв-
ляющийся хемоаттрактантом для моноцитов . Среди цитокинов важную роль в поражении печени играет ИЛ-12. Доказана критическая роль тумор нек-ротизирующего фактора (TNF-a) в развитии патологического процесса при ИР печени. Его действие связано с активацией нейтрофилов, а также с увеличением микротромбообразования в сосудах печени . Продукция TNF увеличивается в течение 6-24 ч после ишемии печени . При ишемии с последующей реперфузией в артериальной и венозной крови обнаружено увеличение ИЛ-6. Важным регулятором воспалительного ответа печени при ИР является провоспалительный цитокин - Peroxime proliferator, который активирует a-рецепторы . В то же время степень поражения гепатоцитов уменьшает ИЛ-18 и ИЛ-13, цитокин, который вызывает супрессию продукции провоспалительных медиаторов макрофагами. В экспериментах на мышах было показано, что после 90 мин ишемии с последующей реперфузией печени ИЛ-13 уменьшал экспрессию TNF-a, продукцию воспалительного протеина-2, ведущему к транспорту нейтрофилов в печень, гепато-целлюлярный отек и повреждение гепатоцитов . В патогенезе ИР поражения печени участвуют коло-ниестимулирующий фактор и макрофагальный коло-ниестимулирующий фактор. При этом цитокины и гиалуроновая кислота могут быть индикаторами ранней фазы поражения печени при гепатоэктомии у человека. Цитопротективным эффектом обладает цитокин - фактор роста гепатоцитов. Он предупреждает лейкоцитарную инфильтрацию и активирует пролиферацию гепатоцитов.
Нарушение микроциркуляции является главной мишенью в поражении печени при ИР. Следствием нарушения микроциркуляции является патология паренхимы печени, недостаток микроциркуляторной перфузии, приводящий к no-reflow и связанный с ре-перфузией воспалительный ответ, который включает активацию и дисфункцию лейкоцитов и купферов-ских клеток (парадокс реперфузии). No-reflow в синусоидах обусловлен отеком эндотелиальных клеток и внутрисосудистой гемоконцентрацией, а также ухудшением баланса между эндотелином и NO. Парадокс реперфузии связан 1) с освобождением и действием провоспалительных цитокинов (TNF-a, ИЛ-1) и кислородными радикалами; 2) увеличением регуляции эндотелиальных и лейкоцитарных молекул адгезии (селектина, ß-интегрина, ICAM-1); 3) взаимодействием лейкоцитов с эндотелием в микрососудах печени. Безусловно, нарушение микроциркуляции связано со сдвигом в гемокоагуляции .
Как уже указывалось, важную роль в микроцир-куляторных нарушениях при ИР печени играет эндо-телин. Роль эндотелина в этом процессе была выяснена при помощи неселективной блокады рецепторов для эндотелина - бозентаном. Блокада системы эндотелина в течение ИР оценивалась различными методами. При этом было показано, что освобождение эндотелина приводит к микроциркуляторным нарушениям и локальной гипоксии, и, таким образом, к поражению печени. Блокада рецепторов эндо-
телина предохраняет печеночную микроциркуляцию, увеличивает снабжение клеток кислородом и редуцирует гепатоцеллюлярное поражение . В агрегации тромбоцитов при ИР участвует тромбок-сан А2, который был обнаружен К. Напа7аИ е! а1. (2000).
Предполагается, что N0 обладает цитопротек-тивным влиянием на микроциркуляцию. В экспериментах на крысах с применением ингибитора N0 синтазы и контрольным тестом - сывороточной трансаминазы - это свойство N0 было подтверждено .
В нарушениях микроциркуляции при ИР большую роль играют тромбоциты. А. Khandoga е! а1. (2003) провели прижизненное исследование при помощи флуоресцентной микроскопии взаимодействия тромбоцитов с эндотелиальными клетками через 20240 мин реперфузии после ишемии печени. При этом были обнаружены роллинг и адгезия тромбоцитов в терминальных артериолах и постсинусоидальных венулах. При этом аккумуляция тромбоцитов в синусоидах наступала уже через 20 мин после реперфу-зии. При пролонгировании ишемии с 30 до 60 и 90 мин число тромбоцитов, взаимодействующих с эндотелием, существенно увеличивалось. Постишемическая адгезия тромбоцитов была связана с увеличением тромбиновой активности и выходом тромбоцитов из системной циркуляции. Кроме того, адгезия тромбоцитов линейно коррелировала с ухудшением перфузии синусов. Пролонгированная реперфузия до 4 ч не увеличивала взаимодействие тромбоцитов и эндотелия. Таким образом, эндотелиальные клетки в арте-риолах, венулах и синусоидах взаимодействуют с тромбоцитами уже в раннем периоде реперфузии. Протяженность их взаимодействия зависит от длительности ишемии, но не от времени реперфузии.
Большую роль в поражении печени при ИР играет активация купферовских клеток с последующим освобождением провоспалительных медиаторов, включая Т№-а. Эти медиаторы стимулируют каскад событий, включающих увеличение хемокинов и молекул адгезии к сосудистому эндотелию, ведущие к транспорту в печень нейтрофилов и поражение тканей . Генерация супероксидного анион-радикала в купферовских клетках была нерегулируемой через 6-24 ч после реперфузии. Продукция Т№-а увеличивалась в обеих долях после реперфузии. ИЛ-Р увеличивался в более поздние сроки реперфузии .
Активация полиморфоядерных лейкоцитов играет критическую роль в поражении печени при ИР . Транспорт нейтрофилов в купферовские клетки печени происходит с участием Р-селектина. В последующем наблюдается активация нейтрофилов, следствием чего является дисфункция РЭС. Активированные нейтрофилы инфильтрируют пораженную печень с параллельным увеличением экспрессии адгезивных молекул на эндотелиальных клетках. Система гем-оксигеназа является наиболее важным цито-протективным механизмом, активирующимся при
клеточном стрессе и включая антиоксидантные и противовоспалительные функции, регулируя клеточный цикл и поддерживая микроциркуляцию. Большую роль в полиморфоядерной инфильтрации печени играет селектин, который также способствует адгезии тромбоцитов к сосудистой стенке . Ней-трофилы повреждают гепатоциты с помощью ферментов, в частности большую роль играет эласта-за нейтрофилов. Применение ингибитора эластазы сглаживает поражение печени.
Регуляция нейтрофил-зависимого поражения гепатоцитов при ИР печени происходит под влиянием CD4+ лимфоцитов. При ИР печени СБ4+лимфоциты быстро поступают в печень и через ИЛ17 способствуют транспорту нейтрофилов .
В развитии воспалительного процесса в гепатоци-тах при ИР печени важную роль играет активация гена NF-kappa B, локализованного в ДНК. В настоящее время выяснено, что в его регуляции основное значение имеют протеин 1 kappa B alpha и протеин 1 kappa B beta, локализованные в ДНК . В ранние сроки ИР происходит быстрая активация генов р38, р44/42, стресс активирующей протеин киназы и с-Jun N - терминальная киназа митогенактивирую-щей протеин киназы, увеличивается сигнал транс-дукции и активатор транскрипции-3, происходит ядерная транслокация активатора протеина-1, активация рецептора для увеличения конечного продукта гликогенолиза, что является ключевым сигнальным путем, связывающим воспалительный процесс и гибель клетки .
Гибель гепатоцитов при ИР печени происходит либо в результате некроза, либо апоптоза. На модели изолированной перфузируемой печени установлено, что после тепловой реперфузии (10 мин) наблюдался некроз гепатоцитов. Он оставался стабильным до 120 мин. Через 30 мин резко усиливался апоптоз. Только через 42 ч развивался некроз гепатоцитов в зоне переполненных кровью синусоидов .
Поскольку многие стороны патогенеза поражений при ИР печени выяснены, в настоящее время внимание исследователей направлено на поиски путей профилактики нарушений, следующих за ише-мией-реперфузией печени.
Одним из таких методов является проведение своеобразной ишемической подготовки к предстоящей ИР печени. Суть ее сводится к тому, что накануне предстоящей ИР печени проводится кратковременная ишемия со столь же кратковременной репер-фузией. Так, в работе W.Y. Lee et al. (2005) печень крысы подвергалась ишемии на 10 мин и на 10 мин -реперфузии. Немедленно, вслед за этим воспроизводилась длительная, на 90 мин ишемия печени с последующей 5-часовой реперфузией. При этом было показано, что ишемическая подготовка уменьшала активность аминотрансферазы в крови, аланин ами-нотрансферазы, а-глютатион-8-трансферазы, агрегацию тромбоцитов, содержание циклического адено-зин-5 монофосфата . Липидную пероксидацию в митохондриях значительно редуцирует и оксида-
БЮЛЛЕТЕНЬ ВОЛГОГРАДСКОГО НАУЧНОГО ЦЕНТРА РАМН
тивный стресс. В исследованиях A. Barrier et al. (2005) такая же подготовка к ИР печени приводила к увеличению количества антиапоптозного протеина Bcl-2 и увеличению индуцибельной синтазы оксид азота. M. Glanman et al. (2003) показали, что подготовка снижала активацию купферовских клеток и синусоидальных перфузионных поражений, при этом сохранялись адекватные окислительно-
восстановительные процессы в митохондриях. По данным C. Peralta et al. (2003), механизмы, ответственные за эндогенный протективный эффект при подготовке печени к ИР, включают: 1) транзитор-ную продукцию NO в течение подготовки; 2) уменьшение токсических веществ, образованных при перфузии; 3) отдаленное влияние на экстрагепатиче-ские органы, такие как легкие; 4) сохранение энергетического метаболизма в течение ишемии; 5) уменьшением ядерного фактора транскрипции. В процессе подготовки печени к ИР профилактируется повреждение клеточных протеинов и ДНК . Подготовка блокирует ксантин-оксидазный путь для генерации реактивных кислородных субстанций . После подготовки увеличивается транскрипция и экспрессия NOS2, что оказывает протективный эффект . A. Chouker et al. (2005) показали, что подготовка смягчает в портальной вене концентрацию пуринов при тепловой ИР печени у человека. По данным R.S. Koti (2005), протективный эффект при подготовке печени к ИР был связан с увеличением L-аргинина. Таким образом, не подлежит сомнению, что подготовка печени к ИР значительно уменьшает поражение гепатоцитов при длительной ИР печени.
Другим направлением в исследованиях по профилактике поражения гепатоцитов при ИР печени была попытка использования химических соединений, влияющих на различные стороны патогенеза, лежащих в основе патологического процесса.
Исходя из основного звена патогенеза образование свободных кислородных радикалов патогенетическим методом лечения является антиоксидантная терапия . Аскорбиновая кислота как антиокси-дант может применяться для профилактики поражений гепатоцитов при ИР печени.
Другим направлением в коррекции нарушений функций печени при ИР является применение антагонистов рецепторов для повреждающих цитокинов. Так, с помощью антагониста рецепторов эндотелина А при ИР печени уменьшали содержание эндотелина и взаимодействие тромбоцитов с эндотелием . В экспериментах S. Zeng et al. (2004) показали, что при блокаде рецептора для увеличения конечного продукта гликолиза остается увеличенной активация ядерного фактора kappa B, однако увеличивается транскрипция прорегнеративного цитокина TNF-a. Авторы предположили, что блокада этого пути может представлять новую стратегию для уменьшения поражения печени и улучшения регенерации. Применение агониста рецептора A2A перед ишемией может смягчать постишемический апоптоз в клетках печени и таким образом минимизировать поражение
печени, что связано с уменьшением активности caspase-3 . B. Cavalieri et al. (2005) предложили новый неконкурентный аллостерический блокатор рецепторов ИЛ-8-repertaxin, который путем связывания CXCRI / R2 в неактивной структуре предупреждает сигнал с рецептора и хемотаксис полиморфоя-дерных лейкоцитов. Показано, что CD 13 ингибирует купферовские клетки и предохраняет печень от поражений при ИР механизмами, редуцирующими ли-пидную пероксидацию .
В экспериментах было показано, что ингибиторы ферментов цитокинов способны коррелировать нарушения функции печени при ИР. В частности, про-тективный эффект при ИР оказывает ингибитор тромбоксан синтазы печени - FK506 . Ингибитор селективного циклооксигеназы-фермента, участвующего в превращении простагландинов в тром-боксан А2, существенно смягчает микроциркулятор-ные и гепатоцеллюлярные повреждения при ИР печени . Y.I. Kim et al. (2002) для профилактики поражения печени при ИР применили ингибитор протеазы. Апоптоз при ИР может ингибироваться специфическим ингибитором caspases и профилак-тировать поражение печени .
Ряд гормонов может быть использован для лечения поражений при ИР печени. Так, простагландин Е1 является цитопротектором, он уменьшает содержание тромбоксана А2 при ИР печени, нормализует содержание NO и препятствует образованию супероксид анион радикала . D. Giakoustidis et al. (2002) с успехом применили высокие дозы а-токоферола, смягчающие поражение гепатоцитов при ИР.
Антикоагулянты и фибринолитики способны уменьшать поражение при ИР печени. Так, анитром-бин увеличивает освобождение простациклина из эндотелиальных клеток и редуцирует поражение гепатоцитов при ИР . Гепарин улучшает функцию печени при ее ИР, влияя на нарушения микроциркуляции в синусоидах печени и частично через инги-бирование эндотелина-1. Активатор плазминогена оказывает положительное влияние при ИР печени на степень поражения гепатоцитов .
Ряд цитокинов положительно влияет на поражение печени при ИР. Обнаружено, что некоторые ци-токины смягчают поражение гепатоцитов при ИР печени. Так, фактор роста гепатоцитов вызывает депрессию оксидативного стресса и ингибирование молекулы ICAM-1, способствуя тем самым уменьшению тяжести поражения при ИР . Y.J. Lee и Y.K. Song (2002) применили ИЛ-10 в сочетании с galectin-3 для профилактики поражения клеток при ИР.
Иммунодепрессант - циклоспорин улучшает состояние гепатоцитов при тепловой ИР печени.
Было обнаружено, что изобилие внутриклеточного гликогена может редуцировать ИР печени. В связи с чем авторы полагают, что перед комплексом операций на печени больным полезно давать большое количество глюкозы . L.N. Lin (2004) показали, что
пропофол профилактировал поражение печени при ИР путем редуцирования уровня свободных радикалов и ингибирования липидной пероксидации у пациентов после операции по поводу рака печени. B.H. Heijnen et al. (2003) и A. Khandoga et al. (2003) для профилактики поражения при ИР с успехом применили гипотермию до 10-15° соответственно. Применение оксибарической оксигенации редуцирует адгезию нейтрорфилов в венулах, а также блокирует ва-зоконстрикцию артериол и тем самым уменьшает дисфункцию печени .
При холодовой ИР печени и при трансплантации печени у крыс с успехом был применен били-вердин .
Некоторые аминокислоты могут оказывать про-тективный эффект при ИР печени. В частности, B. Nilsson et al. (2000) с этой целью применили адено-зин. Определенные дозы этанола оказывают положительное влияние на гепатоциты при ИР. Пируват играет лимитирующую роль в поражении гепатоцитов при ИР. Глицин может эффективно предохранять отторжение печени у крыс после ИР путем подавления экспрессии CD1 4b NF - kappa B, связывать активность купферовских клеток и ингибировать активность TNF-а и ИЛ-1 . Меланотонин редуцирует митохондриальный оксидативный стресс и улучшает метаболизм печени при ИР . L-аргинин и L-какнаванин - ингибиторы синтазы NO - улучшают функцию печени после ИР . При этом L-аргинин увеличивает NO, редуцирует МДА и корректирует TXA (2) / PGI (2) . L-аргинин также уменьшает аггре-гацию тромбоцитов .
Для профилактики поражения при ИР некоторые авторы используют генную терапию.
Так, A.J. Coito et al. (2002) с успехом применили гем-оксигеназу - цитопротекторный протеин - методом трансплантации аденовирусного гена гем-оксигенеазы-1. Jaeschke H. (2002) для лечения поражений при ИР предложил антиоксидантную генную терапию.
H. Jiang et al. (2005) и F.Q. Meng et al. (2005) применили препарат "oxymatrine" при ИР печени. При этом они обнаружили, что препарат ингибирует клеточный апоптоз, что связано с нарушением регуляции fas и fas-лиганд полиморфоядерных лейкоцитов. Repertaxin предупреждает постишемический гепато-целлюлярный некроз у крыс (80 %) и инфильтрацию полиморфоядерных лейкоцитов (96 %) в течение 254 ч реперфузии. Sener G. et al. (2005) для лечения последствий ИР печени применили 2-mercaptoethan sulfonate.
В литературе имеются единичные работы о поражении других органов при ИР печени. Так, H.M. Wang et al. (2005) сообщили о поражении легких при ИР печени, а J.C. Yang et al. (2004) определили увеличение содержания МДА, АЛТ, АСТ и снижение активности СОД и АТФ-азы в легких, печени, почках, поджелудочной железе и сердце. По данным X.L. Wang et al. (2003), протеаза оказывает протективный эффект при остром поражении легких после ИР пе-
В доступной нам литературе мы не встретили данных об участии лимфатической системы в процессах поражения печени при ИР, за исключением упоминания о снижении лимфотока в одной работе. В то же время, учитывая важную роль лимфатической системы в транспорте продуктов деструкции тканей и избыточного количества интерстициальной жидкости - факторов, поддерживающих воспалительный процесс, выяснение этого вопроса является совершенно необходимым. Еще более важным является тот факт, что лимфатическая система участвует в распространении патологического процесса от очага повреждения через органную лимфу, грудной лимфатический проток, правое сердце в легкие. Следствием этого, несомненно, является возникновение патологического процесса в легких, а, возможно, и в других органах.
ЛИТЕРАТУРА
1. Ben-Ari Z., Pappo O., Sulkes J., et. al. // Apoptosis. -2005.-Vol. 10, № 5.-P. 955-962.
2. Caldwell C.C., Okaya T., Martignoni A., et al. // Am. J. Physiol.Gastrointest Liver Physiol. - 2005. - Vol. 289, № 5.-P. 969-976.
3. Cavalieri B., Mosca M., Ramadori P., et al. // Int. J. Immunopathol. - 2005. - Vol. 18, № 3. -P. 475-486.
4. Chang E.J., Lee S.H., Mun K.C., et al. // Transplant. Proc.-2004.-Vol. 36, № 7.-P. 1959-1961.
5. Cursio R., Gugenheim J., Ricci J.E. // Transplant int. -2000.-Vol. 13. - Suppl. 1.-P. S568-572.
6. Fan C, Li Q, Zhang Y, et al. // J. Clin. Invest. - 2004. -Vol. 113, № 5.-P. 746-755.
7. Fondevila C., Busuttil R. W., Kupiec-Weglinski J. W. // Exp. Mol. Pathol. - 2003. - Vol. 74, № 2. - P. 86-93.
8. Giakoustidis D.E., Iliadis S., Tsatilas D., et al. // Hepatogastroenterology. - 2003. - Vol. 50, № 53. - P. 15871592.
9. Glantzounis G.K., Salacinski H.J., Yang W., et al. // Liver transpl.-2005.-Vol. 11, № 9.-P. 1031-1047.
10. Harada N., Okajima K., Kushioto S., et al. // Blood. -1999.-Vol. 93, № 1.-P. 157-164.
11. Hossain M.A., Izuishi K., Maena H. // Word J. Surg. -2003.-Vol. 27, № 10.-P. 1155-1160.
12. Huet P.M., Nagaoka M.R., Desbiens G., et al. // Hepatology. - 2004. - Vol. 39, № 4. - P. 1110-1119.
13. Inoue K., Sugawara Y., Kubota K., et al. // J. Hepatol.-2000.-Vol. 33, № 3.-P. 407-414.
14. Ito Y., Katagiri H., Ishii K., et al. // Eur. Surg. Res. -2003. - Vol. 35, № 5. - P. 408-416.
15. Jaeschke H. // J. Invest Surg. - 2003. - Vol. 16, № 3. - P. 127-140.
16. Khandoga A., Biberthaler P., Messmer K, et al. // Microvasc. Res. - 2003. - Vol. 65, № 2. - P. 71-77.
17. Kihara K., Ueno S., Sacoda M., et al. // Liver Transpl. -2005.-Vol. 11, № 12.-P. 1574-1580.
18. Koti R.S., Tsui J., Lobos E., et al. // Faseb J. - 2005. -Vol. 19, № 9.-P. 1155-1157.
19. Lanteri R., Greco R., Licitra E., et al. // Microsdurgery. - 2003. - Vol. 23, № 5. - P. 458-460.
20. Lentsch A.B. // Hepatology. - 2005. - Vol. 42, № 1. -P. 216-218.
21. Lin L.N., Wang W.T., Wu J.Z., et al. // Zhongguo Wei Zhong Bing Ji Jiu Yi Xui. - 2004. - Vol. 16, № 1. - P. 42-44
БЮЛЛЕТЕНЬ ВОЛГОГРАДСКОГО НАУЧНОГО ЦЕНТРА РАМН
22. Lu Z.S., Zhan Y.Q., YangX.P. // Hunan Yi Ke Da Xue Xue Bao. - 2003. - Vol. 28, № 6. - P. 563-566.
23. Meng F.Q., Jiang H.C., Sun X.Y., et al. // Zhonhua Yi Xue Za Zhi. - 2005. - Vol. 85, № 28. - P. 1991-1994.
24. Morisue A., Wakabayashi G., Shimazu M., et al. // J. Surg. Res. - 2003. - Vol. 109, № 2. - P. 101-109.
25. Moench C., Uring A., Lohse A.W., et al. // Transplant. Res. -2003. - Vol. 35, № 4. - P. 1452-1455.
26. Mosher B., DeanR., Harkema J., et al. // J. Surg. Res. -2001.-Vol. 99, № 2.-P. 201-210.
27. Nadig S.N., Periyasamy B., Shafizadeh S.F., et al. // J. Gasrointest Surg. - 2004. - Vol. 8, № 6. - P. 695-700.
28. Nakamitsu A., Hiyama E., Imamura Y., et al. // Surg. Today.-2001.-Vol. 31, № 2.-P. 140-148.
29. Oe S., Hiros T, FujiiH., et al. // J. Hepatol. - 2002. -Vol. 34, № 6.-P. 832-839.
30. Ohmori M., Araki N., Harada K., et al. // Am. J. Hypertens. -2005. - Vol. 18, № 10. - P. 1335-1339.
31. Okajima K., Harada N., Kushimoto S., et al. // Thromb. haemost. -2002. - Vol. 88, № 3. - P. 473-480.
32. Okatani Y., Wakatsuki A., Reiter R.J., et al. // 2003. -Vol. 469, № 1-3.-P. 145-152.
33. Okaya T., Lentsch A.B. // Am. J. Physiol. Gastrointest Liver Physiol. - 2004. - Vol. 286, № 4. - P. 606-612.
34. Peng Y., Liu Z.J., Gong J.P., et al. // Zhonghua Wai Ke Za Zhi. - 2005. - Vol. 43, № 5. - P. 274-276.
35. Peralta C., Bulbena O., Xaus C., et al. // Transplantation. -2002. - Vol. 73, № 8. - P. 1203-1211.
36. Romanque U.P., Uribe M.M., Videla L.A. // Rev. Med. Chil. -2005. - Vol. 133, № 4.-P. 469-476.
37. Sakon M., Ariyoshi H., Umeshita K., et al. // Surg. Today. -2002. - Vol. 32, № 1. - P. 1-12.
38. Sasaki K., Miyalke H., Kinoshita T., et al. // J. Med. Invest. -2004. - Vol. 51, № 1-2. - P. 76-83.
39. Smyrniotis V., Arkadopoulos N. Kostopanagiotou G. // J. Surg. Res. - 2005. - Vol. 129, № 1. - P. 31-37.
40. Takeuchi D., Yoshidome H., Kato A., et al. // Hepatology. - 2004. - Vol. 39, № 3. - P. 699-710.
41. Tang L.J., Tian F.Z., Gao X.M. // Hepatobiliary Pancreat Dis Int. - 2002. - Vol. 1, № 4. - P. 532-535.
42. Tech N, Field J., Sutton J., et al. // Hepatology. - 2004. -Vol. 39, № 2-P. 412-421.
43. Turecky L. // Bratisl. Lek. Listy. - 1999. - Vol. 100, № 1. -P. 36-40.
44. Uhlman D., Glasser S., Laue H., et al. // J. Cardiovasc. Pharmacol. - 2005. - Vol. 44. - Suppl. 1. - P. 103-104.
45. Unimann D, Unimann S, Spiegel H.U. // 2001. - Vol. 14, № 1.-P. 31-45.
46. Wang L., Wang H.M., Zhang J.L. // Zhonghua Gan Zang Bing Za Zhi. - 2005. - Vol. 13, № 8. - P. 607-608.
47. Wang W., Xu Z., Lin L., et al. // Zhongua-Gan-Zang-Bing-Za-Zhi. - 2000. - Vol. 8, № 6. - P. 370-372.
48. Wang W.T., Lin L.N., Pan X.R., et al. // Zhongguo Wei Zhong Bing Ji Jiu Yi Xui. - 2004. - Vol. 16, № 1. -P. 49-51.
49. Xiong C, Hu H, Wei W., et al. // Zhongua Wai Ke Za Zhi. - 2000. - Vol. 38, № 4. - P. 297-299.
50. Yadav S.S., Howell D.N., Steeber D.A., et al. // Hepatology. - 1999. - Vol. 29, № 5. -P. 1494-1502.
51. Yamagami K., Yamamoto Y, Toyokuni S, et al. // Free Radic. Res. -2002. - Vol. 36, № 2. -P.1 69-176.
52. Yang J.C., Ji X.Q., Lin J.H., et al. // Di Yi Jun Yi Da Xue Xue Bao. - 2004. - Vol. 24, № 9. - P. 1019-1022.
53. Yoshidome H., Kato A., Miuyazaki M., et al. // Am. J. Pathol.-1999.-Vol. 155.-№ 4.-P. 1059-1064.
54. Yuzawa H., Eujioka H., Mizoe A., et al.// Hepatogastroenterology. - 2005. - Vol. 52, № 63. - P. 839-843.
55. Zeng S., Feirt N., Goldstein M., et al. // Hepatology. -2004. - Vol. 39, № 2. -P. 422-432.
56. Zhou W., Zhang Y., Hosch M.S., et al. // Hepatology. -2001.-Vol. 33, № 4.-P. 902-914.
© H.®. flpomeHKO, T.M. Ka^aHHHHa 2006
УДК: 616.36 - 089.166
воздействие радиочастотной термоабляции
НА СТРУКТУРУ ИНТАКТНОЙ И ИШЕМИЗИРОВАННОЙ
А.А. Должиков, В.Ф. Куликовский, Д.И. Набережнев, В.Д. Луценко
Белгородская областная клиническая больница, Белгородский государственный университет
Радиочастотная термоабляция (РЧА) в настоящее время считается среди методов лечения первичных и метастатических опухолей печени в нерезектабель-ных случаях одним из перспективных . Появление метода, разработка его технического обеспечения и
принципов использования насчитывают немногим более 10 лет . За время внедрения и использования РЧА сложились представления о ее преимуществах, ограничениях и отдельных факторах, влияющих на результат. Однако в ряду выполненных исследова-
Сотни поставщиков везут лекарства от гепатита С из Индии в Россию, но только M-PHARMA поможет вам купить софосбувир и даклатасвир и при этом профессиональные консультанты будут отвечать на любые ваши вопросы на протяжении всей терапии.
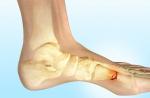
Двойное кровоснабжение (a. hepatica, v. porta) обуславливает редкость инфарктов в печени.
К инфаркту печени может привести нарушение кровотока во внутрипеченочных ветвях одного или обоих сосудов. Объективно об инфаркте печени говорят чаще всего в связи с уменьшением кровотока по a. hepatica, которая обеспечивает 50-70% необходимого тканям кислорода. Воротная вена отвечает за 65-75% притока крови к печени и за 30-50% оксигенации тканей. Артериальный приток крови тесно связан с венозным, так что общий поток крови через печень остается постоянным.
Принято говорить о равном участии артерии и вены в кровоснабжении (оксигенации) печени, хотя в экстремальных условиях возможно «перераспределение нагрузки». Механизм регулирования общего кровотока опосредован только печеночной артерией, воротная вена не может регулировать поток крови. Артериальный кровоток регулируется конкретным участками, осуществляющими выброс аденозина (мощного вазодилататора). Когда кровоток высок, аденозин быстро удаляется, что приводит к артериальной вазоконстрикции. И наоборот, когда портальный кровоток является низким, аденозин-опосредованный вазодилатационный эффект в артериальных сосудах необходим для увеличения общего кровотока.
Причины ишемии печени могут быть самыми разнообразными:
1. Системное понижение артериального давления:
— шок
(в 50% случаев);
— синдром компрессии чревного ствола.
2. Печеночная артерия. Локальное снижение кровотока:
— тромбоз (любой этиологии);
— эмболия (любой этиологии);
— перекрут добавочной доли печени;
— сдавление опухолью (крайне редко);
— манипуляции (хирургические и диагностические) как эндоартериальные (например, ангиография), так и собственно на тканях печени (например, радиоабляция опухоли); вторая после шока причина ишемии печени;
— травма артерии (включая разрыв).
3. Печеночная воротная вена:
— тромбоз и эмболия (любой этиологии);
— компрессия извне.
К ятрогенным повреждениям
относятся:
— артериальная гипотензия, вызывающая недостаточную перфузию внутренних органов и уменьшение портального кровотока;
— действие анестетиков;
— правожелудочковая или левожелудочковая недостаточность;
— тяжелая гипоксемия;
— реперфузионное повреждение печени.
— больные циррозом печени особенно чувствительны к повреждающему действию интраоперационной ишемии, так как ткань печени при этой патологии в большей степени зависит от кровотока по печеночной артерии.
Острая непроходимость печеночной артерии может быть возникать в результате тромбоза у больных с системными васкулитами (узелковый периартериит и другие), миелопролиферативными заболеваниями (полицитемия, хронический миелолейкоз). Она возникает при опухоли (сдавленне, прорастание, эмболия) атеросклерозе, воспалительных процессах в соседних органах, после травмы и т.п.
Причиной закупорки артерий может стать эмболия при инфекционном эндокардите и других заболеваниях сердца (особенно сопровождающихся мерцанием предсердий), при атероматозе аорты. Возможна случайная перевязка или травма печеночной артерии при операции.
Патогенез
Артериальное кровоснабжение печени изменчиво: варьируют сами ветви печеночной артерии и многочисленные анастомозы. Поэтому последствия окклюзии печеночной артерии зависят от ее места, коллатеральной циркуляции и состояния портального кровотока. Очень опасны окклюзии основного ствола, а также ситуации при одновременном нарушении кровообращения в системе воротной вены.
Инфаркты при окклюзии концевых ветвей и недостаточном коллатеральном кровотоке имеют сегментарный характер, они редко достигают в диаметре 8 см, хотя описаны случаи, когда некротизируется целая доля и даже желчный пузырь.
Морфологический картина . Инфаркт печени всегда ишемический с окружающей застойной геморрагической полоской. Субкапсулярпые поля не затронуты в связи с добавочным кровоснабжением. По периферии инфаркта портальные поля сохранены.
Тромбоз воротной вены (пилетромбоз) — редкое заболевание, идиопатический вариант встречается в 13-61% всех тромбозов воротной вены.
Этиология:
— прием контрацептивов;
— сдавление воротной вены извне опухолями, кистами;
— воспалительные изменения стенки воротной вены (при язвенной болезни, аппендиците, травмах брюшной стенки, живота);
— при циррозе печени;
— при интраабдоминальном сепсисе;
— при компрессии вены опухолью;
— при панкреатите и других воспалительных процессах в брюшной полости;
— как послеоперационное осложнение;
— при травмах;
— при дегидратации;
— при нарушении коагуляции.
Патогенез
Тромбоз воротной вены — это обычный тромбоз, который приводит к расширению вен на участках, расположенных перед местом образования тромба. Возможно сращение тромба со стенкой, его организация и реканализация.
При хроническом нарушении портального кровотока раскрываются шунты и формируются анастомозы между селезеночной и верхней брыжеечной венами с одной стороны, и печенью — с другой.
Если тромбоз воротной вены формируется не на фоне цирроза (острый тромбоз), то изменений в печени может не быть. Возможны тромбоэмболии вен печени, а также распространение тромбоза на ветви воротной вены с развитием геморрагических инфарктов селезенки, кишечника.
Source: diseases.medelement.com